Острые лейкозы (ОЛ) представляют собой гетерогенную группу опухолевых новообразований системы крови - гемобластозов, характеризующихся первичным поражением костного мозга морфологически незрелыми кроветворными (бластными) клетками с вытеснением ими нормальных элементов гемопоэза. Все острые лейкозы клональны, т.е. возникают из одной мутировавшей кроветворной клетки. [1]. Алгоритм диагностики острых лейкозов в современной клинике основан на пяти базовых компонентах: получение клинических данных, морфологический анализ бластов, цитохимический анализ бластов, иммунофенотипирование бластов, цитогенетическое исследование. В генезе лейкоза лежит нарушение созревания и пролиферации гемопоэтической стволовой клетки, вызывающее блок клеточной дифференцировки и запускающее экспрессию антигенов, которые в норме отсутствуют. Использование метода проточной цитометрии основывается на четком представлении об иммунофенотипических особенностях лейкемических клеток. Определение с помощью линейно-специфичных антигенов иммунологического фенотипа бластных клеток позволяет дифференцировать острые миелобластные лейкозы (ОМЛ), острые лимфобластные лейкозы (ОЛЛ) и смешанно-клеточные лейкозы [2].
Иммунофенотипическая диагностика ОЛ основывается на выявлении фенотипического профиля, практически не встречающегося в норме:
- лейкозов с коэкспрессией нескольких маркеров «чужих» линий;
- лейкозов с гетерогенными популяциями бластов;
- лейкозов с аберрантными фенотипами (характеризующиеся отсутствием одного или нескольких линейно-специфичных маркеров);
- лейкозов с асинхронной экспрессией антигенов (характеризующиеся одновременной экспрессией маркеров различных этапов дифференцировки).
Целью нашего исследования явилась оценка экспрессии лимфоидных антигенов на бластных клетках при различных вариантах острых миелоидных лейкозов в республике Азербайджан.
Материалы и методы. Нами было проанализировано 160 больных c диагнозом ОЛ. Среди больных было 55% мужчин и 45% женщин. Медиана возраста составила 55 лет (диапазон 18-75 лет). Разделение на исследуемые группы проводили в соответствии с вариантами лейкоза по ФАБ (франко-американо-британской) классификации. Всего исследовано 7 групп ОМЛ: М0, М1,М2, М3, М4, М5, М6.
Исследование проводилось на 3-х лазерном проточном цитометре FACS CANTO II (Beckton Discinson, USA), с использованием моноклональных антител меченых флюорохромами (FITC, PE, Pecy7, APC, APCcy7, PerCP, Violet) к поверхностным и внутриклеточным дифференцировочным антигенам лимфоидного и миелоидного рядов.
Миелоидные и моноцитарные: CD117, CD13, CD33, CD15, MPO, CD14, CD64, CD11B, CD11C;
Лимфоидный. В-клеточные: CD19, CD22, CD79a, CD10;
Т-клеточные: CD2, CD3, CD5, CD7, CD9, CD4, CD8, CD1a;
Мегакариоцитарные: CD41,CD61;
Эритроидные: Gly,CD71.
Подготовка проб. Материалом служили образцы костного мозга и периферической крови больных, стандартно стабилизированные К2 EDTA. Окраску клеток моноклональными антителами, производили с использованием лизирования с последующей отмывкой клеток.Анализ образцов проводили в программе Facs Diva. Положительной считали экспрессию маркера более чем на 20% клеток. В данном исследовании рассмотрен вариант острого лейкоза с экспрессией маркеров чужих линий, примером которой может быть коэкспрессия лимфоидных антигенов на поверхности бластных клеток у больных острыми миелоидными лейкозами. Выбор аномальных комбинаций антигенов опирался на фундаментальные исследования немецких авторов [3].
Результаты и их обсуждение. Аберрантная экспрессия антигенов дифференцировки чужих линий выявляется в большинстве случаев ОМЛ. При выявлении коэкспрессии маркеров разной линейной принадлежности, является необходимым определение суммарного фенотипа бластов для установления окончательного иммунофенотипического диагноза. Нами было проанализировано 160 случаев острого лейкоза в Азербайджане (рис. 1).
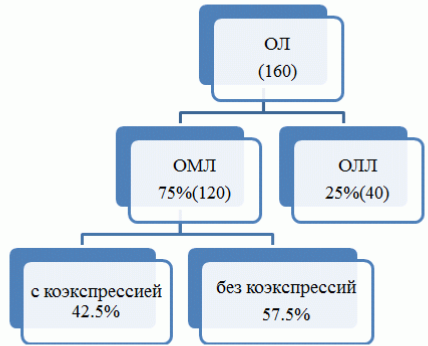
Рис. 1. Структура острых лейкозов в 2014-2015 г. в Азербайджане.
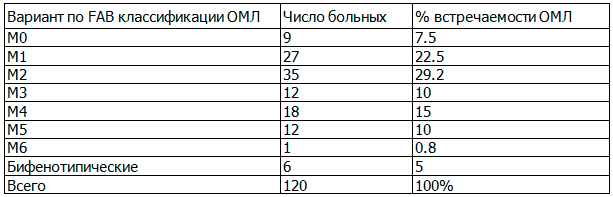
Варианты ОМЛ распределились следующим образом (табл. 1).
Таблица 1. Распределение вариантов ОМЛ в 2014-2015 г. в Азербайджане
Следующим этапом исследования явилось изучение коэкспрессии иммунофенотипических маркеров при остром миелоидном лейкозе. К наиболее частым вариантам аберрантного иммунофенотипа относится коэкспрессия Т-клеточного антигена CD7 у больных ОМЛ. Случаи с экспрессией CD7 на миелобластах характеризуются низкой частотой полных ремиссий и короткой продолжительностью жизни [4].
Объяснением данного клинического феномена может быть связь аберрантного иммунофенотипа с экспрессией гена множественной лекарственной устойчивости MDR1 [5] возможно, что агрессивное течение обусловлено возникновением лейкозного клона из ранних гемопоэтических предшественников. Вместе с тем негативное влияние аберрантной экспрессии CD7 на течение ОМЛ подтверждено не всеми исследователями. Предполагается, что более значимыми для прогноза могут быть другие клинико-лабораторные параметры, нежели иммунофенотипическая характеристика бластных клеток, и прежде всего молекулярно-генетические повреждения [6].
Подтверждением данного предположения может быть связь между кариотипом и иммунофенотипом. Так, у больных с транслокацией t(8;21) на поверхности миелобластов достаточно часто обнаруживается экспрессия антигенов CD34, CD56 и CD7, в случаях с трисомией хромосомы 8 - CD56, а при инверсии inv(16) - CD34 [7]. Аберрантная экспрессия CD7 встречается чаще у больных ОМЛ с промежуточными и неблагоприятными прогностическими вариантами нарушений кариотипа [8]. Анализ протоколов наших исследований выявил СD7 у 30 (25%) пациентов, при этом наиболее часто он встречался при ОМЛ М1-М2 вариантах (рис. 2).
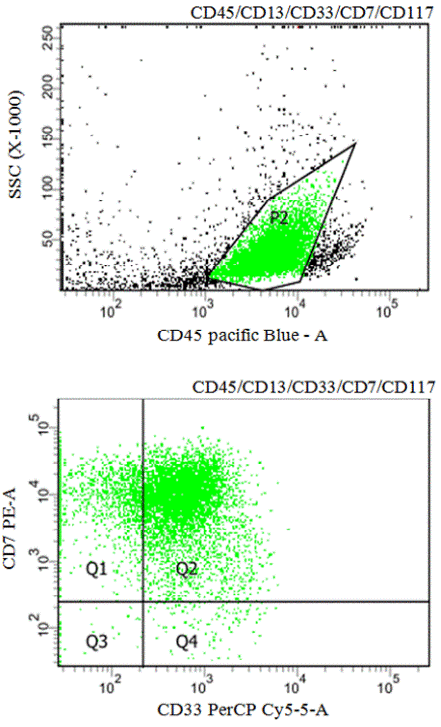
Рис. 2. Проточно-цитометрический анализ образца костного мозга больного ОМЛ М2 с коэкрессией СD7. На I-м дотблоте бокового светорассеяния и CD45 гейтирована бластная популяция. На II-м дотблоте в квадранте Q2 показаны клетки одновременно позитивные по двум антигенам CD7 и CD33.
Антиген CD2 чаще встречается при ОМЛ М3 и М4эоз. Одновременная коэкспрессия антигенов CD2 и CD19 коррелирует с более высокой частотой достижения ремиссий и более длительной 2х летней выживаемостью по сравнению с [CD2;CD19] негативными больными [9]. В нашем исследовании CD2 был выявлен у 12 пациентов (10%) и наиболее часто при ОМЛ М4 варианте. Антиген CD4 встречается на очень ранних стадиях развития клеток-предшественников, коммитированных в грануломоноцитарном и эритроидном направлении, а также на мембране моноцитов и макрофагов. Наличие антигена CD4 чаще обнаруживается у больных ОМЛ с аберрацией [11q23] и коррелирует с низкой выживаемостью [10]. В данном исследовании CD4 был выявлен у 6 пациентов (5%) с диагнозом ОМЛ М5. Ранее экспрессия антигена клеточной поверхности CD9 описана на стволовых кроветворных клетках, эозинофилах, базофилах [11]. Наличие СD9 встречается при всех вариантах ОМЛ, но чаще экспрессия CD9 отмечается при промиелоцитарном лейкозе (рис. 3). В результате наших наблюдений CD9 был выявлен у 12 пациентов (10%), причем почти все случаи ОМЛ М3 были позитивны по CD9.
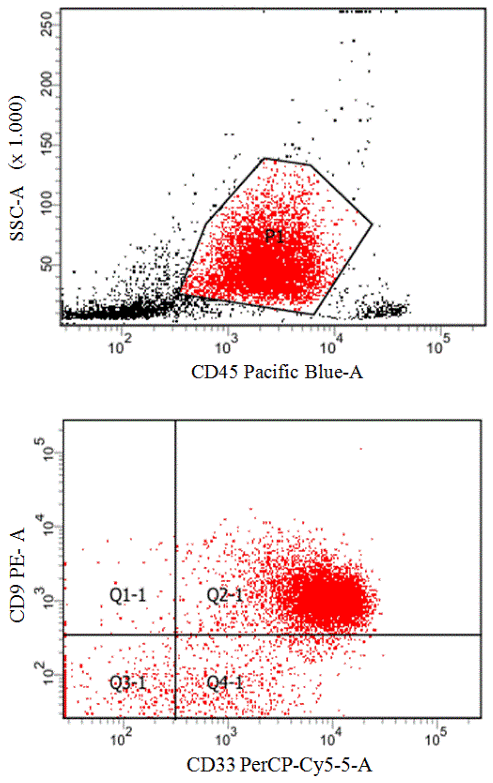
Рис. 3. Проточно-цитометрический анализ образца костного мозга больного ОМЛ М3v с коэкрессией СD9. На I-м дотблоте бокового светорассеяния и CD45 гейтирована бластная популяция. На II-м дотблоте в квадранте Q2-1 показаны клетки одновременно позитивные по двум антигенам.
Наличие антигена CD10 ассоциируется с более высокой частотой полных ремиссий и большой общей выживаемостью больных. В нашей практике СD10 был выявлен в 6 случаях (5%).
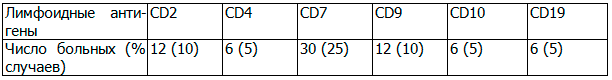
Обобщая данные протоколов наших исследований по экспрессии неродственных антигенов при миелоидных лейкозах, в 42.5% случаев ОМЛ была выявлена лимфоидная позитивность. Частота встречаемости антигенов, ассоциированных с В-линией была значительно меньше, чем антигенов специфичных для Т-линии (таблица 2).
Наиболее часто встречаемый неродственный маркер при ОМЛ М1-М2 вариантах был CD7, при ОМЛ М3 - CD9, при ОМЛ М4 - СD2 и CD4.
Самый высокий процент встречаемости среди лимфоидных маркёров, экспрессируемых одновременно с миелоидными, подтверждён для CD7. Экспрессия CD9 встречалась почти во всех случаях ОМЛ М3. В результате исследования была выявлена высокая частота экспрессии на миелоидных бластных клетках лимфоидных антигенов, из которых преобладающее значение имеют антигены асоциированные с Т-клеточной линией дифференцировки. Аберрантная коэкспрессия В-лимфоидных и миелоидных маркеров встречается в 5.5 раза реже, чем коэкспрессия Т-лимфоидных и миелоидных антигенов.
Таблица 2. Общая частота экспрессии Т-или В-клеточных антигенов у больных ОМЛ
По рекомендациям ВОЗ (2008), в диагностике гемобластозов методом проточной цитофлоуриметрии должны предусматриваться не только возможности диагностики первичного варианта опухоли, но и минимальной остаточной болезни (МОБ) [12].
Выявление у больных аберрантной экспрессии, позволяющей отличать бластные клетки от нормальных гемопоэтических клеток, дает возможность определения резидуальных лейкемическик клеток.
Исходя из вышеизложенного, необходимо отметить значимость выявления такого рода аномальных экспрессий для определения суммарного фенотипа бластов с целью улучшения иммунофенотипической диагностики острых лейкозов, более полной оценки ремиссии и риска развития раннего рецидива заболевания.
