Смертность от острого инфаркта миокарда (ОИМ) за последние 20 лет значительно уменьшилась благодаря оптимальному использованию медикаментозных средств, внедрению в клиническую практику методов реканализации инфаркт-обусловившей коронарной артерии (ИОКА) - тромболитической терапии (ТЛТ), перкутанной транслюминальной коронарной ангиопластики (ПТКА), стентирования [15]. Своевременное восстановление кровотока по инфаркт-связанной коронарной артерии является самым эффективным способом ограничения размеров некроза миокарда [11,15]. Вместе с тем, наряду с положительным влиянием (возобновление кровотока в зоне инфаркта), феномен реперфузии может сопровождаться увеличением повреждения миокарда (так называемое реперфузионное повреждение), что включает феномен no-reflow (невосстановленного кровотока на тканевом уровне из-за микроциркуляторных нарушений), станнинг («оглушение» миокарда), реперфузионные аритмии [6,13,16]. В настоящее время в формировании этого феномена главенствуют патофизиологические процессы с образованием избыточного количества свободных кислородных радикалов после восстановления коронарного кровотока (реперфузии) с активацией перекисного окисления липидов и неконтролируемое проникновение Са2+ и его избыточное накопление в кардиомиоцитах в результате повреждения сарколеммы перекисным окислением липидов после реперфузии [8].
В экспериментальных исследованиях неоднократно доказывалось, что реперфузионные повреждения миокарда, развивающиеся преимущественно по свободно-радикальному механизму, зачастую тяжелее ишемических [6,8,9,13]. Свободнорадикальному воздействию особенно подвержены полиненасыщенные жирные кислоты, что способствует активации ПОЛ, значительно изменяющему свойства мембран. Цитотоксическое действие продукции ПОЛ обусловлено, в первую очередь, их способностью активировать окисление фосфолипидов (активировать фосфолипазу, липоксигеназу, циклооксигеназу), клеточных и субклеточных мембран [1,4,6,9]. В процессе гиперактивации ПОЛ повреждается мембрана миокарда сарколеммы, которая приводит к избыточному поступлению ионов кальция из экстрацеллюлярного пространства внутрь кардиомиоцита. Этот феномен получил название кальциевого парадокса. Перегрузка кальцием кардиомиоцита приводит к гиперконтрактуре миокарда, дисфункции митохондрий, снижению продукции АТФ, гибели кардиомиоцита [4,6,8,9,16].
Активация ПОЛ в зоне ишемии и накопление продуктов деградации свободных радикалов (МДА, ДК) стимулирует свертываемость крови, увеличивает ее вязкость, усиливает агрегацию и адгезию тромбоцитов. Активация тромбоцитов происходит по циклооксигеназному пути окисление арахидоновой кислаты из мембранных фосфолипидов тромбоцитов [4,6,9,14]. В процессе активации тромбоцитов происходит выделение биологически активных веществ (тромбоксан, лейкотриены, активизирующий тромбоцитарный фактор) в кровоток, которые участвуют в локальной реакции воспаления. Кроме того, значение тромбоцитов в патогенезе реперфузионного повреждения миокарда обусловлено, их способностью закупоривать капилляры в зоне ишемии/реперфузии, что лежит в основе феномена «no-reflow» [13,14]. Тромбоциты активируются, и в дальнейшем запускается каскадная реакция агрегации, взаимодействия тромбоцитов, белков плазмы и клеток эндотелия, что приводит к образованию тромба. Данный процесс усугубляется высокой активностью вазоконстрикторных субстанций (тромбоксан, тромбин), которые активно высвобождаются в процессе агрегации тромбоцитов [14].
Стандартная медикаментозная терапия, направленная, в основном, на уменьшение потребности миокарда в кислороде или на увеличение его доставки за счет медикаментозной вазодилатации, не оказывает защитного влияния на миокард при проведении активной реперфузионной терапии. Есть все основания считать, что применения препаратов с кардиопротективным антиоксидантным действием, могут быть важнейшими звеньями патогенетической терапии у больных острым коронарным синдромом, подвергшихся реперфузионной терапии [1,5,7,16].
Целью данной работы явилось изучение влияния корвитина на агрегационное состояние крови и ПОЛ у больных острым коронарным синдромом с элевацией сегмента ST, перенесших чрескожную транслюминальную коронарную ангиопластику.
Материалы и методы исследования. В исследование было включено 50 больных с острым коронарным синдромом с подъёмом сегмента ST, поступивших в первые 6 часов от начала заболевания. Средний возраст больных составил 56,3±2,4 лет, из них 42 (84%) мужчин и 8 (16%) женщин. Критериями включения в исследование служили: характерная клиническая картина острого коронарного синдрома, наличие стойкого подъёма сегмента ST не менее, чем в двух смежных отведениях ≥2 мм. Из исследования исключались больные с ранее перенесенным ИМ, тяжёлой сердечной недостаточностью, полной блокадой левой ножки пучка Гиса, тяжёлыми сопутствующими заболеваниями, влияющими на исход заболевания, случаи, в которых не было достигнуто восстановление кровотока в инфаркт - связанной артерии II-III градации по шкале TIMI и отсутствовала тканевая реперфузия по данным ЭКГ. Методом случайной выборки (в порядке последовательного поступления) сформировано две группы больных, не имевших статистически значимых отличий по исходным клинико-анамнестическим данным и применявшейся базисной терапии. Основная (І) группа состояла из 26 человек, которым дополнительно к базисной терапии сразу после госпитализации внутривенно капельно в течение 30-45 мин вводили Кверцетин, согласно схеме разработанной Борщаговский ХФЗ (Украина): в 1-е сутки - внутривенно в дозе 0,5 г в 50 мл изотонического раствора натрия хлорида в течение 35-40 мин до проведения коронарной ангиопластики, через 2 и 12 ч; на протяжении 2-3 суток 2 раза в сутки в дозе 0,5 г с интервалом 12 ч; на 4-5-е сутки - 1 раз в сутки однократно в дозе 0,25 г (патент Украины № 127111); контрольную (ІІ) группу составили 26 больных, получавших базисное лечение. Базисное лечение включало гепарин, аспирин, клопидогрел, атенолол, эналаприл, изосорбида динитрат. При наличии показаний использовали диуретики, наркотические анальгетики, антиаритмические лекарственные средства. Обе группы были сопоставимы по исходным клинико-анамнестическим характеристикам (табл. 1).
Таблица 1. Клинико-анамнестические данные больных ОКС+ST, включенные в исследование
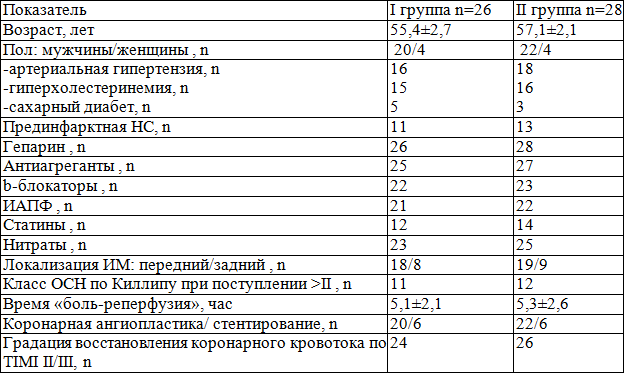
Всем больным была проведена первичная чрезкожная транслюминальная ангиопластика. Среднее время от начала симптомов заболевания до проведения ангиопластики составило 5,2±2,3 часа. Оценивали эффективность тканевой реперфузии по разрешению элевации сегмента ST на электрокардиограмме. Использовали анализ одного отведения с наибольшей исходной элевацией сегмента ST [12]. Критерием эффективности реперфузии при инфарктах задней стенки левого желудочка служило снижение сегмента ST на ≥70% от исходной величины, при инфарктах передней локализации — ≥50% [12]. Указанные пороговые величины применяли для сравнения трех электрокардиограмм, снятых перед началом ПТКА, на 60-й и 180-й минуте. ЭКГ исследование и суточное мониторинг проводили на аппаратах «Nihon-Kohden-CardioFax» (Япония) в 12 общепринятых стандартных отведениях с использованием дополнительных отведений в 3 отведениях по Нэбу. При оценке кровотока в инфаркт-связанной артерии (ИСА) и эффекта ПТКА применялась шкала TIMI. ПТКА проводилась по методу A. Gruentzig непосредственно после выполнения диагностической коронароангиографии.
Всем больным проводилось исследование состояния ПОЛ/АОС и агрегационная активность тромбоцитов - при поступлении, через 6 ч. после реперфузии, на 3 и 10-е сутки наблюдения. Интенсивность процесса ПОЛ оценивали по уровню продуктов – малонового диальдегида (МДА) в мембране эритроцитов по методу с модификации Л.И. Андреева в тесте тиобарбитуровой кислотой [3]. О состоянии АОС судили по активности компонентов первичной защиты – ферментов супероксиддисмутазы (СОД) и каталазы (КТ) методом Дибининой Е.Е. на спектрофотометре СФ-46 (Россия) [2].
Исследование агрегационной способности тромбоцитов проводили фотометрическим методом Born [10] на аппарате анализатора агрегации тромбоцитов АТ-02 (Россия). В качестве индуктора агрегации использовался раствор АДФ в пороговой концентрации 1*10 (-6) моль/л, позволяющий оценить первичную (обратимую) агрегацию. Оценивали наличие спонтанной агрегации - увеличение светопропускания более 10% до добавления в кювету индуктора агрегации, латентный период – время в секундах с момента внесения индуктора агрегации до начала увеличения светопропускания, скорость агрегации на 30-й секунде 1-й волны (%/мин) – изменение светопропускания плазмы в течение 30 секунд после добавления агрегирующего агента, по отношению к максимальному светопропусканию безтромбоцитарной плазмы, степень агрегации (%) – отношение максимального коэффициента светопропускания плазмы между моментом внесения индуктора агрегации и моментом прекращения изменения коэффициента пропускания к коэффициенту светопропускания безтромбоцитарной плазмы. Также исследовалась агрегация тромбоцитов и ПОЛ/АОС, представители контрольной группы. Контрольную группу составили 20 здоровых добровольцев (ЗД), 17 (85%) мужчин и 3 (15%) женщин без признаков патологии сердечно-сосудистой системы в возрасте 53,4±4,68 лет, сопоставимых по полу, возрасту и весу с исследованной группой. Для статистического анализа результатов исследования использовалась программа Microsoft Office Excel 2003. Данные представлены как среднее значение ± стандартная ошибка (М±m). Для сравнения средних значений использовался t-тест Стьюдента. Различия считались достоверными при уровне значимости р<0,05.
Результаты исследования. При поступлении у больных обеих групп наблюдался более чем 2-х кратное увеличение МДА (16,51±2,14 и 16,91±1,21 мкмоль/мгЭрт, р>0,05) , и снижение активности АОС (СОД- 10,2±2,41 и 11,12±2,82 ЕД/мг.эр, Каталаза- 3,04±2,45 и 3,81±1,72 ЕД/мг.эр.). Между группами, показатели МДА и АОС исходно значительных различия не было, р>0,05.
Достижение успешной реперфузии миокарда, сопровождалось увеличением концентрации МДА у всех больных исследуемых групп через 6 часов после ПТКА. У пациентов, получавших корвитин (I гр.), пик концентрации МДА был значительно меньше, чем в контрольной группе (IIгр.); 26.41±2.11 против 35.5 ±1.41 нмоль/мг белка, соответственно (р<0.005), и угнетение активность СОД было более выражено во II группе, абсолютные значения уменьшался до 7.01±1.78 Ед.акт/мг белка (р<0.05), но в I группе, уменьшение активности СОД не достигало статически значимого показателя (9.23±1.6, р>0.05 с исходным, р<0.05, между группами). В динамике, достоверное различие этих показателей сохранялось на протяжении всего периода наблюдения (10 сут). На 3-и сутки наблюдения отмечалось достоверное уменьшение МДА в обеих группах, однако в I группе наблюдалось более выраженное динамика, по сравнению с II группой ( -44.3% vs -33.5%, р<0.05), также отмечалось увеличение активности АОС в обеих группах, с достоверно выраженной динамикой в I группе относительно II (48.1% vs 30.2%, р<0.01). Параллельно, наблюдается достоверное различие интенсивности динамики увеличения КТ (30% в I группе vs 21.1% во II группе, р<0.05). К 10 суткам наблюдения, субнормальные показатели МДА отмечались у больных I группы (р>0,05), в контрольной группе МДА остается достоверно высокой по сравнению с нормой, соответственно выше, чем в I группе (на 58%, р<0.001). На 10 сутки наблюдения активность АОС (СОД) увеличилась в обеих группах, с тенденцией статически значимого увеличения относительно нормы, при этом активность СОД в I группе не была статически значимой по сравнение с ЗД. Абсолютные показатели между группами достоверно различались (20.86±1.16, во II группе vs 17,47±1,07 Ед. акт/мг белка, в I группе, р<0.05). Такая высокая активность СОД во II группе является компенсаторной реакцией АОС, как ответ на еще продолжающуюся гиперактивность ПОЛ.
Таблица 2. Динамика показатели ПОЛ/АОС стационарного периода наблюдения
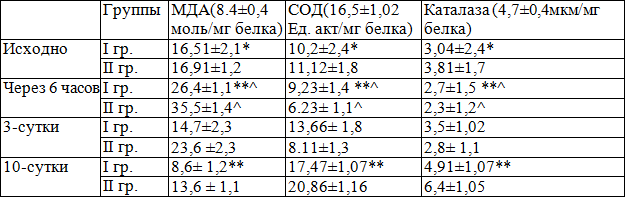
Примечание: статические различия между группами * - р>0.05; ** - р<0.05; ^ - р<0.05, статические различия с исходным состоянием
Исходные данные агрегационной активности тромбоцитов (ААТ) при индуцировании пороговых концентраций (1мкМ) АДФ показали высокую агрегационную активность тромбоцитов в обеих группах исследования. Исходно у 8 (30.7%) больных в I группе и у 9 (32.1%) больных во II группе наблюдалась II волна агрегации с развитием необратимой агрегации тромбоцитов при использовании пороговых концентраций индуктора. Это свидетельствует о повышенной функциональной активности Тр и готовности к секреции гранул АДФ при воздействии меньших, чем физиологических стимулов. Исходно обе группы были сопоставимы (статистические различия р>0.05).
Таблица 3. Показатель индуцированной АДФ-агрегации тромбоцитов в исследуемых группах через 6 часов после ПТКА (M± m)
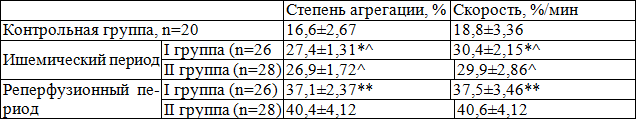
Примечание: * - р>0,05, достоверность показателей между группами, ** - р<0,05; ^ - р<0,01, достоверность различия с контролем
После реканализации инфаркт-связанной артерии (ИСА) установлено увеличение ААТ у всех больных в исследуемых группах. В реперфузионном периоде, степень и скорость АДФ-индуцированной агрегации у пациентов I группы увеличивалась на 35% (p<0.05) и 23% (p<0.05), соответственно, аналогичные показатели более выраженно увеличивались во II группе, в которой динамика составила 50% (p<0.005) и 36% (p<0.05, с исходным и p<0.01, с I группой). В динамике на 3 и 10 сутки в обеих группах достоверно уменьшается скорость и степень агрегации Тр, сохраняется достоверное различие соотношения показателей. К концу 10 суток степень и скорость агрегации у пациентов I группы были сопоставимы с показателями, характерными для ЗД, в то время как во II группе эти показатели были статически значимо больше, чем в I группе. На 10 сутки у 1 (3.84%) больных в I группе и у 5 (17.85%) больных во II группе наблюдалась II волна агрегации с развитием необратимой агрегации тромбоцитов. Это свидетельствует об уменьшении функциональной активности Тр и секреции гранул АДФ в обеих группах с более позитивным эффектом у больных I группы.
Обсуждение. Результаты нашего исследования показали значительное нарастание степени агрегации тромбоцитов и ПОЛ после реперфузии, по сравнению с ишемическим периодом. В клинических и экспериментальных исследованиях [6,13,14] показано, что причинами выраженного нарастания агрегационной активности тромбоцитов в постишемическом реперфузионном периоде являются: гипероксия миокарда ("кислородный парадокс") с интенсификацией перекисного окисления липидов и повреждением мембран клеток, перегрузка клеток Са2+ ("кальциевый парадокс"). Полученные нами результаты позволяют подтвердить факт, что в прогрессировании некроза миокарда при возобновлении кислородного снабжения после перенесенной ишемии значительную роль играет агрегационная активность тромбоцитов, а также усугубление их в связи с формирующейся антиоксидантной недостаточностью, усилением процессов ПОЛ. Это соответствует мнению других авторов [1, 6, 7, 9,16]. В нашем исследовании раннее применение корвитина, у больных I группы, до и после проведения реперфузии, достоверно уменьшало реперфузионный период активности ПОЛ, что проявлялось в уменьшении пика концентрации МДА и степени агрегации тромбоцитов. Антиоксидантный эффект препарата привел к быстрой нормализация МДА и активности СОД у больных I группы, что, возможно, связано с уменьшением гиперактивности ПОЛ реперфузионного периода миокарда. Результаты исследования согласуются с исследованием А.А. Мойбенко и соавт. [5]. Авторы показали на основании изучения динамики МДА, что уменьшение интенсивности ПОЛ, после применения корвитина у больных ОКС, уменьшает реперфузионные нарушения агрегации тромбоцитов, предупреждают феномен «no-reflow» в коронарных сосудах, улучшают гемодинамику, уменьшают объем некротизированного миокарда и оказывают противоаритмическое действие.
Так, в основной (I) группе больных, получавших корвитин, после реперфузии степень увеличения процессов ПОЛ и агрегации Тр была меньше по сравнению с контрольной (II) группой, также активность АОС в I группе после реперфузии прогрессивно увеличивалась, а вo II группе активность АОС после реперфузии угнеталась с гиперактивным процессом ПОЛ, что свидетельствует о положительном влиянии корвитина на ПОЛ, тромбоцитарный гемостаз у больных ОКС+ST, подвергшихся первичной коронарной ангиопластике.
Выводы. Таким образом, раннее назначение корвитина, предотвращает негативные последствия реперфузионной терапии, уменьшая агрегацию тромбоцитов и процессов ПОЛ у больных острым коронарным синдромом с элевацией сегмента ST.
