Введение. Ишемическая болезнь сердца (ИБС) - одна из ведущих причин смертности и инвалидизации населения в большинстве стран мира. Особое положение в общей структуре ИБС занимают больные, перенесшие инфаркт миокарда (ИМ). В результате гибели кардиомиоцитов при инфаркте миокарда геометрия полости левого желудочка (ЛЖ) и претерпевает ряд изменений, которые получили название «постинфарктное ремоделирование ЛЖ». Несмотря на наличие научных работ [1,2,4], посвященных разным аспектам процесса ремоделирования левого желудочка, вопросы адаптации миокарда, взаимосвязи структурно–геометрических и функциональных изменений, сегментарной кинетики все же изучены явно недостаточно. Немного сведений и о структурно-функциональных изменениях в аорте у пациентов, перенесших ИМ.
Цель исследования: сравнение структурно-функциональных показателей сердца и аорты у больных с впервые возникшим ИМ в зависимости от объема поражения.
Материалы и методы исследования. Проведено одномоментное обследование 90 больных инфарктом миокарда в первые трое суток от момента развития заболевания. Критерии включения: достоверный инфаркт миокарда, диагностированный в соответствии с критериями ВНОК [3]. Всем больным проводилось обследование и лечение в соответствии с национальными рекомендациями ВНОК по диагностике и лечению больных острым инфарктом миокарда [3]. Структурно-функциональные показатели сердца и аорты исследованы ультразвуковым методом на аппарате «LogicBook XP» (General Electric, USA). При эхокардиографическом исследовании оценивали степень нарушения сократимости с использованием 16-сегментарной модели ЛЖ. Если сегмент находился в состоянии нормокинеза, ему присваивали 1 балл, при гипокинезе – 2 балла, при акинезе – 3 балла, при дискинезе – 4 балла. Затем рассчитывали индекс нарушения локальной сократимости, как среднее арифметическое. Одновременно с проведением ЭхоКГ из вены пациентов забирали кровь для определения сывороточных уровней матриксной металлопротеиназы 9 типа (MMP-9), тканевого ингибитора матриксных металлопротеиназ 1 типа (TIMP-1).
Результаты и обсуждение. Проведен анализ данных пациентов с первым ИМ (63 человека, 70% от обследуемых), которые разделены на 2 группы в зависимости от индекса нарушения локальной сократимости (ИНЛС). В 1-ю группу вошел 31 пациент (19 мужчин, средний возраст 62,03±2,40 года) с ИНЛС < 1,5 (среднее значение 1,21±0,03), во вторую группу 32 человека (20 мужчин, средний возраст 63,13±2,47 лет) с ИНЛС > 1,5 (среднее значение 1,8±0,05). Группы были сопоставимы по полу, возрасту, уровню АД (122,19±2,39/77,45±2,02 мм рт.ст. и 120,48±2,91/75,14±2,11 мм рт.ст., р>0,05) и величине ЧСС (в первой группе 71,39±2,11 уд/мин; во второй – 73,97±2,61 уд/мин, p>0,05). Больные 1-й группы имели достоверно больший индекс массы тела (ИМТ) (29,15±0,65 кг/м2 против 25,99±0,64 кг/м2, р=0,001).
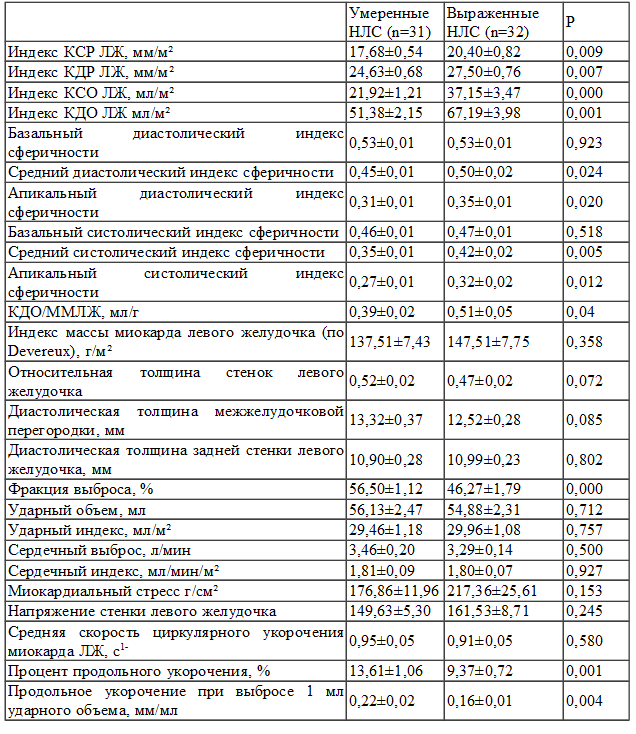
В табл. 1 приведены структурно-функциональные показатели, левого желудочка обследованных. Пациенты второй группы имели большие индексированные значения как линейных размеров, так и объемов ЛЖ в систолу и диастолу. Причем наиболее выраженное увеличение полости происходило на апикальном и среднем уровнях ЛЖ, что подтверждается диастолическими индексами сферичности на соответствующих уровнях. Полученные данные соответствуют представлениям о постинфарктном ремоделировании ЛЖ, при котором снижение сократительной способности, отраженное в ИНЛС, компенсируется увеличением полости камеры и ее сферификацией.
Проведена оценка типов ремоделирования ЛЖ в группах. За нормальные значения принимали ИММЛЖ < 125 г/м2 и относительную толщину стенок < 0,45. В обеих группах средние значения индекса массы миокарда ЛЖ, соответствуют гипертрофии и достоверно не отличаются. При этом в обеих группах, практически с одинаковой частотой встречается концентрическая гипертрофия (48,39±9,12% в первой группе, 50,00±8,98% во второй, р=0,900). У пациентов с умеренными нарушениями локальной сократимости несколько чаще встречается концентрическое ремоделирование (29,03±8,29% против 15,63±6,52%, р=0,207), а у больных с высоким ИНЛС – эксцентрическая гипертрофия (28,13±8,08% против 12,90±6,12%, р=0,140).
Несмотря на представленные выше структурные изменения, не было выявлено достоверных отличий в таких показателях, характеризующих функцию ЛЖ, как ударный объем, ударный индекс, сердечный выброс и сердечный индекс.
Таким образом, в раннем постинфарктном периоде, у обследуемых пациентов основным компенсаторным механизмом для сохранения достаточного объема кровообращения, согласно закону Франка-Старлинга, являлась дилатация полости ЛЖ.
При оценке диастолической функции ЛЖ (рис. 1) выявлено, что в обеих группах преобладал 1 тип диастолической дисфункции. Во 2 группе не было пациентов с сохраненной диастолической функцией, а в 1 группе – с рестриктивным типом дисфункции. В 1 группе было достоверно больше пациентов без нарушения диастолической функции (р=0,005). Во второй группе чаще встречались пациенты с псевдонормальным типом дисфункции (р=0,001).
Таблица 1. Структурно-функциональные показатели левого желудочка в зависимости от объема поражения миокарда
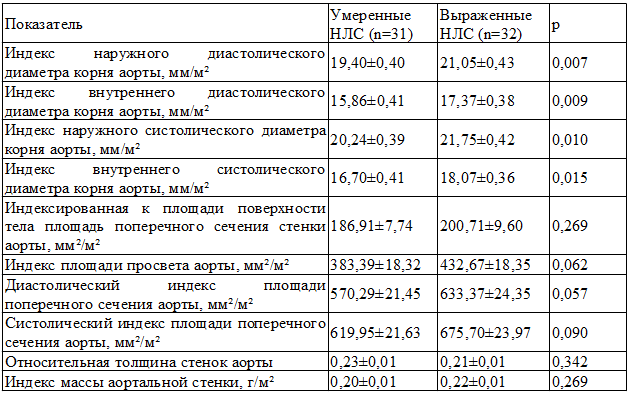
Структурные характеристики аорты представлены в табл. 2. Показано, что у лиц второй группы выше индексированные значения наружного и внутреннего диаметров как в систолу, так и в диастолу. Проведенный корреляционный анализ выявил прямую взаимосвязь между ними и ИНЛС в систолу (r=0,42-0,38, р=0,001-0,003) и диастолу (r=0,4-0,44, р=0,000-0,001), а также с площадью поперечного сечения аорты в обе фазы сердечного цикла (r=0,34, р=0,007) и с индексом площади просвета аорты (r=0,32, р=0,011). Можно предположить, что увеличение диаметра аорты является компенсаторным механизмом, направленным на облегчение выброса крови в острую стадию инфаркта миокарда.

Рис. 1. Частота встречаемости типов диастолической функции в группах
Таблица 2. Структурные показатели аорты
В последнее время появились исследования [5], доказывающие роль матриксных металлопротеиназ (ММР) в процессе постинфарктного ремоделирования миокарда ЛЖ. В нашем исследовании выявлено, что уровень MMP-9 коррелирует с ИНЛС (r=0,35, p=0,024) и у пациентов с выраженными нарушениями локальной сократимости достоверно выше (в первой группе 70,99±6,02 нг/мл, во второй – 94,32±6,27 нг/мл, р=0,011). Причем уровень ММР-9 коррелирует с количеством пораженных сегментов (r=0,33, p=0,030), но не выявлено связи со средней (функциональной) глубиной поражения сегмента. С количеством пораженных сегментов коррелирует (r=0,39, p=0,010) и тканевой ингибитор матриксных металлопротеиназ 1 типа (TIMP-1).
Таким образом, пациенты с более выраженными нарушениями локальной сократимости имеют меньший, в сравнении с пациентами с умеренными нарушениями, индекс массы тела. Значительное снижение систолической функции приводит у них к более выраженной, быстроразвивающейся дилатации ЛЖ, а также к увеличению просвета аорты. Повышение ИНЛС ассоциируется с более выраженными нарушениями диастолической функции ЛЖ. С площадью поражения ЛЖ связано повышение сывороточного уровня MMP-9. В раннем постинфарктном периоде увеличение полости ЛЖ является наиболее важным компенсаторным механизмом, позволяющим поддерживать систолическую функцию сердца.
