Соединительной ткани принадлежит существенная роль в обеспечении нормального функционирования сердечно-сосудистой системы. При дисплазии соединительной ткани (ДСТ) большое внимание в литературе уделено изучению морфофункциональных особенностей сердца, в частности клапанного аппарата [3-5,7]. Однако состояние сосудистой системы исследовано мало [9].
Важнейший компонент внеклеточного вещества соединительной ткани – коллаген определяет механические свойства сосудов, участвует в их ремоделировании [2]. По мнению некоторых авторов [5] врожденная неполноценность соединительной ткани может выступать одним из значимых звеньев патогенеза атеросклероза. Однако роль соединительнотканной дисплазии в формировании атеросклеротической бляшки остается неясной.
Для ранней диагностики атеросклеротического поражения сосудов и оценки риска кардиоваскулярных сосудистых осложнений используется широкий спектр неинвазивных инструментальных методов. Среди них особенно информативно определение толщины комплекса интима-медиа (КИМ) сонных артерий с помощью ультразвукового исследования с высоким разрешением [14]. Увеличение КИМ на каждые 0,1 мм сопряжено с нарастанием риска инфаркта миокарда на 11% [11]. Кроме того, большое значение имеет определение концентрации холестерина и липопротеидов в сыворотке крови.
Целью настоящей работы стало изучение структуры сонных артерий и распространенности основных факторов риска развития сердечно-сосудистых заболеваний у лиц с соединительнотканной дисплазией при различных уровнях артериального давления.
Материалы и методы. Обследовано 223 мужчин — работников локомотивных бригад эксплуатационного депо на станции Челябинск в возрасте от 20 до 54 (42,5±7,8) лет. Всем включенным в обследование проведено клиническое, фенотипическое, эхокардиографическое обследование, электрокардиография (ЭКГ), суточное мониторирование ЭКГ, ультразвуковое исследование сонных артерий, липидорамма. Фенотипическое и антропометрическое обследование проводилось с использованием специально разработанной нами карты, учитывающей основные признаки дисплазии, включенные в упомянутые выше международные критерии [8,10,12,13]. Артериальную гипертензию определяли в соответствии с критериями ВНОК (2008) как подъем систолического артериального давления (САД) 140 и более мм. рт. ст.; диастолического артериального давления (ДАД) 90 и более мм. рт. ст., выявленный не менее двух раз с интервалом не менее недели [1].
Всем обследованным проводилось ультразвуковое дуплексное сканирование сонных артерий с использованием аппарата Philips EnVisor С линейным датчиком 7,5 МГц (разрешающая способность 0,01 мм). При исследовании общих сонных артерий (ОСА) оценивалась толщина комплекса интима-медиа (ТИМ ОСА) в В-режиме по общепринятой методике (P. Pignolli). За нормальную величину ТИМ ОСА принимали значение 0,09 см и менее, границей перехода от утолщения стенки к атеросклеротической бляшке считали величину ТИМ более 0,13 см [1].
Кроме того, оценивались: внутренний диаметр (d) просвета ОСА в фазу диастолы с последующим вычислением показателя площади поперечного сечения КИМ (ППС КИМ), вычисляемом по формуле [ТКИМ+(d внутр/2)]2 - [(d внутр/2)]2, пиковая систолическая скорость кровотока (VpsОСА).
Толщина комплекса интима-медиа общей сонной артерии измерялась по стандартной методике в В-режиме по задней стенке (относительно датчика) проксимальнее бифуркации на 1,0 см.
У обследуемых проводился анализ липидного спектра сыворотки крови с определением концентрации общего холестерина сыворотки (ОХС), триглицеридов (ТГ) и липопротеидов высокой плотности (ХС ЛПВП) при помощи реагентов серии «Витал-Европа». Коэффициент атерогенности (КА) рассчитывали так: КА=(ОХС-ХС ЛПВП)/ХС ЛПВП (индекс Климова А.Н.).
Статистическая обработка материала проведена с использованием программ STATISTICA 8.0, Microsoft Excel 2003. Уровень доверительной вероятности был задан равным 95%. Анализ нормальности распределения параметров производили с помощью критерия Шапиро-Уилкса. Для данных с нормальным распределением вычисляли выборочное среднее (M), среднеквадратичное отклонение (σ). Для данных с распределением, не соответствующим нормальному, рассчитывали медиану (Me), 25% и 75% квартили. При сравнении выборочных средних для данных с нормальным распределением использован критерий Стьюдента, при невыполнении условия нормальности распределения – критерий Манна-Уитни. Для сравнения выборочных оценок долей использованы Χ2-тест и критерий Фишера. Во всех случаях использовали двусторонние варианты критериев. Различия считали статистически значимыми при р<0,05.
Результаты. Все лица, прошедшие обследование, были разделены на группы в зависимости от наличия ДСиФ и уровня АД. Доля лиц с ДСиФ в сочетании с нормальным уровнем АД составила 33,3% (74 человек) среди обследуемых. Лиц без признаков ДСТ в сочетании с нормальным АД было 36,3% (81 человек), лиц с ДСиФ в сочетании с АГ – 11,2% (25 человека), лиц без признаков ДСТ в сочетании с АГ – 19,2% (43 человека).
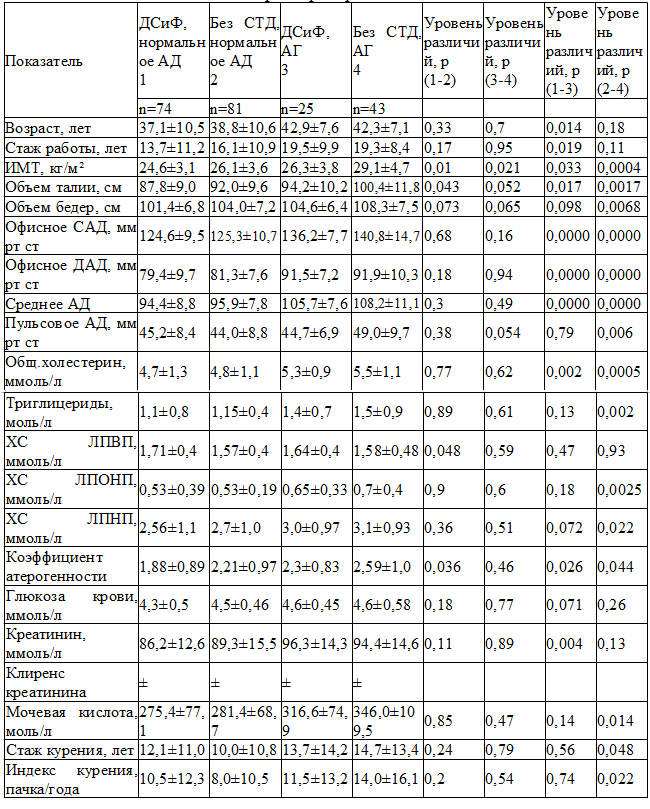
При анализе основных факторов риска развития ССЗ получены значимо меньшие показатели ИМТ (р=0,01), ОТ (р=0,043), коэффициента атерогенности (КА) (р=0,036) группе с ДСиФ с нормальным АД при сравнении с группой без ДСТ с нормальным АД. При этом уровень ЛПВП в группе с ДСиФ с нормальным АД был значимо выше по сравнению с группой без ДСТ с нормальным АД (р=0,048). По остальным показателям между этими группами различий не найдено.
В группе с ДСиФ с АГ выявлено значимо меньшее значение ИМТ при сравнении с группой без ДСТ с АГ (р=0,021).
Группы с признаками ДСиФ, но с разными уровнями давления значимо различались по возрасту, стажу работы, ИМТ, ОТ, уровням офисного САД, офисного ДАД, уровню среднего АД, уровню ОХ, коэффициенту атерогенности, уровню креатинина. В группе с ДСиФ с нормальным АД значение показателей было значимо меньше.В группе без ДСТ с нормальным АД были значимо меньше значение ИМТ, ОТ, ОБ, уровни офисного САД, офисного ДАД, среднего АД, пульсового АД, уровни ОХ, ТГ, ЛПОНП, ЛПНП, КА, уровень мочевой кислоты, стаж курения и индекс курильщика по сравнению с группой без ДСТ с АГ (табл. 1).
В группе с ДСиФ с нормальным АД среднее значение ТИМ ОСА было значимо меньше по сравнению с группой без ДСТ с нормальным АД (р=0,038). При этом частота встречаемости атером в ОСА в группе с ДСиФ с нормальным АД была значимо меньше по сравнению с группой без ДСТ с нормальным АД (р=0,008).
Таблица 1. Распространенность основных факторов развития сердечно-сосудистых заболеваний среди работников локомотивных бригад в зависимости от наличия диспластических синдромов и фенотипов и уровня АД по основным факторам риска
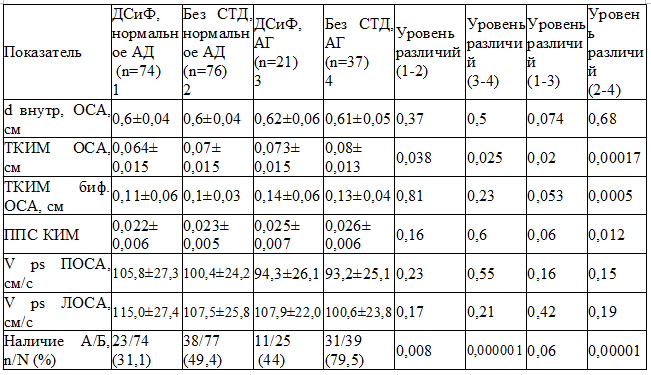
В группе с ДСиФ с АГ среднее значение ТИМ ОСА было значимо меньше по сравнению с группой без ДСТ с АГ (р=0,025). При этом частота встречаемости атером в ОСА в группе с ДСиФ с АГ было значимо меньше по сравнению с группой без ДСТ с АГ (р=0,000001).
В группе с ДСиФ с нормальным АД среднее значение ТИМ ОСА было значимо меньше по сравнению с группой с ДСиФ с АГ (р=0,02). При этом частота встречаемости атером в ОСА в группе с ДСиФ с нормальным АД значимо не различалось по сравнению с группой с ДСиФ с АГ (р=0,06).
В группе без ДСТ с нормальным АД среднее значение ТИМ ОСА было значимо меньше по сравнению с группой без ДСТ с АГ (р=0,00017). При этом частота встречаемости атером в ОСА в группе без ДСТ с нормальным АД было значимо меньше по сравнению с группой без ДСТ с АГ (р=0,00001) (табл. 2).
Таблица 2. Сравнительная характеристика структурно-функциональных показателей сонных артерий в зависимости от наличия диспластических синдромов и фенотипов и уровня АД
Обсуждение. При дисплазии соединительной ткани более характерно астеническое телосложение [3-5]. По данным нашего исследования получено, что среднее значение ИМТ в группе с ДСиФ с нормальным АД соответствовало норме (24,6±3,1), тогда как в остальных группах оно превышало 25,0 г/м2 и соответствовало избыточной массе тела. Таким образом, изменения, обнаруженные нами при анализе липидного спектра и ТИМ ОСА общих сонных артерий, могут быть объяснены значимыми различиями показателей ИМТ и ОТ в группах.
Кроме того, по данным литературы интима артерий благодаря особенностям строения основного вещества (гликозаминогликанов) обладает «высоким сродством» к апоВ, содержащим липопротеиды, и способна накапливать их в концентрациях, равных или превышающих таковые в плазме крови [6].
Свойства гликозаминогликанов при соединительнотканной дисплазии имеют большое значение, так, например, аккумуляция гликозаминогликанов, наряду с дегенерацией коллагена и фрагментацией эластина характеризует ремоделирование матрикса сердечных клапанов при пролапсе митрального клапана [3]. Возможно, количество и качество структурных гликопротеидов сосудистой стенки при дисплазии соединительной ткани выполняет протективную роль при формировании атеросклеротической бляшки.
Выводы
1. Толщина комплекса интима-медиа общих сонных артерий и частота встречаемости атеросклеротических бляшек в бифуркациях общих сонных артерий была значимо меньше в группах с признаками дисплазии соединительной ткани, как с нормальными уровнями артериального давления, так и при артериальной гипертонии.
2. Наличие диспластических синдромов и фенотипов может рассматриваться как протективный маркер, ассоциирующийся со снижением риска развития атеросклероза сонных артерий как в группах с нормальными артериальным давлением, так и при наличии артериальной гипертонии.
3. В группе с признаками дисплазии соединительной ткани в сочетании с нормальным артериального давления показатели липопротеидов высокой плотности были значимо выше, а коэффициента атерогенности – ниже по сравнению с группой без признаков дисплазии соединительной ткани с нормальным артериальным давлением. При этом в группах с артериальной гипертонией показатели липидного спектра значимо не различались.
4. Наличие артериальной гипертонии нивелирует различия между группами с диспластическими синдромами и фенотипами и без признаков дисплазии соединительной ткани, как при анализе структуры общих сонных артерий, так и показателей липидного спектра.
