Введение. Эпидемиологические исследования показывают, что риск развития инфаркта миокарда и сердечно-сосудистой летальности у лиц страдающих подагрой и бессимптомной гиперурикемией (БСГУ) выше, чем в популяции [1]. В ряде исследований представлено, что подагра и БСГУ, часто ассоциируются с артериальной гипертонией (АГ), дислипидемией, ожирением, инсулинорезистентностью, сахарным диабетом 2 типа [2]. Нарушения липидного обмена заключаются в развитии гипертриглицеридемии, снижении концентрации холестерина липопротеидов высокой плотности (ХС ЛПВП) и повышением холестерина липопротеидов низкой плотности (ХС ЛПНП), которые ассоциируются с риском развития атеросклероза [3]. По данным литературы частота АГ у больных подагрой колеблется от 36% до 54%, а в сочетании с метаболическим синдромом увеличивается до 72% [4-6].
С 1994 г. в клиническую практику был внедрен препарат лозартан (лозап), первый специфический блокатор АТ1 рецепторов, который получил высокую оценку как гипотензивное средство с отличной переносимостью и в настоящее время широко применяется во всем мире. Блокаторы ангиотензиновых рецепторов (БРА) устроняют прессорные эффекты циркулирующего в крови ангиотензина II, а также аутокринно-паракринные эффекты ангиотензина II, в избытке синтезируемого в тканях и провоцирующего развитие структурных изменений в сердце, сосудах, почках и, возможно, в других органах [7-10]. С 1999 г. блокаторы АТ1-рецепторов были официально включены в разряд лекарственных средств первого выбора для лечения артериальной гипертонии. При монотерапии эффективность лозартана сопоставима с другими современными гипотензивными средствами, то есть препарат обеспечивает коррекцию АД у половины пациентов с АГ. При сочетании подагры с АГ требуется комбинация антигипертензивных средств с гипоурикемической терапией. Использование лозартана в виде монотерапии обеспечивает оба этих эффекта и способствует оптимизации лечения данной категории больных. Лозартан предложен экспертами EULAR в качестве препарата выбора в лечении больных подагрой благодаря своему гипоурикемическому эффекту [11]. У больных подагрой в сочетании с АГ гипоурикемический эффект является рациональным дополнением к антигипертензивному эффекту при монотерапии. Урикозурическое действие лозартана может помочь уменьшить дозу аллопуринола или избежать его назначения у ряда больных, а также уменьшить количество назначаемых препаратов и увеличить приверженность пациентов к лечению [12].
Целью нашего исследования явилось сравнение эффективности и переносимости лозартана (лозапа) у больных подагрой и БСГУ на фоне АГ с сопутствующими факторами риска (избыточная масса тела, гипертрофия миокарда левого желудочка, гиперлипидемия) при лечении продолжительностью 12 недель.
Материалы и методы. В исследовании принимали участие 40 больных в возрасте от 43 до 72 лет (средний возраст 59,4±6,38 лет), преобладали женщины (62,5%). Все пациенты были разделены на две группы: I группу (n=20) составили пациенты с БГУ, II группу (n=20) больные подагрой. Диагноз подагры выставляли в соответствии критериям S.L.Wallace [13].
Клиническая характеристика больных, характер и частота факторов риска в группах представлены в табл. 1. В исследование не включали больных, ранее получавших гипоурикемическую терапию, с вторичными гипертониями, тяжелыми сопутствующими заболеваниями желудочно-кишечного тракта, печени и почек, сердечной недостаточностью, нестабильной стенокардией, сахарным диабетом, онкологическим анамнезом.
Таблица 1. Клиническая характеристика пациентов
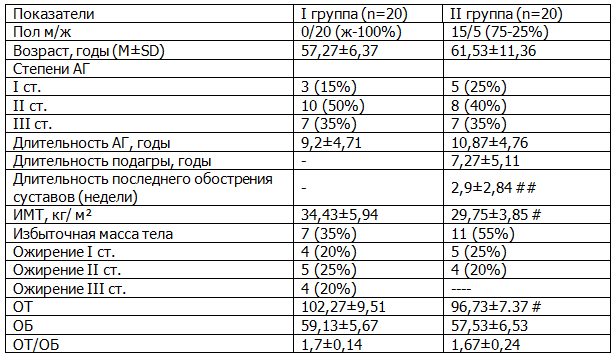
Примечание: данные представлены в виде средней (М) и стандартного отклонения (SD). Для сравнения двух независимых групп применялся критерий Манна-Уитни # - р<0,05, ## - р<0,001.
Из табл. 1 следует, что обе группы достоверно различались по половому составу. Среди больных подагрой преобладали мужчины (75%), а при БСГУ женщины (100%). У больных подагрой продолжительность заболевания колебалась от 0,5 до 13 лет (сред. 7,27±5,11 лет) с частотой обострения артрита в среднем 3 [1-5] случая в год. Преобладало рецидивирующее течение заболевания у 15 больных, хроническое течение у 5 (37,5%) больных. Количество пораженных суставов составило 4,0 [3-8], 20% пациентов имели внутрикожные и подкожные тофусы. На момент исследования больные находились в межприступном периоде (более двух недель после купирования артрита) и ранее не принимали антигиперурикемические препараты.
У больных I группы средняя длительность БСГУ составила 4,6±1,0 года, зачастую сочетаясь с остеоартрозом у 82% больных. Продолжительность АГ у больных I группы составила 9,2±4,71 года, II группе- 10,87±4,76 года. У больных обеих групп преобладала АГ II степени (40-50%), реже встречалась III степени - по(35%), еще реже I степени- (15% и 25%) соответственно в I и II группах.
Предшествующую гипотензивную терапию с недостаточным эффектом и нерегулярным приемом получали (96%) пациентов: ингибиторы АПФ - 65%, В-блокаторы - 20%, диуретики - 15%. За пять дней до применения лозартана гипотензивные средства были отменены.
Всем пациентам проводилось лечение лозартаном (Лозап ЗЕНТИВА, Чешская Республика) в дозе 50 мг/ сутки однократно утром. Если через две недели терапии снижение АД оказывалось недостаточным, доза увеличивалась вдвое. Длительность наблюдения составила 12 недель.
Исходно всем больным в обеих группах выполнялось антропометрическое обследование: рост, вес, индекс массы тела (ИМТ), окружность талии (ОТ), окружность бедра (ОБ), отношение ОТ/ОБ (табл. 1). Определение степени ожирения оценивалось согласно критериям ВОЗ. Выполнялось биохимическое исследование крови с определением уровня глюкозы, общего холестерина (ХС общий), холестерина липопротеидов высокой плотности (ХС ЛПВП), холестерина липопротеидов низкой плотности (ХЛ ЛПНП), триглицеридов (ТГ), индекса атерогенности (ИА), мочевины, креатинина, мочевой кислоты (МК) крови и суточная урикозурия.
Во время визитов больного исходно, через 2, 4, 8,12 недель лечения проводилось 3-4 кратное измерение АД (по методу Короткова) в положении сидя после 15 минутного отдыха, 3 раза с 3- минутными интервалами. На протяжении всего исследования пациенты осуществляли самоконтроль АД.
Всем пациентам было проводилось суточное мониторирование АД (СМАД) с помощью аппарата Schiller МТ-300, исходно и через 12 недель от начала терапии лозапом. Мониторирование проводилось с интервалом 15 минут днем и 30 минут ночью в течение 24ч. С исключением из анализа установочных измерений АГ. АГ диагностировалась при среднесуточных величинах систолического артериального давления (САД)>140 мм рт.ст. и диастолического артериального давления(ДАД)>80 мм рт.ст. в дневное время и САД>120 мм рт.ст., ДАД>70 мм рт.ст. в ночное время. Также оценивались суточный профиль АД, вариабельность САД (Вар.САД) и ДАД (Вар.ДАД), определялась величина утреннего подъема АД(ВУП), скорость утреннего подъема АД, индекс времени (ИВ) САД и ДАД.
За критерии эффективности антигиперурикемической терапии принимали нормализацию уровня МК в крови (целевой уровень< 360 ммоль/л), а гипотензивной терапии снижение уровня ДАД клинически не менее чем на 10% или на 10 мм рт.ст. и САД клинически на 15% или 15 мм рт. ст. от исходного уровня. Неудовлетворительным считалось снижение ДАД менее чем на 5 мм рт.ст., САД на 10 мм рт.ст. Целевым уровнем АД на фоне терапии считали АД < 140/90 мм рт.ст.
Статическая обработка данных проводилась с помощью программы Statistica 6.0 (Statsoft, США) Использовались непараметрические методы описательной статистики анализ по Вилкоксону, а для сравнения двух независимых групп применялся критерий Манна-Уитни. Результаты представлены в виде средней арифметической (М) и стандартного отклонения (SD). За статистически значимые принимались отличия при р< 0,05.
Результаты. Анализ антропометрических данных показал, что большинство (55 %) больных подагрой имели избыточную массу тела, 25% страдали I, 20% -II степенью, абдоминальной формы ожирения. В группе с БСГУ достоверно больше было больных с ожирением (65%), из них с III степенью -20%, также ОТ у них была достоверно больше (р<0,05) по сравнению со II группой.
До начала лечения у больных обеих групп показатели общего ХС, ИА и МК в крови достоверно отличались от нормальных (табл. 2), причем у больных подагрой достоверно выше был уровень МК крови 501,27±68,06 ммоль/л против 437,4±61,22 ммоль/л (р< 0,01) и уровень креатинина 100,67±29,95 ммоль/л против 88,69±13,98ммоль/л при БСГУ соответственно. Уровень общего ХС и ИА исходно был достоверно хуже у больных БСГУ. Повышение атерогенных фракций липидного профиля отмечалось у 80% больных с БСГУ и 65% больных подагрой, снижение ХС ЛПВП - у 73% и 60% больных, соответственно. При сравнении показателей ХС ЛПВП, ХС ЛПНП, ТГ различия по группам не были статистически значимыми.
Таблица 2. Динамика лабораторных показателей у больных обеих групп
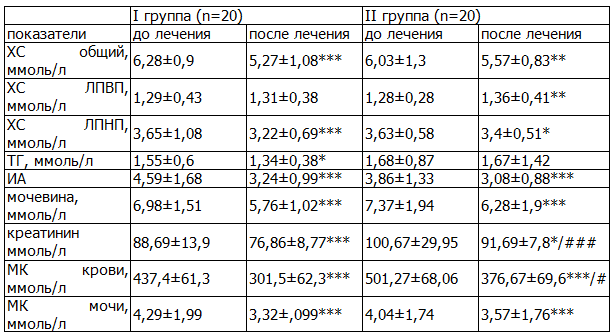
Примечания: данные представлены в виде средней (М) и стандартного отклонения (SD); * - р<0,05, ** - р<0,01, *** - р<0,001 (метод Вилкоксона). Критерий Манна - Уитни. # - р<0,05, ### - р<0,001.
Через 12 недель от начала лечения с использованием лозапа отмечалось достоверное снижение уровня МК крови до 301,47±62,31 ммоль/л в I группе и до 376,67±69,6 ммоль/л во II группе (табл.2). Целевого уровня МК достигло 85% больных I группой и 46% больных во II. При сравнении параметров липидного профиля у больных обеих групп отмечалось достоверно наиболее выраженное снижение уровня общего ХС, ИА. Также наблюдалась тенденция к снижению уровней ХС ЛПНП, ТГ и повышению ХС ЛПВП. Уровень сахара крови на фоне терапии не изменился, а креатинина снизился.
Динамика показателей СМАД у больных подагрой и БСГУ представлена в табл. 3, из которой следует, что исходно большинство показателей суточного профиля АД были достоверно выше нормальных значений. До применения гипотензивной терапии у пациентов I группы сред. САД (24) составило 152,13±17,1 мм рт.ст., сред. ДАД (24) 124,29±22,7 мм рт.ст., во II группе сред. САД (24) 147,67±28,39 мм рт.ст и сред. ДАД (24) 123,92±17,4 мм рт.ст., причем у больных подагрой отмечалось повышение большего количества показателей СМАД по сравнению с БСГУ. У пациентов II группы выявлялись более высокие показатели сред. САД и сред. ДАД в дневные и ночные часы по сравнению с I группой. Похожая закономерность отмечалась в отношении других параметров. Так, у больных подагрой достоверно выше были показатели Вар. САД и Вар. ДАД в дневные и ночные часы и ВУП САД (24); ВУП ДАД (24).
В качестве показателей нагрузки систолическим и диастолическим давлением использовался показатель ИВ который был повышен в обеих группах, наиболее выраженное достоверное повышение отмечалось ИВ ДАД в дневные часы.
Подъем АД в утренние часы оценивали по ВУП АД и скорости утреннего подъема (СУП) АД, которое является независимым фактором риска гипертрофии миокарда левого желудочка (ЛЖ). Во II группе по сравнению с I достоверно выше показатели ВУП САД(24), ВУП ДАД(24), а СУП ДАД(24) и СУП ДАД(24) были сопоставимы между группами.
Таблица 3. Показатели СМАД у больных БСГУ и подагрой
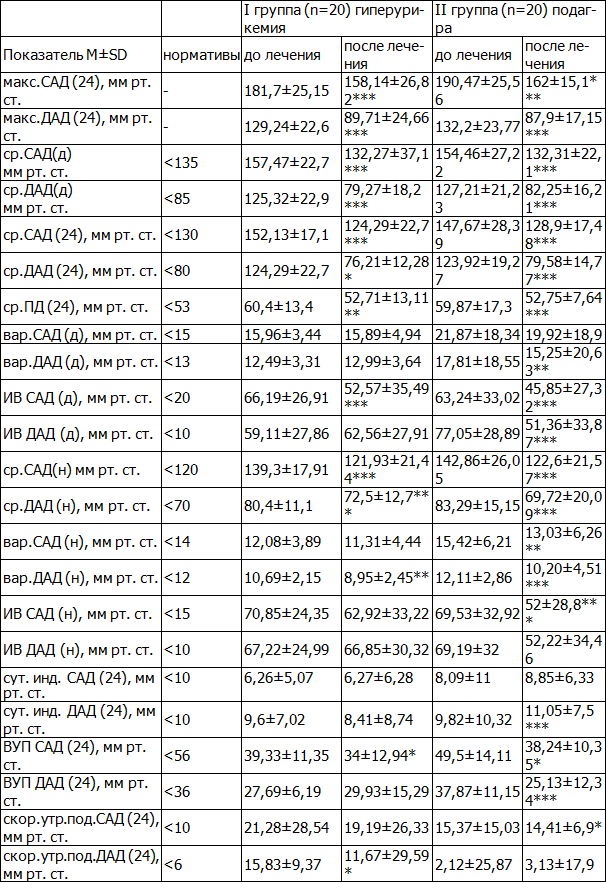
Примечание: данные представлены в виде средней (М) и стандартного отклонения (SD); * - р<0,05, ** - р<0,01; *** - р<0,001 (метод Вилкоксона).
По данным СМАД через 12 недель от начала терапии у больных обеих групп большинство параметров вернулись к нормальным значениям кроме ИВ САД , и ИВ ДАД в дневные и ночные часы , СУП САД(24) и СУП ДАД(24), причем значения этих параметров остались достоверно хуже у пациентов с БСГУ, по сравнению с больными подагрой (Таб.3). Так, сред. САД в I группе снизилось на 21% от исходного, сред. ДАД на 38% (р<0,01) ; во II группе на 17,5% и 37% ( р<0,01), соответственно. У больных I группой индекс времени систолической дисфункции (ИВ САД) уменьшился на 21,2% днем и 11,4% ночью ( р<0,01) у больных II группы на 28,6% днем и 24,6% ночью (р<0,001). Индекс времени диастолической дисфункции (ИВ ДАД) в дневные и ночные часы снизился на 12% и 1,5% (р<0,05) и на 33,8%-10% в I и II группах соответственно. В обеих группах также имелась сопоставимая тенденция к снижению СУП САД и ДАД. (табл. 3).
На рис. 1а,б показано, что исходно нарушения суточного профиля САД выявлялись в обеих группах. Доля пациентов с нормальным суточным профилем САД «дипперы» была выше в I группе (50%) по сравнению со II группой(25%), а во II группе преобладали «нон-дипперы» 50% против 35% из I группы. Также во II груп
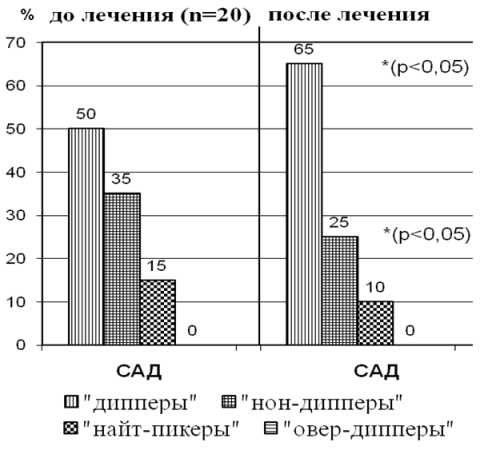
Рис. 1а. Нарушение суточного профиля САД до и после лечения у больных БСГУ.
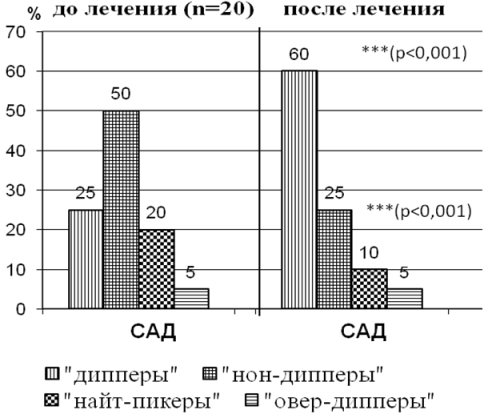
Рис. 1б. Нарушение суточного профиля САД до и после лечения у больных подагрой.
Через 12 недель от начала лечения у больных обеих групп, отмечалась положительная достоверная динамика с увеличением доли пациентов с нормальным суточным профилем: в I группе с 50% до 65%(р<0,05), а во II группе с 25% до 60% (р<0,001). Причем во II группе достоверно уменьшилось количество «нон-дипперов» и «найт-пиккеров» с 50% до 25% и с 15% до 10%, соответственно (р< 0,001), а в I группе отмечалась лишь тенденция к росту «дипперов», количество «нон-дипперов» тоже уменьшилось не значительно с 35% до 25%, «найт-пиккеров» с15% до10%. Количество «овер-дипперов» во II группе не изменилось.
Таким образом при монотерапии лозапом отличный гипотензивный эффект с коррекцией АД не выше 140/85 мм рт.ст. и хороший гипотензивный эффект с уменьшением ДАД не менее 10 мм рт.ст. был достигнут у 80% больных подагрой и 70 % при БСГУ. При этом у 33% пациентов с I группы и 40% II группы была эффективна монотерапия лозапом в дозе 50 мг/сутки, а у 37% I и 40% II группы доза была увеличена до 100 мг/сутки. У 30% больных с I группы и 20% II группы монотерапия была не эффективна, что требовало назначения дополнительных препаратов.
Обсуждение. Нами проведено сравнительное исследование эффективности монотерапии с использованием лозапа у больных подагрой и БСГУ в сочетании с АГ. В исследованиях, проведенных в последнее десятилетие показано, что гиперурикемия является существенным фактором риска сердечно-сосудистых заболеваний, так как повышает риск возникновения и прогрессирования АГ[14].
В связи свыше сказанным, возрастают требования к лечению подагры, отягощенной сочетанием с АГ и наличием других кардиоваскулярных факторов риска (мужской пол, нарушение липидного профиля, абдоминальная форма ожирения, гипертрофия левого желудочка, сахарный диабет 2 типа и др.), отражающих наличие у них высокого риска кардиоваскулярных осложнений [15]. Использование в виде монотерапии лозартана (лозапа), который обладает гипоурикемическим и антигипертензивным действием позволяет оптимизировать лечение больных подагрой и БСГУ ассоциированной с АГ.
Большое внимание в последние годы уделяется СМАД, которое позволяет установить истинные значения АД, улучшить возможности диагностики и контроля за проводимой терапией. СМАД является одним из основных методов контроля АД при проведении исследований в области АГ, а признанием его высокой клинической ценности явилось включение в международные и национальные рекомендации по ведению пациентов с АГ [16].
Важным фактором риска сердечно-сосудистых осложнений являются показатели систолической и диастолической нагрузки в течении суток, которые тесно связаны с индексом гипертрофии миокарда, диастолтческой функции ЛЖ, размерами левого предсердия [17,18].
В нашем исследовании « нагрузку давлением» оценивали по индексу времени (ИВ). По этому показателю мы определяли процент времени в течении которого величины АД превышали безопасный уровень. Показатели ИВ САД и ИВ ДАД в дневные и ночные часы в каждой из групп превосходили нормальные параметры более чем у половины обследуемых. Причем в процессе лечения было достигнуто достоверное снижение.
Было выявлено увеличение вариабельности САД и ДАД в дневное и ночное время, наиболее выраженное у больных подагрой, которое также достоверно уменьшалось на фоне лечения с использованием лозапа. Высокая вариабельность связана с более частым поражением органов мишеней и увеличением частоты сердечно-сосудистых осложнений [19].
Показано, что наибольшее число сердечно-сосудистых катастроф (нестабильная стенокардия, инфаркт миокарда, внезапная смерть, церебральный инсульт) приходятся на утренние часы особенно в первые 2 часа после пробуждения, что обусловлено повышенным АД в утреннее время[20,21,22]. В нашем исследовании повышение ВУП САД и ДАД чаще выявлялось у больных подагрой 60%, чем БСГУ 33%( р< 0,05). Через 12 недель монотерапии лозапом наблюдалось достоверное снижение этих показателей у больных обеих групп.
Анализ суточного профиля АД показал, что у больных подагрой и БСГУ происходит нарушение профиля САД и ДАД , но во II группе показатели суточного профиля были хуже по сравнению с I группой. Установлено, что недостаточное снижение АД и ночная гипертония («нон-дипперы» и «найт-пиккеры») значительно преобладали у больных подагрой, также в этой группе у части пациентов выявлено выраженное снижение АД в ночное время («овер-дипперы»). На фоне лечения лозапом увеличелось количество пациентов с нормальным суточным профилем («нон-дипперов») в I группе до 65%, а во II группе до 60%.
Таким образом наш клинический опыт применения монотерапии лозапа у больных подагрой и БСГУ на фоне АГ показал, что лечение привело к достоверному снижению уровня МК у больных обеих групп. Целевой уровень МК был достигнут у 85% больных I группы и 45 % II группы. Улучшились показатели липидного профиля: понизился до нормы уровень общего ХС, ХС ЛПНП, ТГ, ИА и отмечалась тенденция к увеличению ЛПВП, однако не достигнуто уровня статистической значимости.
Исследование показало, что лозап обладает достоверным антигипертензивным эффектом (с частотой ответа 90 % в I и 85% во II группах) характеризующийся нормализацией суточного профиля АД, снижением систолической и диастолической перегрузки, вариабельности АД. Следовательно, применение монотерапии с использованием лозартана (лозапа) в течении 12 недель было эффективным и показало целесообразность его использование с целью благоприятного влияния на показатели обмена мочевой кислоты, липидного профиля и нормализацию суточного профиля АД у больных подагрой и бессимптомной гиперурикемией.
