Введение. Эссенциальная артериальная гипертензия (АГ) или гипертоническая болезнь (ГБ) остается одной из важнейших медико-социальных проблем. По материалам обследования, проведенного в рамках целевой Федеральной программы «Профилактика и лечение АГ в Российской Федерации», распространенность АГ среди населения в 2009 году составила 40,8% (у мужчин – 36,6%, у женщин – 42,9%) [1]. Повышенный уровень артериального давления (АД) является важнейшим предиктором основных сердечно-сосудистых заболеваний – инфаркта миокарда и мозгового инсульта, определяющих высокий уровень инвалидизации и смертности. Немало исследований посвящено изучению состояния периферических сосудов как органа-мишени при АГ. Cосудистое ремоделирование, заключающееся в изменении эластических свойств стенки артерий, и нарушение функции микроциркуляторного русла (МЦР) являются важными компонентами патогенеза АГ, способствуют развитию и прогрессированию органной патологии [2,3,4,5]. Однако, данные о наличии и характере взаимосвязи поражения сосудов крупного и среднего калибра с микроциркуляторными расстройствами при АГ в современной литературе весьма немногочисленны и отрывочны.
Цель данного исследования - сопоставить характер нарушений эластических свойств сосудистой стенки и параметры микроциркуляции при ГБ II стадии с различными вариантами поражения органов-мишеней.
Материал и методы. В исследовании приняли участие 40 пациентов в возрасте от 31 до 60 лет (в среднем 47,5±1,3 года) с гипертонической болезнью II стадии (далее – группа АГ); длительность заболевания составила в среднем 3,8±0,5 года. В зависимости от варианта поражения органов-мишеней они были разделены на две подгруппы: с гипертрофией левого желудочка (ГЛЖ, n=24) и с микроальбуминурией (МАУ, n=16). До включения в исследуемую группу пациенты не получали регулярной гипотензивной терапии. В контрольную группу вошли 30 практически здоровых мужчин и женщин в возрасте 30-57 лет (в среднем 44,4±1,6 года) с нормальным АД, по полу и возрасту сопоставимые с исследуемыми.
Критериями исключения из исследования являлись: симптоматические АГ, сердечная недостаточность, пороки сердца, облитерирующие поражения магистральных сосудов, экстрасистолы высоких градаций и мерцательная аритмия, болезнь и синдром Рейно, заболевания системы крови, лихорадка, поражения кожи в месте наложения датчика.
Пациентам с АГ было проведено общеклиническое обследование в соответствии с Рекомендациями ВНОК [6]. Эластические свойства сосудов оценивали методом определения скорости распространения пульсовой волны (СРПВ) с помощью сфигмографической приставки аппаратно-программного комплекса «Полиспектр-12» (ООО «Нейрософт», г.Иваново), исследовали СРПВ по сосудам эластического (СРПВэ, каротидно-феморальная сфигмограмма) и мышечного типов (СРПВм, каротидно-радиальная сфигмограмма), их соотношение, а также модули упругости (Еэ и Ем) [7].
Параметры микроциркуляции определяли методом лазерной допплеровской флоуметрии (ЛДФ) с использованием компьютеризированного одноканального лазерного анализатора капиллярного кровотока «ЛАКК-02» – исполнение 1 (НПП «Лазма», Россия). Исходная запись ЛДФ-граммы осуществлялась в положении пациента лежа на спине в течение 10 минут с соблюдением условий стандартизации методики [8], затем выполнялись функциональные пробы. Датчик располагался в области задней (наружной) поверхности левого предплечья в точке, находящейся выше основания шиловидных отростков локтевой и лучевой костей на 3-4 см по срединной линии, поскольку именно эта область является зоной сердца Захарьина-Геда [9].
Показатели микроциркуляции рассчитывались исходно в покое, а также по результатам функциональных проб (окклюзионной, постуральной, пробы с задержкой дыхания) согласно общепринятой методике [10]. Анализ амплитудно-частотного спектра проводился с использованием алгоритма вейвлет-преобразования. Оценивали следующие характеристики базального кровотока: ПМ – показатель микроциркуляции - величина среднего потока крови в интервалах времени регистрации (перф.ед.); СКО (σ) – среднее колебание перфузии относительно ПМ (перф.ед.); Кv – коэффициент вариации (%); амплитудно-частотный спектр колебаний кровотока, отражающий функционирование активных и пассивных механизмов регуляции (эндотелиальный, миогенный, нейрогенный компоненты тонуса микрососудов, респираторный и кардиальный ритмы колебаний); внутрисосудистое сопротивление микроциркуляторного русла (ВСС, %); индекс эффективности микроциркуляции (ИЭМ, %).
В процессе анализа результатов окклюзионной пробы (ОП) рассчитывался резерв капиллярного кровотока (РКК) по формуле: РКК=ПМmax / ПМ • 100%, где ПМmax – пиковый ПМ, возникающий после окклюзии. На основании исходного ПМ и РКК определялся гемодинамический тип микроциркуляции (ГТМ), являющийся комплексным показателем для итоговой оценки микроциркуляторных нарушений и позволяющий оценить резервные возможности микрососудистого русла у больных АГ.
Статистическая обработка результатов проводилась с использованием прикладного пакета программ «Statistiсa 6.0 for Windows». Данные в таблицах и тексте представлены в виде: среднее арифметическое и стандартная ошибка среднего – М±m. Достоверными считались различия показателей при р<0,05.
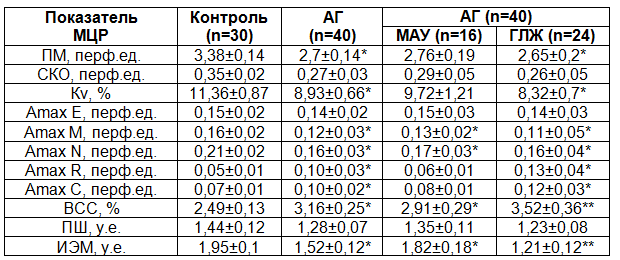
Результаты и обсуждение. При оценке интегральных показателей базального кровотока у пациентов с АГ (таблица 1) отмечалось достоверное снижение ПМ, свидетельствующее, вероятно, об ухудшении тканевой перфузии. Изменчивость кровотока в микроциркуляторном русле, которая обеспечивает адаптацию системы микроциркуляции к постоянно меняющимся потребностям тканей, также имеет значимые отклонения, что проявляется уменьшением коэффициента вариации Кv в основной группе. Эта особенность косвенно отражает возможное снижение эффективности функционирования активных механизмов регуляции микрокровотока при АГ [10].
Анализ амплитудно-частотного спектра колебаний перфузии позволяет получить более детальную информацию о состоянии функции микроциркуляторного звена. При исследовании структуры ритмов колебаний кровотока у пациентов с АГ нами было отмечено снижение абсолютных значений амплитуд флуктуаций в нейрогенном и миогенном диапазонах (Amax N и Amax M). Вместе с тем, выявлено нарастание амплитуд респираторного и кардиального ритмов колебаний (Amax R и Amax C). Эти изменения носят прогрессирующий характер, достигая статистически значимого уровня в подгруппе пациентов с гипертрофией левого желудочка. Вклад амплитуды эндотелиального ритма (Amax E) в общую мощность спектра контрольной и основной групп в нашем исследовании остался практически неизменным, что, вероятно, свидетельствует о сохраненной вазодилатирующей способности эндотелия микрососудов.
Таблица 1. Параметры базального кровотока в микроциркуляторном русле по данным ЛДФc
Примечания: здесь и далее * - разница с группой контроля достоверна (р<0,05); ** - разница с группой МАУ достоверна (р<0,05).
Важной характеристикой периферической микрогемодинамики является внутрисосудистое сопротивление микроциркуляторного звена [11]. Нами отмечено достоверное увеличение этого показателя у пациентов с АГ в целом, а также в подгруппах МАУ и ГЛЖ в частности.
Показатель шунтирования (ПШ), позволяющий оценивать соотношение нутритивного (т.е. капиллярного) и шунтового (по артериоло-венулярным анастомозам) кровотока, несмотря на отсутствие достоверных отличий при АГ и в контроле, имеет тенденцию к снижению у пациентов с ГЛЖ, что, по-видимому, является следствием уменьшения амплитуды осцилляций нейрогенного диапазона и относительного угнетения кровотока по шунтам (вероятно, компенсаторного характера) на фоне их спазма [10].
Интегральной характеристикой соотношения механизмов активной и пассивной модуляции тканевой перфузии является индекс эффективности микроциркуляции [11]. В нашем исследовании получено статистически значимое прогрессирующее снижение ИЭМ в основной группе, более выраженное при наличии ГЛЖ.
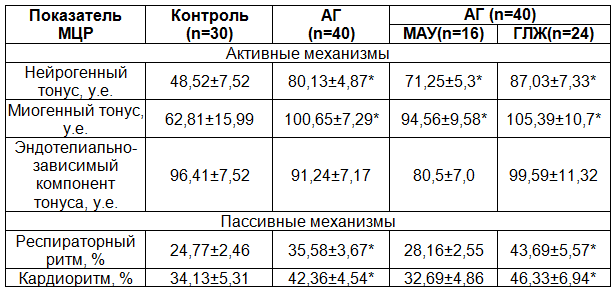
Таким образом, для больных артериальной гипертензией по результатам нашего исследования характерно снижение вазомоторной активности микрососудов с повышением нейрогенного и миогенного компонентов тонуса резистивного звена микроциркуляторного русла на фоне активации пассивных механизмов модуляции кровотока (табл. 2). Перераспределение спектральной мощности в пользу ритмов респираторного и кардиального диапазонов отражается в снижении ИЭМ при АГ. У здоровых людей наблюдается сбалансированность механизмов регуляции микрокровотока с преобладанием активных модуляторов.
Таблица 2. Механизмы регуляции тканевого кровотока
По результатам пробы с задержкой дыхания в группе контроля нормальное снижение кровотока в ответ на функциональное воздействие (18-27% от исходного уровня) наблюдалось у большинства обследованных (64%), а при АГ – лишь у 25% пациентов с МАУ и у 31% - с ГЛЖ (р<0,05).
Преобладающим вариантом реакции тканевой перфузии у больных АГ с микроальбуминурией явилось чрезмерное (более чем на 27% от исходного уровня) снижение кровотока, которое отмечалось в 46% случаев (при АГ с ГЛЖ – 19%, в контроле – 5%, р<0,05), что свидетельствует о наклонности микрососудов к спазму вследствие избыточной активации симпатического отдела вегетативной нервной системы [9].
В группе АГ с ГЛЖ превалировало недостаточное (менее чем на 18% от исходного уровня) уменьшение перфузии в ответ на задержку дыхания, выявленное нами у половины обследованных (50%, при АГ с МАУ – 29%, в контроле – 31%, р<0,05). Такой вариант нарушений может иметь место при исходном спазме микрососудов, а также при низкой скорости движения форменных элементов крови через микроциркуляторное русло из-за застойных явлений [9].
При выполнении постуральной пробы у пациентов с АГ и микроальбуминурией достоверно чаще отмечалось чрезмерное (более чем на 45% от исходного уровня) снижение показателя микроциркуляции (54%, при АГ с ГЛЖ – 15%, в контроле – 7%, р<0,05) в ответ на опускание руки с датчиком на 30 см ниже уровня сердца, что наблюдается при высокой реактивности системы прекапиллярных сфинктеров и наклонности к спазму приносящих микрососудов [9]. Нормальная реакция кожного кровотока (снижение ПМ на 30 – 45% от исходного) наблюдалась в группе контроля у 50% пациентов, при АГ с ГЛЖ – у 24% и при АГ с МАУ – у 17 % обследованных (р<0,05).
Недостаточное снижение уровня перфузии (менее чем на 30% от исходного уровня) выявлено у 29% больных АГ с МАУ, а в подгруппе ГЛЖ – явилось достоверно наиболее часто встречающимся вариантом ответной реакции сосудов МЦР (61%, в контроле – 43%, р<0,05). Малая амплитуда спада ПМ при постуральной пробе отмечается при наличии исходного спазма сосудов прекапиллярного звена в связи с повышением миогенного компонента тонуса. Морфологически в этом случае также фиксируются явления стаза и застоя в микроциркуляторных сосудах [9].
Таким образом, в большинстве наблюдаемых случаев АГ нами отмечена неадекватная реакция системы микроциркуляции на воздействие, заключающаяся в чрезмерном или недостаточном снижении кожного кровотока.
Показатели окклюзионной пробы у пациентов с гипертонической болезнью II стадии представлены в табл. 3.
Таблица 3. Показатели окклюзионной пробы у пациентов с ГБ II стадии
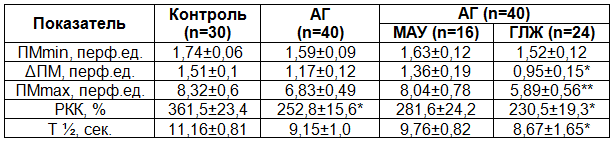
Примечания: ПМmin – минимальный уровень кровотока, возникающий в процессе 3-х минутной окклюзии плечевой артерии; ΔПМ – разность между исходным ПМ и ПМmin.
Состояние исходного кровенаполнения микроциркуляторного русла (ΔПМ) – или резерв оттока – у пациентов с АГ по результатам пробы оказалось сниженным по сравнению с контрольными значениями, достигая статистически значимого уровня при наличии гипертрофии левого желудочка. Это может косвенно отражать явления стаза в микроциркуляторном русле, и наблюдается при функциональном или морфологическом разрежении сети артериол и капилляров [9]. В этой группе также было выявлено уменьшение максимального показателя реактивной гиперемии (ПМmax), подтверждающее гипотезу о наличии застойно-стазических явлений в венулярном звене МЦР у данного контингента больных. Показатель ПМmax у пациентов с ГЛЖ снижен по сравнению с подгруппой МАУ (5,89±0,56 перф.ед. и 8,04±0,78 перф.ед., р<0,05). Достоверных изменений уровня биологического нуля (ПМmin) у больных ГБ II стадии не происходит.
Из представленных в табл. 3 данных следует, что резерв капиллярного кровотока у больных АГ меньше чем у здоровых лиц и составляет 252,8±15,6% (р<0,05). Эти результаты подтверждены и другими авторами [9,11].
Время полувосстановления капиллярного кровотока после прекращения окклюзии (Т½) в группе АГ снижено, что указывает на более быструю нормализацию кровотока и относительную склонность к спазму капилляров, вероятно, за счет измененной вазодилатирующей способности эндотелия [9].
Комплексная оценка результатов исследования позволила выявить у пациентов с ГБ II стадии гетерогенность гемодинамических типов микроциркуляции с преобладанием доли патологических. Достоверно чаще регистрировался застойно-стазический тип (ЗСТ), он был отмечен у 25% обследованных (в контроле – 3%, р<0,05). На долю спастического типа (СТ) пришлось 32%, гиперемического типа (ГТ) – 20% случаев.
У большинства пациентов из группы контроля наблюдался нормоциркуляторный тип (НЦТ) – 50% (при АГ – 23%, р<0,05), вклад спастического и гиперемического типов составил 30% и 17% соответственно.
Анализ внутригрупповых различий в структуре ГТМ у пациентов с ГБ II стадии выявил преобладание спастического типа при наличии МАУ (38%, во второй подгруппе – 24%, р<0,05) и застойно-стазического – при наличии ГЛЖ (37%, в другой подгруппе – 12%, р<0,05), что свидетельствует о выраженных отличиях ответной реакции на окклюзию при разных вариантах поражения органов-мишеней, обусловленных, вероятно, стадийностью морфофункциональных изменений в ходе эволюции заболевания. НЦТ был выявлен у 31% обследованных с МАУ и у 21% - с ГЛЖ. Частота встречаемости ГТ составила 18% и 19% в подгруппах ГЛЖ и МАУ соответственно.
Таким образом, результаты вазоконстрикторных проб и пробы с реактивной гиперемией у пациентов с ГБ II стадии демонстрируют однонаправленные изменения функционирования системы микроциркуляции и подтверждают данные, полученные нами при исследовании параметров базального кровотока. Эти отклонения проявляются в развитии спастических и застойных явлений в МЦР, прогрессирующих по мере эволюции заболевания, и связаны, вероятно, с повышением нейрогенного и миогенного компонентов тонуса микрососудов, а также с их морфологическими изменениями. Указанные нарушения в совокупности приводят к снижению эффективности функционирования микрогемодинамики и, как следствие, к ухудшению тканевой перфузии.
При исследовании эластических свойств сосудистой стенки было установлено, что в группе пациентов с ГБ II стадии показатели СРПВэ и СРПВм (табл. 4), а также их соотношение достоверно превышали контрольные значения, что свидетельствует о наличии признаков ремоделирования сосудов эластического и мышечного типов [5,7].
Таблица 4. Скорость распространения пульсовой волны у пациентов с ГБ II стадии
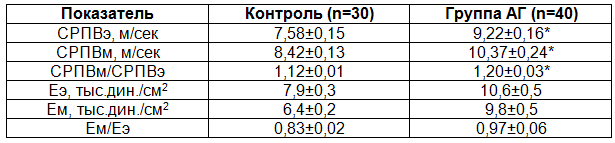
Примечание: Еэ и Ем – модули упругости сосудов эластического и мышечного типов соответственно.
При проведении корреляционного анализа была выявлена взаимосвязь СРПВ по сосудам эластического типа и внутрисосудистого сопротивления микроциркуляторного русла (r=0,34, р<0,05), т.е. чем выше СРПВ по сосудам эластического типа, тем больше внутрисосудистое сопротивление. У лиц с показателем СРПВэ, превышающим 8,8 м/сек, достоверно чаще, чем в группе АГ в целом, отмечался застойно-стазический гемодинамический тип микроциркуляции (47% и 25% соответственно, р<0,05).
Полученные результаты, на наш взгляд, можно интерпретировать, исходя из сопоставления факторов, влияющих на ЛДФ-сигнал, и известных данных о прогрессирующих по мере развития ГБ морфофункциональных изменениях сосудистого русла. На начальных этапах формирования ГБ преобладает гиперсимпатикотония с повышением сердечного выброса, тогда как изменения общего периферического сопротивления сосудов выявляются реже. По мере эволюции заболевания отмечается снижение уровня симпатической активации, и на более поздних стадиях ГБ ведущую роль играют морфологические изменения сосудов.
При длительном воздействии высокого сердечного выброса и увеличенной скорости распространения пульсовой волны на капиллярную сеть происходит уменьшение просвета резистивных сосудов, а в ряде случаев – полное закрытие их просвета за счет сокращения прекапиллярных сфинктеров, демпфирующих давление на стенки капилляров. Подобная реакция сосудов мышечного типа в ответ на повышение давления крови носит название эффекта Bayliss, описанного впервые в 1902 г. [3,12]. При этом уменьшение площади поперечного сечения просвета мелких сосудов сопровождает увеличение сосудистой реактивности. В последующем происходит описанный у животных и человека процесс запустевания, разрежения (рарефикации) капилляров и мелких артериол [13]. Условно он может быть разделен на две стадии: сначала в капиллярной сети идут процессы функциональной, а затем и структурной инволюции. На первой стадии эти изменения обусловлены вазоконстрикцией в действующей капиллярной сети. Именно в момент преобладания стадии функционального разрежения на ЛДФ-грамме формируется спастический ГТМ, когда исходный ПМ снижен, однако в процессе проведения ОП количество действующих микрососудов увеличивается, за счет чего объемный кровоток возрастает [9]. При данных условиях отношение максимального ПМ после окклюзии к исходному ПМ будет увеличено. Подобные изменения выявлены нами у пациентов с АГ и микроальбуминурией, известной как ранний маркер поражения органов-мишеней при ГБ.
Во время второй, более поздней стадии происходит морфологическая редукция микрососудов: число функционирующих капилляров становится меньше, чем в норме, даже при максимальной дилатации действующих сосудов [14]. На ЛДФ-грамме можно увидеть картину застойно-стазического ГТМ, когда уменьшенное число мелких артериол и капилляров формирует малый объемный кровоток. Так как в процессе воздействия различных внешних раздражителей (например, во время ОП) количество функционирующих микрососудов существенно не изменяется, будут наблюдаться низкий максимальный ПМ после окклюзии и, следовательно, малый РКК на ЛДФ-грамме [9]. Такой характер отклонений, по данным нашего исследования, преобладает у пациентов с АГ и ГЛЖ.
Выводы. Результаты исследования свидетельствуют о том, что у пациентов с гипертонической болезнью II стадии изменения микрососудистого русла, приводящие к снижению эффективности тканевой перфузии, и увеличение жесткости стенки артерий крупного и среднего калибра развиваются параллельно. Эти нарушения, по-видимому, взаимосвязаны и имеют патогенетическую значимость в прогрессировании заболевания.
У пациентов с ГБ II стадии в целом выявлена гетерогенность типов микроциркуляции с достоверным увеличением доли патологических, однако степень выраженности сосудистых расстройств варьирует в зависимости от варианта поражения органов-мишеней: при наличии микроальбуминурии в микроциркуляторном русле преобладают процессы вазоконстрикции, а при гипертрофии левого желудочка – застойно-стазические явления и признаки структурной инволюции. При увеличении жесткости сосудистой стенки (повышении СРПВэ) микроциркуляторные нарушения более выражены.
Полученные данные отражают закономерности сосудистого ремоделирования при АГ и могут быть полезны для совершенствования подходов к диагностике и лечению этой нозологической формы.
