Оценка степени тяжести недифференцированной дисплазии соединительной ткани (НДСТ) у больных с врожденным пролапсом митрального клапана (ПМК) относится к сложным вопросам в современной клинике внутренних болезней [9]. Это обусловлено многообразием клинических проявлений со стороны различных органов и систем и в первую очередь со стороны сердечно сосудистой системы [14]. Важное место в этой проблеме занимает возраст пациента. Частота выявления НДСТ, по данным литературы, среди лиц молодого и юношеского возраста достигает 80% [5].
Вместе с тем при использовании жестких критериев (шесть и более внешних факторов) частота выявления НДСТ снижается до 10-25%, а клиническая значимость выявленных аномалий возрастает [6,7]. К особенностям НДСТ в юношеском (от 15-17 лет) и молодом возрасте у пациентов с врожденными ПМК относят вегетативную дисфункцию, синдром хронической усталости, иммунные расстройства, аномалий развития клапанного аппарата сердца, клапанных пролапсов и регургитации [7].
Среди важных причин прогрессирования НДСТ у больных с врожденным ПМК рассматривают развитие дисфункции эндотелия (ДЭ), что связывают с дисбалансом полиморфизма генов белков экстрацеллюлярного матрикса [15]. Причиной ДЭ на молекулярном уровне является нарушение локальной продукции NO и повышенный окислительный стресс [12]. Важным фактором в развитии ДЭ выступает дисбаланс в продукции NO оказывающей вазодиллятирующий эффект, обусловленный активностью ферментной системы NO – синтаз и активностью эндотелинов – вазоактивных пептидов, продуцируемые эндотелиаминами и эпителиальными клетками, макрофагами, фибробластами и многими другими тканями, включая кардиомиоциты [14,15,18].
В настоящее время описаны три изоформы эндотелинов: эндотелин – 1 (ЭТ-1), эндотелин-2 (ЭТ-2), эндотелин-3 (ЭТ-3) [19]. Эндотелин связываются с рецепторами расположенными в основном на гладкомышечных клетках и кардиомиоцитах, опосредуя вазоконстрикторный эффект ЭТ-1 и его способность подавлять проаритмогенные эффекты катехоламинов [18]. Активация рецепторов ЭТ-1 увеличивает высвобождение NO и простациклина, увеличивает вазоконстрикцую, модулирует клеточную пролиферацию и гормональную продукцию [13,18]. Увеличения ЭТ-1 проводит к развитию гипертрофии левого желудочка и в настоящее время рассматривается как маркер и предиктор многих патологий, таких как, ишемическая болезнь сердца, острый инфаркт миокарда, атеросклероз, легочная и системная гипертензия и др. [7].
Важное значение ЭТ-1 имеет в развитии гипоксии [18,19]. Гипоксическая индукция ведет к повышению регуляции гликопротеида- сосудисто - эндотелиального фактора роста (VEGF) и впоследствии к увеличению числа кровеносных сосудов. Этот фактор роста выполняет свои функции через специфические тирозинкиназные рецепторы, расположенные на поверхности эндотелиальных клеток (VEGF R-1 или FLT-1) и VEGF R-2 или FLК-1 (KDR) [8]. Свой ангиогенный эффект VEGF реализует в основном через VEGF R-2, ряд исследователей считают, что увеличение VEGF и его рецепторов обусловливают процесс коллатерального обеспечения тканей кислородом и питательными веществами [9].
Снижение уровня VEGF в условиях гипоксии обусловливает апоптоз эндотелия, ведущий к обструкции просвета и регрессии сосудов [11]. Снижение уровня VEGF, рецепторной чувствительности VEGFR - 2, обусловленные дисбалансом NO - синтазного механизма, выработки NO, активности ЭТ-1, окислительного стресса могут быть важными пусковыми механизмами активации деструктивных матриксных металлопротеиназ, которые вызывают деградацию эктрацеллюлярного матрикса клапанного аппарата сердца, прогрессирование тяжести НДСТ у больных с врожденным ПМК. В тоже время факторы, выполняющие функцию ангиогенеза, регулирующие тонус сосудов, эндотелиальную функцию, процессы окислительного стресса при развитии различной степени тяжести НДСТ у больных с врожденным ПМК до сегодняшнего дня четко не округлены, что затрудняет назначение с профилактической или лечебной целью патогенетически обоснованной терапии.
Целью настоящего исследования была оценка функции эндотелия и активности некоторых ферментов антиоксидантной системы в зависимости от степени тяжести НДСТ у больных с врожденными пороками митрального клапана.
Материал и методы. В популяционное обследование включено 86 лиц, в том числе 36 (41,9%) мужского и 50 (58,1%) женского пола в возрасте от 15 до 25 (19,9±1,42) лет с этиологическими признаками (идиопатической, врожденной) ПМК [7]. Диагноз устанавливали на основании классификации Т.И.Кадуриной [7,8] и был подтвержден данными ЭхоКГ. Обследования включены 41 (47,7%) пациентов с ПМК с регургитацией I степени (16 мужчин и 25 женщин) – 1 гр. и 45 (52,3%) пациентов в том числе 20 мужчин и 25 женщин со 2 степенью регургитацией - 2 гр. В группу обследования не включали лиц с вторичным характером ПМК при тщательном изучении анамнестических данных и результатов инструментального обследования, а также у которых выявлялись заболевания сердечно - сосудистой системы, ревматизма, хронических патологии печени, почек, легких. Контролем для обоих, сравниваемых групп служили данные от 20 условно здоровых лиц сопоставимого возраста – 18,9±1,56 лет, без признаков нарушение ЭКГ и давшие добровольно устное согласие на проведение обследования. У всех обследованных утром натощак из локтевой вены брали кровь для выделения сыворотки. Определяли концентрации оксида азота (NO), активности ферментов эндотелиальной и индуцибельной NO-синтазы (eNOS и i NOS), содержания пероксинитрита (ONO2-), эндотелина – 1 (ЭТ-1), фактора роста эндотелия сосудов (VEGF) и его рецептора (VEGFR- 2), активность ферментов антирадикальной защиты – супероксидисмутазы (СОД) и каталазы (КТ).
Уровень NO определяли по сумме основных стабильных метаболитов NO2 - и NO3 по методике описанной П.П.Голиковым и соавторы [3], активность eNOS определяли по методу В.В. Сумбаева, И.М.Ясинской [1], скорость реакции фермента iNOS оценивали по V.T.Hope, S,R,S Vinsent (1985) в модификации А.С.Комарин, Р.К.Азимов [4]. Уровень ОNO2- определяли по методу N.W.Кооу и соавт. (1994) в модификации А.С.Комарин, Р.К.Азимов [4]. Количественное определение ЭТ-1, VEGF, VEGFR- 2 профили на автоматическом универсальном ридере с использованием ИФА марки АТ-858 (LTD, Китай). При этом использовали стандартные наборы для твердофазного ИФА фирмы Human (Австрия). Активность фермента СОД определяли по методу Е.Е.Дубиной и соавт. [5], КТ - по М.А.Коромок и соавт. [2]. Полученные данные подвергали статистической обработке в программной среде Microsoft Windows с использованием пакетов программ Microsoft Exsel 2003 и Statistica, Version 6 и отражены в виде M±m. Достоверность различий определяли по критерию Стьюдента и считали значимыми при р<0,05.
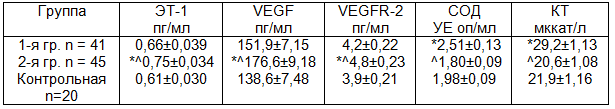
Результаты и обсуждение. В 1-й группе пациентов в сыворотке крови отмечается увеличение экспрессии ONO2-, активности iNOS по сравнению с данными в контроле на 21,1 и 19,7% (р<0,05) на фоне высокой активности ферментов антирадикальной защиты – СОД и КТ – на 26,8 и 33,3% (р<0,02 и 0,01) (табл 1, 2). Можно полагать, что высокий уровень ONO2- в сыворотке крови пациентов 1 гр. обусловлено возросшей активностью iNOS, которая в условиях патологии катализирует образование NO в десятки и сотни раз выше, чем при активации eNOS. В этих условиях избыточный NO вступает в реакцию с О2 - [гидроксильным радикалом] с образованием высокоцитотоксического соединения ONO2- [17].
Вместе с тем, такие показатели, характеризующие функцию эндотелия – NO, eNOS, а также процессы ангиогенеза – VEGF и VEGFR-2 и активность ЭТ-1 были в пределах контрольных значений. Анализируя полученные данные можно представить, что у пациентов 1 гр. высокая активность СОД и КТ в состоянии компенсировать процессы инактивации ONO2-, тем самым удерживать, хотя и не стабильно высокий уровнь iNOS и ONO2-, чтобы предотвращать процессы активации ЭТ-1, ангиогенеза, удерживать в пределах контрольных значений функцию эндотелия. Вместе с тем, напряжение, создаваемое со стороны iNOS и ONO2- не может быть бесконечным. При этом могут истощаться потенциальные запасы ферментов обеспечивающих антирадикальную защиту эндотелия [18].
В наших исследованиях это, по-видимому, проявляется более выраженными нарушениями в системе обеспечивающих физиологическую функцию эндотелия, процессы ангиогенеза и активности ферментов актирадикальной защиты у пациентов с врожденным ПМК 2 степени регургитации. Так, у пациентов 2 гр. в сыворотке крови уровень NO статистически значимо оказался выше, чем в контроле – на 34,4% (р<0,01) несмотря на то что активность фермента e NOS была ниже – на 18,7% (р<0,05). В этой группе пациентов показатели в крови i NOS, ONO2- и ЭТ-1 были выше, чем в контроле на 36,4% (р<0,01), 45,1% (р<0,001) и 23,0% (р<0,05) соответственно. Одновременно высокими были показатели, характеризующие процессы ангиогенеза – VEGF и VEGFR-2 – на 27,4 и 23,1% (р<0,02 и 0,05). У пациентов 2 гр. показатели активности ферментов актирадикальной защиты СОД и КТ были в пределах контрольных значений, но существенно ниже, на 28,3 и 29,5% (р<0,02 и 0,01), чем в 1 гр. пациентов. Исходя из полученных данных можно предположить, что высокая концентрация NO в сыворотке крови пациентов 2 гр. обусловлена активацией i NOS, так как фермент e NOS был угнетен.
В этих условиях гиперэкспрессия NO и ONO2- оказывают мощный вазопрессорный эффект, что можно связать с их индицирующим действием на активность ЭТ-1 [14,18]. В условиях вазоконстрикции и гипоксии в тканях возрастает уровень О2- [17,18], который при экспрессии NO-вступают в реакцию взаимодействие с образованием ONO2- [18]. Такая логика событий подтверждается тем, что в сыворотке крови активность ферментов антирадикальной защиты – СОД и КТ у пациентов 2 гр. по сравнению с 1 гр. была существенно ниже.
Возможно, что с недостаточной активностью ферментов антирадикальной защиты возрастают процессы, направленные на экспрессию i NOS, ONO2-, NO и ЭТ-1. В создавшихся условиях, чтобы обеспечивать тканей кислородом возрастает подробность в процессах дополнительной васкуляризации органов. В наших исследованиях это проявляется, по-видимому, активацией процесса ангиогенеза, о чем свидетельствуют данные увеличение показателей VEGF и VEGFR-2. Увеличение продукции VEGF и VEGFR-2 – показателей ангиогенеза нами расценивается как компенсаторно - приспособительная реакция тканей организма, адаптацию его к создавшимся условиях для поддержания функции сердца у пациентов с врожденным ПМК и 2-й степенью регургитации клапанного аппарата сердца. Вместе с тем активации VEGF и VEGFR-2 могут служить причинами усиления процесса фибриногенеза и роста компонентов экстрацеллюларного матрикса, к которым относят коллаген I, III, IV типов, гиалуроновая кислота, ламитил и его фрагменты, YKL-40, металлопротеазы, тканевые ингибиторы металлопротеаз, цитолины и др., что приводит к образованно соединительнотканой мембраны в стенках кровеносных сосудов [8,9].
Таким образом, у пациентов с врожденной ПМК 1-й и 2-й степени регургитации в патогенезе НДСТ лежат процессы эндотелиальной дисфункции, обусловленные дисбалансом в NO-системе. Дисбаланс в NO-системе обусловлен гиперэкспрессией iNOS и ONO2-, угнетением активности eNOS, что приводит к увеличению ЭТ-1, как следствие развития стойкого вазоконстрикторного эффекта.
У пациентов с врожденной ПМК 1-й степени регургитации избыточное увеличение NO и ONO2- компенсируется возрастанием высокой потенциальной емкостью ферментов системы антирадикальной защиты – СОД и КТ. Высокий уровень ферментов системы антирадикальной защиты у пациентов 1 группы стабилизируется на высоком уровне процессы образования ONO2-, тем самым компенсаторно предотвращаются эффекты стимуляции образования NO, ЭТ-1, факторов ангиогенеза – VEGF и VEGFR- 2.
Таблица 1. Показатели функции эндотелия и активности ферментов антиоксидантной системы в сыворотке крови больных с врожденным пролапсе митрального клапана

Таблица 2.
Примечания: * - р<0,05 по сравнению с контролем, ^ - р<0,05 по сравнению с 1 гр.
У пациентов 2-й группы возрастание экспрессии NO-, обусловленные индикацией активности iNOS, недостаточной емкостью ферментов системы антирадикальной защиты стойкое образование высоких концентраций ONO2-, NO приводит к стимуляции активности ЭТ-1, как следствие развития окислительного стресса. Это способствуют вазоконстрикции, эндотелиальной дисфункции, стимуляции процесса ангиогенеза, полиморфизму генов белков экстрацеллюлярного матрикса, формированию аномалии соединительной ткани, характеризирующие структурные молекулярные нарушения сопровождающиеся различными морфофункциональными сдвигами висцеральных систем, в том числе клапанного аппарата сердца. На основании полученных данных можно прийти к заключению, что морфологическим субстратом прогрессирования дезорганизации соединительной ткани у пациентов с врожденной ПМК выступает ДЭ, стимуляция ангиогенеза и относительная несостоятельность активности ферментов системы антирадикальной защиты.
Учитывая, что уровень показателей NO-системы, ангиогенеза существенно изменяются при прогрессировании НДСТ у пациентов с врожденным ПМК и они могут служить дополнительными маркерами оценка тяжести и прогнозе заболевания.
Выводы
- При прогрессировании НДСТ у больных с врожденным ПМК в сыворотке крови наблюдаются процессы, характеризующие дисфункцию эндотелия - экспрессия NO, iNOS, ONO2- и ЭТ-1, на фоне угнетения активности eNOS.
- Увеличение степени регургитации у пациентов с врожденной ПМК одновременно сопровождается возрастанием в сыворотке крови факторов ангиогенеза VEGF и VEGFR-2.
- У пациентов с НДСТ в сыворотке крови отмечается различный уровень активности ферментов системы антирадикальной защиты. Высокая активность ферментов СОД и КТ, что совпадает с экспрессией iNOS, ONO2- и пределах контроля показателей NO, ЭТ-1, VEGF, VEGFR-2 у пациентов с 1 ст. регургитации. Во 2 гр. определяется существенное снижение ферментов СОД и КТ по сравнение с 1 гр., что проявляется значительным дисбалансом в NO-системе: угнетенные активности eNOS. экспрессией NO, iNOS, ONO2-, ЭТ-1, стимулированием факторов ангиогенеза VEGF и VEGFR-2.
