Неревматический аортальный стеноз (сенильный, дегенеративный, атеросклеротический, кальцинированный) является наиболее частой клапанной патологией сердца и среди всех сердечно-сосудистых заболеваний занимает третье место после артериальной гипертензии и ишемической болезни сердца [1]. Распространенность аортального стеноза (АС) плохо изучена и по разным данным в индустриальных странах составляет 2–9 % у лиц старше 65 лет, причем с возрастом частота его возрастает [1,2]. Независимо от степени тяжести, АС приводит к повышенному риску возникновения инфаркта миокарда, нарушения мозгового кровообращения, сердечной недостаточности и внезапной смерти, а также является одним из ведущих показаний для оперативного вмешательства на сердце в пожилом и старческом возрасте [3,4].
Наличие длительного латентного периода, во время которого постепенно нарастает выраженность гемодинамической обструкции выходного тракта левого желудочка, а также наличие сопутствующей сердечно-сосудистой патологии, затрудняют диагностику заболевания на ранних этапах. С появлением же симптомов болезни средняя продолжительность жизни больных без оперативного лечения не превышает двух-пяти лет [4,5]. Хотя гемодинамические изменения при стенозе аортального клапана (АК) достаточно хорошо изучены, остается неуточненным характер изменений процессов ремоделирования сердца в зависимости от тяжести АС на фоне сопутствующей ишемической болезни сердца (ИБС).
В связи с этим, целью исследования стало изучение процессов ремоделирования сердца у лиц с ИБС в сочетании с дегенеративным аортальным стенозом.
Материалы и методы. В исследование ретроспективно методом сплошной выборки из историй болезни кардиологического профиля ГБУЗ ОКБ №3 г. Челябинска за период 2007-2010 г. отобрано 147 пациентов (мужчин 35,5%, женщин 64,6%) с дегенеративным АС в сочетании с ИБС стабильной стенокардией I-IV функционального класса. Средний возраст пациентов составил 73,3±6,6 лет (60-88).
В контрольную группу включен 41 пациент (мужчин 48,8%, женщин 51,2%) с установленным диагнозом ИБС без признаков кальциноза и стенозирования АК. Средний возраст пациентов составил 68,9±6,2 лет (60-82). Критерием ИБС явилось наличие ишемической депрессии сегмента ST по данным суточного мониторирования ЭКГ, велоэргометрии, тредмил-теста; перенесенный инфаркт миокарда в анамнезе, атеросклеротическое поражение коронарных артерий по данным коронароангиографии и/или мультиспиральной компьютерной томографии (КТ) сердца.
Критерием включения в основную группу явилось наличие стеноза АК дегенеративного генеза различной степени тяжести, подтвержденного данными эхокардиографии (ЭХО-КГ). Критериями исключения явились ревматическая лихорадка в анамнезе, клинические и эхокардиографические признаки ревматической болезни сердца, системные заболевания соединительной ткани, заболевания крови, сахарный диабет и другие эндокринопатии, хроническая почечная недостаточность, онкологическая патология, заболевания печени, инфекционный эндокардит в анамнезе, двустворчатый аортальный клапан.
Исследуемые группы были сопоставимы по полу, факторам риска, наличию сопутствующих сердечно-сосудистых заболеваний (артериальной гипертензии, случаев нарушения мозгового и коронарного кровообращения в анамнезе, тяжести стенокардии напряжения). Эхокардиографическое исследование проводилось по методике Американской ассоциации эхокардиографии на аппарате фирмы General Electric Vivid 7 (США) в В и М режимах с использованием цветного доплеровского картирования датчиком с частотой 2,5 мГц в стандартных позициях [6,7]. Постановка диагноза кальцинированного АС дегенеративного генеза и оценка его тяжести проводилась в соответствии с рекомендациями EAE/ASE (2009) и ACC/AHA 2006 [8,9]. Оценивались такие показатели, как максимальный градиент давления на АК, скорость трансаортального потока, а также амплитуда раскрытия створок АК. Все пациенты основной группы были разделены по степени тяжести стеноза АК в зависимости от скорости трансаортального кровотока: I степень – 110 человек (74,8 %); II степень – 16 (10,9 %); III степень – 21 (14,3 %). Градиент давления аортальной обструкции определяли по формуле Бернулли: ΔP = 4*V2, где ΔP – градиент давления между ЛЖ и аортой, (мм. рт. ст.), V – скорость кровотока, дистальнее обструкции, (м/с). Наличие кальцификатов в митральном и аортальном кольцах и клапанах выявляли с помощью диагностических критериев Y. Feigenbaum [10].
При исследовании в М-модальном режиме определяли амплитуду раскрытия створок АК во время систолы ЛЖ, конечный диастолический размер (КДР) и конечный систолический размер (КСР) левого желудочка, толщину межжелудочковой перегородки (ТМЖП), толщину задней стенки левого желудочка (ТЗСЛЖ), размер левого предсердия (ЛП), размер правого желудочка (ПЖ) и правого предсердия (ПП), диаметр аорты (ОА) в см. Используя полученные величины по формуле Teicholz L.E. (1976) вычисляли конечный систолический (КСО, см) и конечный диастолический объемы (КДО, см) ЛЖ, ударный объем (УО, см), фракцию выброса (ФВ, %) и фракцию систолического укорочения (ФС, %).
Масса миокарда левого желудочка (ММЛЖ) вычислялась по формуле Devereux R. и Reicheck N. [11]: ММЛЖ = 1,04 х [(ТМЖП+ТЗСЛЖ+КДР)3 – (КДР)3] – 13,6; где 1,04 – коэффициент плотности сердечной мышцы. Индекс ММЛЖ, г/м² рассчитывали как отношение ММЛЖ к площади поверхности тела. Критерии гипертрофии (ГЛЖ) миокарда ЛЖ - увеличение ИММЛЖ более 125 г/м2 – у мужчин и более 110 г/м2 – у женщин [12].
Для определения типа ремоделирования миокарда левого желудочка вычисляли относительную толщину стенок (ОТС) миокарда по формуле ОТС=(ТМЖП+ТЗСЛЖ)/КДР. За нормальные значения ОТС принималась величина, равная 0,42 [7,13]. Оценку изменений геометрии ЛЖ осуществляли в соответствии с классификацией А. Ganau (1992) [14]. Нормальная геометрия ЛЖ считалась при ОТС<0,42 и ИММЛЖ=N, эксцентрическую ГЛЖ отмечали при ОТС<0,42 и ИММЛЖ>N; концентрическую - при ОТС≥0,42 и ИММЛЖ>N; концентрическое ремоделирование – при ОТС≥0,42 и ИММЛЖ=N. Систолическое давление в легочной артерии (СДЛА) рассчитывалось по методу Chan K-L (1987) [15].
Исследование диастолической дисфункции ЛЖ основывалось на измерении скорости потока крови через митральный клапан в период наполнения ЛЖ. В данной позиции производили измерение максимальных скоростей раннего диастолического наполнения – Е (см/сек.) и скорости кровотока во время предсердной систолы – А (см/сек.). Рассчитывали их соотношение Е/А, а также время замедления кровотока через митральный клапан в фазу раннего диастолического наполнения ЛЖ. При одновременной регистрации кровотока в выносящем тракте ЛЖ и трансмитрального кровотока измеряли время изоволюметрического расслабления ЛЖ [6].
Статистическая обработка результатов проводилась с использованием программы SPSS Statistics Version 17. Все значения представлены в виде М±SD при нормальном распределении и в виде Ме (25 и 75 перцентиль) при распределении отличном от нормального. Сравнение качественных признаков проводилось с помощью таблиц сопряженности (хи-квадрат по методу Пирсона). Для оценки корреляционных взаимосвязей применяли коэффициенты корреляции Пирсона и Спирмена. Различия считались достоверными при вероятности ошибки менее 5 % (р<0,05).
Полученные результаты. Сравнительный анализ показателей эхокардиографии позволил выявить существенные различия метрических (КСР, ТЗСЛЖ, ТМЖП, ЛП, ПЖ, ПП) и объемных (КДО, КСО, УО) показателей, которые были значимо больше в группе больных ИБС в сочетании с АС по сравнению с контролем. При этом, средние значения систолической функции ЛЖ (ФС, ФВ) были существенно ниже, а давления в легочной артерии – выше также у лиц с аортальным стенозом, хотя и не отличались от нормальных значений (табл. 1).
Таблица 1. Сравнительный анализ структурно функциональных показателей исследуемых групп
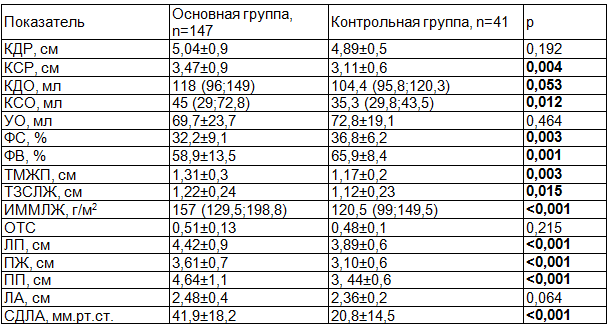
Примечание: Данные представлены в виде (М±SD) при нормальном распределении и в виде Ме (25; 75 перцентиль) при ассиметричном распределении.
В исследуемых когортах частота встречаемости гипертрофии левого желудочка (ГЛЖ) оказалась достаточно высокой и преобладала в группе с АС 91,2% (134 чел.) и 71,1% (27 чел.) у лиц без АС (р<0,05). Случаи диастолической дисфункции ЛЖ чаще наблюдались в группе ИБС без стеноза АК 84,5% (33 чел.) и 64,3% (92 чел.), р<0,05.
Частота сниженной ФВ (<55%) была выше у пациентов с АС 37% (54 чел.), чем в контрольной группе - 8% (2 чел.), р<0,05. Нарушение локальной сократимости также преобладало у лиц со стенозом АК 38,1% (56 чел.) и 20,5% (8 чел.), р<0,05, что, возможно, может быть связано с более высокой частотой встречаемости инфаркта миокарда в анамнезе у пациентов со стенозом АК (36,1% против 29,3%, p>0,05).
Показатели трансаортального градиента давления и скорости кровотока на АК в зависимости от степени АС имели следующее распределение: 1 ст. – 16,6 (13,8;23,1) мм.рт.ст. и 2,04 (1,87;2,34) м/с; 2 ст. – 47,9 (38,8;53,7) мм.рт.ст. и 3,47 (3,09;3,65) м/с; 3 ст. – 85,6 (73;101,5) мм.рт.ст. и 4,65 (4,34;5,14) м/с, р<0,05. Амплитуда раскрытия створок АК: 1 ст. - 1,35±0,3 см; 2 ст. – 1,02±0,2 см; 3 ст. – 0,89±0,1 см, р<0,05.
При проведении сравнительного анализа показателей ЭХОКГ в зависимости от степени стеноза АК выявлено увеличение толщины стенок миокарда ЛЖ, величины ОТС и массы миокарда ЛЖ, которые сопровождались снижением показателей ФВ (табл. 2).
Таблица 2. Сравнительный анализ структурно-функциональных показателей в зависимости от степени тяжести аортального стеноза
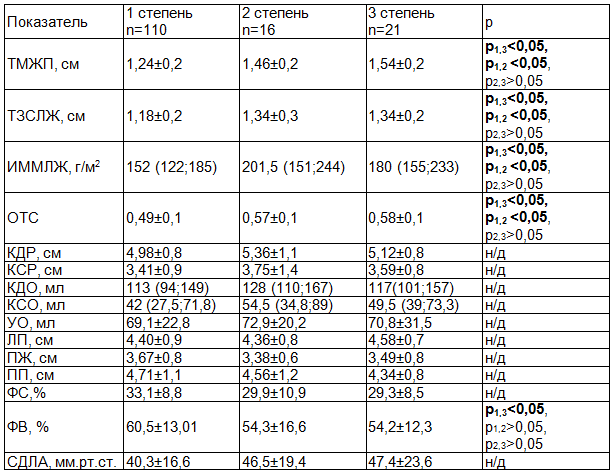
Примечание: данные представлены в виде (М±SD) при нормальном распределении и в виде Ме (25;75 перцентиль) при ассиметричном распределении.
Объемные показатели ЛЖ, размеры полостей сердца и СДЛА имели тенденцию к росту значений, однако различия статистической достоверности не достигали (р>0,05). При этом максимальные значения КДР, КСР, КДО, КСО и УО наблюдались у лиц со 2 степенью стеноза АК. Возможно, это объясняется наличием в этой группе пациентов большей частоты встречаемости инфаркта миокарда в анамнезе (1 ст. АС - 38,2%; 2 ст. АС - 50%; 3 ст. АС - 14,3%, р<0,05), нарушений локальной сократимости миокарда ЛЖ (1 ст. - 37,3%; 2 ст. - 50%; 3 ст. - 33,3%, р>0,05), что сочеталось и с более высокой частотой диастолической дисфункции ЛЖ (1 ст. - 58,9%; 2 ст. - 87,5%; 3 ст. - 75%, р<0,05).
При анализе характера ремоделирования миокарда ЛЖ был отмечен рост числа случаев концентрической гипертрофии ЛЖ по мере увеличения степени тяжести АС, а частота эксцентрической гипертрофии ЛЖ имела тенденцию к снижению. Концентрическое ремоделирование ЛЖ выявлено только у лиц с 1 степенью АС (рис. 1).
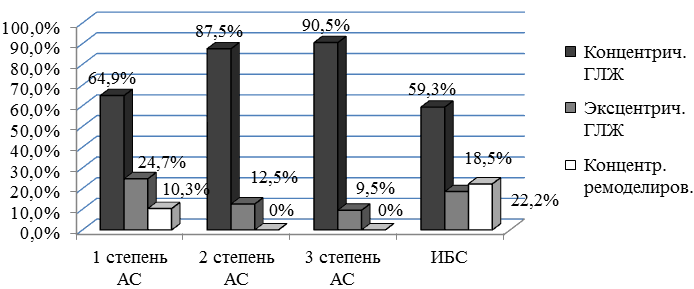
Рис. 1. Распространенность типов ремоделирования ЛЖ в группах в зависимости от степени стенозирования: АС – аортальный стеноз.
При исследовании структурных и функциональных показателей миокарда у лиц с АС в зависимости от варианта ремоделирования ЛЖ установлено, что у пациентов с концентрической гипертрофией ЛЖ значения трансаортального градиента давления и скорость кровотока на аортальном клапане были существенно выше, чем у лиц с концентрическим ремоделированием и эксцентрической гипертрофией ЛЖ (табл. 3).
Таблица 3. Структурно-функциональные показатели сердца в зависимости от варианта ремоделирования миокарда левого желудочка
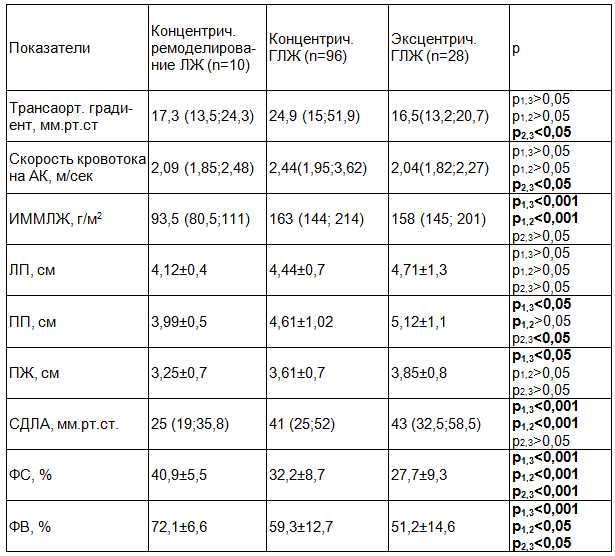
Пациенты с эксцентрической гипертрофией ЛЖ имели более высокие объемные показатели ПП и ПЖ, более высокие значения легочного давления и более низкие значения сократительной способности миокарда ЛЖ по сравнению с лицами с концентрическим ремоделированием миокарда ЛЖ. При этом различий в показателях трансаортального кровотока в этих группах не наблюдалось.
При проведении корреляционного анализа установлено, что увеличение градиента давления на АК ассоциируется с увеличением толщины стенок и массы миокарда ЛЖ: с ИММ (r=0,263, р=0,002), с ТЗСЛЖ (r=0,235,р=0,004), с ТМЖП (r=0,443, р<0,001), с ОТС (r=0,262, р=0,004). Увеличение степени АС сопровождается снижением показателей систолической функции сердца: ФВ (r= -0,212, р=0,01) и ФС (r= -0,193, р=0,02). Уменьшение амплитуды систолического открытия створок АК связано с ростом ТМЖП (r= -0,227, р=0,006) и ОТС (r= -0,189, р=0,039).
Таким образом, наши данные указывают, что процессы ремоделирования сердца при АС обусловлены в большей степени не ишемией миокарда, а степенью стенозирования АК. Кроме того, в анамнезе у пациентов с ИБС и АС с концентрической ГЛЖ достоверно чаще происходили случаи инфаркта миокарда 57,1% (16 чел.), острого нарушения мозгового кровообращения 25% (7 чел.), фибрилляции предсердий 64,3% (18 чел.), р<0,05.
Выводы
- Наличие аортального стеноза приводит к значимому ремоделированию сердца, преимущественно по типу концентрической гипертрофии миокарда левого желудочка с преимущественным увеличением толщины межжелудочковой перегородки и задней стенки левого желудочка.
- С ростом степени тяжести АС происходит прогрессирующее снижение систолической функции ЛЖ и увеличение давления в легочной артерии.
- У больных с аортальным стенозом ремоделирование миокарда по типу эксцентрической гипертрофии ЛЖ ассоциируется с наиболее высокими размерами левого предсердия и правых отделов сердца, показателями легочного давления и наиболее низкими значениями сократительной способности миокарда по сравнению с лицами с концентрическим ремоделированием и концентрической гипертрофией миокарда левого желудочка.
