Ренин-ангиотензиновая система (РАС) имеет важное значение в регуляции ряда физиологических и патофизиологических состояний. По данным экспериментальных и клинических исследований активация РАС является одним из важных механизмов, лежащих в основе прогрессирования составляющих синдрома инсулинорезистентности (ИР) [1]. Главным эффектором РАС является ангиотензин II (АТII), образование которого в большинстве случаев происходит при участии ангиотензин превращающего фермента (АПФ). Исследования последних лет показали, что содержание АПФ в организме человека генетически обусловлено. Ген АПФ расположен в 17 хромосоме, в локусе 17q23. Инсерционно-делеционный полиморфизм гена АПФ связан с инсерцией (I) или делецией (D) 287 пар оснований Alu-повтора в 16 интроне гена АПФ. Выделяют соответственно три генотипа: гомозиготы по инсерции (II), гомозиготы по делеции (DD) и гетерозиготы (ID) [2].
Согласно определению Международной Федерации диабета синдром ИР представляет собой сочетание факторов риска развития атеросклероза [3]. Наиболее значимыми из них являются нарушения углеводного обмена, абдоминальное ожирение, артериальная гипертензия и дислипидемия. Между этими компонентами существует тесная взаимосвязь, обусловленная, прежде всего, инсулинорезистентностью и гиперинсулинемией [4-6]. В доклинических исследованиях показана взаимосвязь между АТII и путями внутриклеточной передачи сигнала инсулина. В частности, выявлена роль АТII в передачи сигналов, отвечающих за поддержание структуры и деятельности кардиомиоцитов [7-8].
К настоящему времени накоплено множество противоречивых данных об ассоциации полиморфизма гена АПФ с инфарктом миокарда, гипертонией, гипертрофией левого желудочка, гипертрофической кардиомиопатией, заболеваниями почек и сосудистыми осложнениями сахарного диабета [9-10].
Во многих исследованиях изучалась толщина комплекса интима-медиа различных артерий (сонной, бедренной) и выраженность атеросклероза сонных и коронарных артерий в зависимости от генотипа АПФ. Целью данного исследования явилась оценка риска развития атеросклероза в зависимости от генотипов и аллельных вариантов гена АПФ.
Материал и методы исследования
На этапе включения в исследование в 2001-2002 г. было обследовано 92 клинически здоровых пациента (50 женщины и 42 мужчины) в возрасте 35-55 лет, обратившиеся в поликлинику ОАО «Медицина» для проведения диспансеризации.
По критериям EGIR (2002), синдром инсулинорезистентности определяется как наличие гиперинсулинемии (иммунореактивный инсулин (ИРИ) >11,0 мкМЕ/мл) и двух или более из следующих компонентов: нарушение регуляции глюкозы (уровень глюкозы ≥6,1 ммоль/л и/или нарушение толерантности к глюкозе, исключая сахарный диабет), АГ (уровень АД≥140/90 мм рт.ст. и/или постоянный прием гипотензивных препаратов), дислипидемия (холестерин липопротидов высокой плотности (ХС ЛПВП) ≤1,0 ммоль/л и/или триглицериды (ТГ) ≥ 1,7 ммоль/л, абдоминальное ожирение (объем талии ³ 94 см у мужчин и ³ 80 см у женщин) [10].
Определяли также уровни аполипопротеинов А1 (Апо-А1) и В (Апо-В) с расчетом аполипопротеинового индекса атерогенности по соотношению основных аполипопротеинов – Апо-В (транспортный белок ХС ЛПНП) / Апо-А1 (транспортный белок ХС ЛПВП). В норме этот показатель не превышает 1. При прогрессировании атеросклеротического процесса характерно уменьшение содержания Апо-А1 и увеличение Апо-В.
Измерение толщины комплекса интима-медиа (ТКИМ) общих сонных артерий (ОСА) проводили по стандартной методике на аппарате VOLUSON 730 EXPERT 2006г., оснащенном линейным датчиком с фазированной решеткой с частотой 7,5 МГц. Исследование ОСА проводили по 3 точкам на 1см ниже уровня бифуркации справа и слева. Вычисляли среднюю ТКИМ ОСА по 6 точкам. Наличие ранних признаков атеросклероза определялось как местное утолщение ТКИМ ОСА более 1,0 мм в любой из точек сонных артерий (ТКИМ ОСА максимальная).
Из материала ДНК, выделенного из лейкоцитов периферической крови, проводился анализ структуры гена АПФ методом полимеразной цепной реакции.
Через 5 лет после первичного обследования проведены контрольные лабораторные и инструментальные исследования у пациентов изучаемой группы.
Оценку частоты встречаемости признаков в изучаемой совокупности проводили методом c2. Достоверность различия частоты встречаемости генотипов и аллелей гена в группах случаев и контролей представлены в виде отношения шансов (ОШ). Относительный риск (OР) рассчитывали на основе мультипликативной модели наследования по аллелям (тест c2 при степени свободы df=1). Результаты представлены в виде относительного риска с 95% доверительным интервалом.
Результаты и их обсуждение
Средний возраст пациентов изучаемой группы составил 41,7±1,41 лет для мужчин и 41,7±1,30 лет для женщин.
Наследственная предрасположенность к сердечно-сосудистым заболеваниям или к СД в группах мужчин и женщин достоверно не различалась (Р>0,05).
Распределение генотипов соответствовало равновесию Харди-Вайнберга. При анализе распределения генотипических и аллельных частот в суммарной выборке изученных пациентов частота встречаемости аллеля D составила 47,8%, а аллеля I – 52,2%. Гомозиготами по аллелю D (генотип DD) являлись 20,7% пациентов (N=19), гетерозиготами (генотип DI) – 54,3% пациентов (N=50), гомозиготами по аллелю I (генотип II) – 25,0% (23 пациента).
При включении в исследование ТКИМ ОСА максимальная по 6-ти точкам измерения достоверно не различалась в группах пациентов с различными генотипами (р=0,436) и аллельными вариантами (р=0,286), составляя в среднем 0,76±0,01 мм. Через 5 лет наблюдения в группе пациентов – носителей DD генотипа данный показатель достоверно увеличился на 34,2% относительно исходного уровня и составил 1,06±0,04 против 0,82±0,04 мм у гомозиготных пациентов по аллелю I (р=0,001).
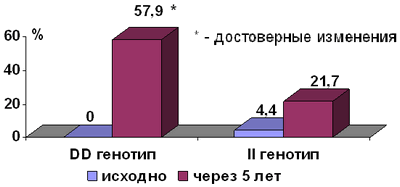
Рис. 1. Динамика развития ранних признаков атеросклероза с утолщением ТКИМ ОСА более 1,0 мм либо образованием атеросклеротических бляшек в каротидных артериях.
За 5-ти летний период наблюдения у части пациентов изучаемых групп были выявлены ранние признаки атеросклеротического поражения каротидных артерий в соответствии со значением ТКИМ ОСА, превышающей 1,1 мм (рис. 1). В группе пациентов с генотипом DD доля таких пациентов была в 2,7 раза выше, чем у пациентов с генотипом II, составляя 57,9 против 21,7% (Р<0,001).
В качестве дополнительного фактора атерогенности на заключительном этапе исследования оценивался аполипопротеиновый индекс атерогенности. У пациентов-носителей аллеля D данный коэффициент в среднем был достоверно выше, чем при I аллеле и составлял 0,91±0,02 против 0,83±0,01 (р=0,004). Следует отметить, что в группе гомозиготных по D аллелю пациентов индекс атерогенности не только превышал нормативные значения, но и достоверно отличался от значений в группах при носительстве I аллеля.
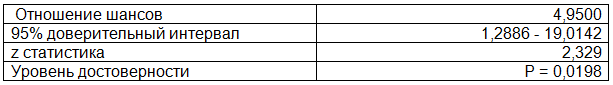
Для оценки значимости и достоверности влияния носительства DD генотипа на риск развития атеросклеротического поражения каротидных артерий использовали метод расчета ОШ. Результаты показали (табл. 1), что риск развития ранних признаков атеросклероза при генотипе DD почти в 5,0 раз выше, чем при генотипе II, с 95% доверительным интервалом от 1,29 до 19,0 (Р=0,02). Иными словами, наличие DD генотипа гена АПФ в 5 раз увеличивает риск развития раннего атеросклероза с локальным утолщением ТКИМ ОСА более 1,1 мм либо образованием атеросклеротических бляшек в каротидных артериях.
Таблица 1. Результаты расчета ОШ развития ранних признаков атеросклероза у пациентов носителей генотипа DD
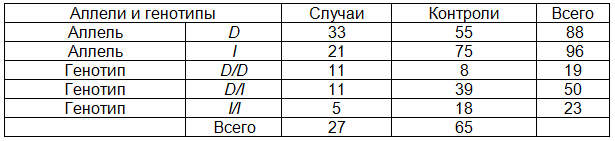
Задачей дальнейшего изучения явился поиск аллеля гена АПФ, частота которого значимо различается в группах пациентов с признаками раннего атеросклероза (случаи) и здоровых лиц (контроли), и расчет показателя относительного риска для носителей данного аллеля. Для этих целей использовали метод расчета совокупного генетического риска по мультипликативной модели наследования, которая включает два шага: 1) преобразование значения отношения шансов для конкретного полиморфного локуса в значение относительного риска и 2) вычисление значения совокупного относительного риска на основе значений рисков для локусов предрасположенности из первого шага. В табл. 2 представлены исходные данные для расчета с учетом полиморфизма гена АПФ.
Таблица 2. Распределение пациентов с признаками раннего атеросклероза (случаи) и здоровых лиц (контроли)
В табл. 3 и 4 представлены распределения частот генотипов, которые соответствуют равновесию Харди-Вайнберга (Р>0,05) и для случаев, и для контролей.
Таблица 3. Тест Харди-Вайнберга для случаев (тест c2, df = 1)
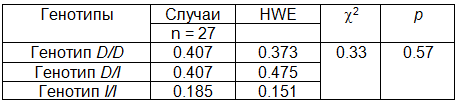
Таблица 4. Тест Харди-Вайнберга для контролей (тест c2, df = 1)
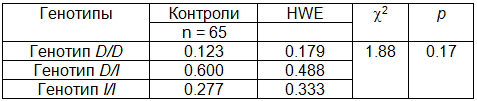
Выполнение условия равновесия Харди-Вайнберга для случаев и контролей позволяет использовать мультипликативную модель наследования для оценки риска развития атеросклероза (табл. 5).
Таблица 5. Мультипликативная модель наследования (тест c2, df = 1)
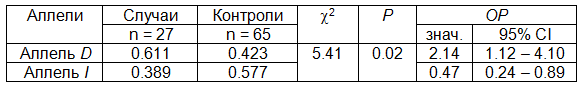
Таким образом, только носительство D аллеля гена АПФ достоверно ассоциировалось с наличием ранних признаков атеросклероза, выявленного в 61,1%. Oтносительный риск составил 2,14 с 95% доверительным интервалом в диапазоне от 1,12 до 4,10 (Р=0,02).
Данные, полученные в нашем исследовании подтверждают раннее опубликованные результаты. В исследовании ELSA при обследовании 320 больных артериальной гипертонии у больных с DD генотипом была выявлена достоверно большая ТКИТ ОСА и большая распространенность атеросклероза сонных артерий, по сравнению с больными, имеющими II и ID генотип [11]. В работе M.Hosoi et al. анализировалась ТКИМ сонных и бедренных артерий у больных с СД 2 типа. ТКИМ ОСА оказалась достоверно выше у больных с DD генотипом [12].
Таким образом, в нашей работе носительство D аллеля гена АПФ ассоциировалось с наличием ранних признаков атеросклеротического поражения сосудов, проявляющимся утолщением комплекса интима-медиа сонных артерий более 1,1 мм, либо образованием атеросклеротической бляшки в каротидных артериях через 5 лет наблюдения. Атерогенность дислипидемии в группе DD генотипа дополнительно характеризовалась увеличением аполипопротеинового индекса атерогенности.
Оценка кардиометаболического риска с учетом генетических особенностей развития синдрома позволит оптимизировать проведение скрининговых программ и лечебно-профилактических мероприятий.
