Актуальность. В процессе естественного течения пороков митрального клапана (МК) следует обратить внимание на неизбежное возникновение ремоделирования сердца в результате нарушения гемодинамики [2]. Одной из главных причин ухудшения отдаленных результатов хирургической коррекции пороков МК является развитие или прогрессирование сердечной недостаточности (СН). По данным литературы выживаемость пациентов и частота развития симптомов СН в послеоперационном периоде зависят от систолической дисфункции левого желудочка (ЛЖ) на момент коррекции порока МК и типа его геометрического ремоделирования [7, 10, 12].
Процесс дилатации сердца у пациентов с поражением МК затрагивает не только ЛЖ, но и левое предсердие (ЛП) [13, 14]. Частота атриомегалии по разным данным составляет от 7,8 до 19 % всех больных, оперированных по поводу митральных пороков [1, 4, 5, 15].
Увеличение ЛП развивается при пороках МК вследствие хронической перегрузки ЛП объёмом и давлением. Это приводит к увеличению его размеров, растяжению волокон предсердной проводящей системы и, вследствие этого, к развитию фибрилляции предсердий (ФП).
Пароксизмы ФП могут привести к отеку легких у пациентов с критическим МС вследствие резкого увеличения давления в ЛП. Таким образом, частота сердечных сокращений (ЧСС) и вид ритма являются критической детерминантой трансклапанного градиента давления [3, 8, 11].
Таким образом, дилатацию ЛП можно рассматривать как значимый фактор риска хирургического лечения пациентов с пороками МК и как независимый фактор риска внезапной смерти, а также развития нарушений ритма сердца, одним из основных которых является возникновение ФП. При этом нет четкого определения, при каких размерах ЛП возникают эти осложнения [6, 9]. Поэтому с середины XX века, совместно с коррекцией порока МК стали выполнять пластику ЛП, направленную на уменьшение объёма [16].
Таким образом, всесторонняя оценка геометрии ЛП и ЛЖ с использованием эхокардиографических (ЭхоКГ) параметров ремоделирования миокарда и современных методик исследования до и после хирургической коррекции порока может помочь выбрать оптимальный срок оперативного вмешательства.
Цель исследования. Оценить закономерности ремоделирования левых отделов сердца у пациентов, оперированных по поводу пороков МК с высокой лёгочной гипертензией (ЛГ) при помощи сопоставления результатов дооперационного и послеоперационного обследования.
Материалы и методы. Проанализированы результаты лечения 98 пациентов с пороками МК в Национальном центре грудной и сердечно-сосудистой хирургии им. Cвятого Георгия ФГБУ «Национальный медико-хирургический центр им. Н.И. Пирогова Росздрава» в период с 2009 года по 2011 год.
Пациенты были разделены на 2 группы. В первую группу вошли пациенты с высокой ЛГ (n=52). В исследование включались больные, у которых давление в легочной артерии (ДЛА) по данным ЭхоКГ составляло более 50 мм рт.ст.
Среди пациентов I группы выделили две подгруппы. К подгруппе Ia отнесли пациентов с митральным стенозом (МС) (n=28), к подгруппе Ib – пациентов с митральной недостаточностью (МН) (n=24). Пациентов с сочетанным пороком МК относили либо к первой, либо ко второй группе, в зависимости от преобладания того или иного поражения клапана. В первой подгруппе были пациенты с площадью отверстия МК не более 1,5 см2, и с регургитацией менее 2 степени. Во второй подгруппе – пациенты, у которых регургитация на МК была 3 степени. Обязательным условием являлось интраоперационное подтверждение данных ЭхоКГ на основании визуального контроля хирурга.
Во вторую группу включили пациентов с пороками МК без наличия высокой ЛГ (n=46). Их аналогичным образом разделили на подгруппы. В группу IIa вошли 24 пациента с МС, а в группу IIb - 22 пациента с МН.
Среди пациентов было 55 (56,12%) мужчин и 43 (43,88%) женщин. Распределение пациентов по возрасту было от 21 до 76 лет. Средний возраст в первой группе составил 53,4±11,70 лет, во второй – 52,6±14,24 лет.
У большинства пациентов (n=32) в качестве осложнения естественного развития порока наблюдалась ФП, из них у 4 пациентов выявлена пароксизмальная форма ФП, у 20 пациентов регистрировался синусовый ритм.
В каждой группе рассматривались оперативные вмешательства, направленные как на пластику МК, так и на его протезирование (табл. 1).
Таблица 1. Распределение пациентов по типу выполненных оперативных вмешательств
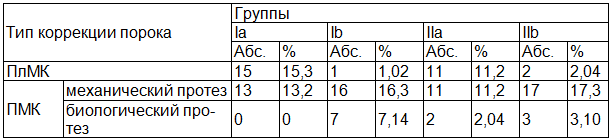
При поступлении в клинику всем пациентам проводилось подробное объективное и полное инструментальное обследование, включающее в себя электрокардиографические, рентгенологические и эхокардиографические исследования (в том числе интраоперационное чреспищеводное ЭхоКГ). ЭхоКГ проводилась до операции, а так же необходимое количество исследований выполнялось интраоперационно и в послеоперационном периоде на аппарате «General Electric Vivid 7» (США) с использованием трансторакальных и транспищеводных датчиков с частотой 2,5-3,5 МГц. Протокол исследования включал в себя: паспортные данные пациента, размеры камер сердца (ЛП, правого предсердия (ПП), правого желудочка (ПЖ), толщину межжелудочковой перегородки (МЖП) и задней стенки левого левого желудочка (ЗС ЛЖ). По методу Teichholz определялись структурно-функциональные характеристики ЛЖ: конечно-диастолический размер (КДР), конечно-систолический размер (КСР), ударный объем, конечно-диастолический объем (КДО), конечно-систолический объем (КСО), фракция выброса (ФВ). Дополнительно рассчитывали массу миокарда ЛЖ (ММ ЛЖ) по формуле R.B.Devereux-N.Reichek и высчитывали индекс массы миокарда ЛЖ (ИММ ЛЖ), как его отношение к площади поверхности тела. Также определяли соотношение ММ ЛЖ к КДО ЛЖ и отношение ИММ ЛЖ к индексу КДО ЛЖ (ИКДО ЛЖ), относительную толщину стенок ЛЖ (ОТС ЛЖ), как отношение суммы толщины в диастолу МЖП и ЗС ЛЖ к КДР ЛЖ.
Критериями ремоделирования левых отделов сердца считали увеличение отношения объёма ЛП к КДО ЛЖ, ММ ЛЖ к КДО ЛЖ, индексированных КДО ЛЖ и КСО ЛЖ, так как данные параметры зависят от пола, роста, массы тела человека, ИММ ЛЖ к ИКДО ЛЖ, ОТС ЛЖ.
Результаты исследования и их обсуждение. В предоперационном периоде, наибольшие значения ЭхоКГ показателей сердца отмечались у пациентов Ib группы. ММ ЛЖ у них была практически вдвое выше, чем в группе Ia (487,6±10,47 г и 213.2±17,46 г, соответственно). У пациентов с МН (группа Ib) наблюдалось выраженное увеличение КДО ЛЖ (219,4±84,19 мл), в то время как у больных с МС (группа Ia) данное значение было существенно (p<0,05) ниже (125,9±46,95 мл). Такая же зависимость наблюдалась при сопоставлении значений КСО ЛЖ – 104,9±57,34 мл (группа Ib) и 62,2±27,27 мл (группа Ia) (p<0,05).
У пациентов II группы в сравнении с показателями I группы до операции отмечались меньшие значения объемно-геометрических показателей ЛЖ. ММ ЛЖ у пациентов группы IIb была значительно меньше в сравнении с пациентами группы Ib – 487,6±10,47 г и 359,6±32,1 г, соответственно (p<0,05). Среди пациентов с МС не было достоверных различий этого показателя – 213,2±17,46 г (группа IIa) и 208,7±16,8 г (группа Ia), соответственно (p>0,05). Подобная зависимость наблюдалась также при сравнении ИММ ЛЖ. У пациентов в Ia группе это значение составило 126,6±18,02 г/м2, а во IIa группе - 114,1±9,6 г/м2 при этом отсутствовало достоверное различие (p>0,05).
При сравнении групп с МН (группы Ib и IIb) наблюдалось достоверное различие ИММ ЛЖ – 251,6±14,85 г/м2 (группа Ib) и 189,3±39,7 г/м2 (группа IIb) (p<0,05). Значения КДО ЛЖ среди групп с МС (группы Ia и IIa) достоверно не различались, в то время как у пациентов с МН наблюдалось достоверное различие этого показателя: 219,4±84,19 мл (группа Ib) и 143,4±34,1 мл (группа IIb) (p<0,05).
Наиболее выраженные признаки ремоделирования отмечались среди пациентов с исходной высокой ЛГ. В группе Ia выявлено наибольшее ремоделирование ЛП (объем ЛП 396,5±237,7 мл), а в группе Ib – ремоделирование ЛЖ (КДО ЛЖ 219,4±84,19 мл). В группе пациентов без высокой ЛГ в предоперационном периоде отмечено выраженное ремоделирование ЛП (объем ЛП 247,2±39,4 мл – группа IIa и 220,3±41,8 мл – группа IIb), характеристики ЛЖ находились в пределах допустимых величин (КДО ЛЖ 128,3±25,9 мл и 143,4±34,1 мл, соответственно).
У пациентов Ib группы при анализе показателей КДО ЛЖ, КСО ЛЖ, КДР ЛЖ, КСР ЛЖ до операции достоверно наблюдалась связь между величиной ДЛА и значением данных параметров ЭхоКГ (p<0,05). У пациентов остальных групп такая достоверная связь между этими показателями отсутствовала.
Показатели ДЛА измерялись по данным ЭхоКГ до операции и катетеризации ЛА и перед и после коррекции порока МК, а также в отделении реанимации до и после экстубации пациентов. У пациентов Ia группы регистрировались более высокие показатели ДЛА перед операцией (табл. 2).
Таблица 2. Изменение систолического ДЛА у пациентов Ia и Ib групп
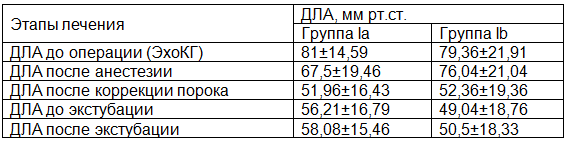
В связи с тем, что повышение ДЛА у пациентов с пороками МК неизбежно сопровождалось развитием недостаточности ПЖ, увеличение объёмно-геометрических показателей ЛЖ при высокой ЛГ позволяло считать их косвенными признаками систолической дисфункции ПЖ.
При анализе результатов была выявлена закономерность между объемно-геометрическими характеристиками сердца и клинической картиной заболевания среди пациентов двух групп. При наличии стадии компенсации СН, как правило, отмечалось увеличение таких показателей, как КДР или КДО ЛЖ. При субкомпенсации возникало сочетание повышенных показателей КДР и КДО ЛЖ. Стадии декомпенсации СН в большинстве случаев соответствовало совместное повышение КДО, КДР, КСО и КДО ЛЖ, это также соответствовало достоверным клиническим признакам заболевания.
В послеоперационном периоде в группе Ia ИММ ЛЖ уменьшился со 126,6±18,02 г/м2 до 123,4±12,05 г/м2 (p>0,05). В группе Ib ИММ ЛЖ составил исходно 251,6±14,85 г/м2 и после операции 224,40±15,01 г/м2 (p<0,05), в группе IIa – 114,1±9,6 г/м2 и 106,6±7,8 г/м2 (p>0,05), в группе IIb – 189,3±39,7 г/м2 и 135,6±21,7 г/м2 (p<0,05).
В послеоперационном периоде в группе Ia ИММ ЛЖ уменьшился со 126,6±18,02 г/м2 до 123,4±12,05 г/м2 (p>0,05) В группе Ib ИММ ЛЖ составил исходно 251,6±14,85 г/м2 и после операции 224,40±15,01 г/м2 (p<0,05), в группе IIa – 114,1±9,6 г/м2 и 106,6±7,8 г/м2 (p>0,05), в группе IIb – 189,3±39,7 г/м2 и 135,6±21,7 г/м2 (p<0,05). Следовательно, у больных с МН после операции произошел регресс ММ ЛЖ, причем преимущественно в группе IIb. У больных с МС (группы Ia и IIa) он достоверно не снизился.
Процесс нормализации объёмно-геометрических характеристик левых отделов сердца в послеоперационном периоде наблюдался у пациентов обеих групп. В группе Ia КДО ЛЖ уменьшился со 125,9±46,95 мл до 119,5±32,45 мл (p>0,05) (рис. 1), а ИКДО ЛЖ увеличился с 61,35±28,32 мл/м2 до 71,67±21,63 мл/м2 (p>0,05), КСО ЛЖ достоверно не снизился, соответственно, составив 62,2±27,27 мл и 61,20±25,08 мл (p>0,05) (рис. 2), индекс конечно-систолического объема (ИКСО) ЛЖ также достоверно не изменился – 31,9±14,74 мл/м2 и 31,60±13,13 мл/м2, соответственно (p>0,05), индекс конечно-диастолического размера (ИКДР) ЛЖ уменьшился с 2,84±0,51 см/м2 до 2,36±0,46 см/м2 (p<0,05). Таким образом, у пациентов Ia группы после операции объемно-геометрические показатели ЛЖ достоверно не уменьшились, но их значения приближались к норме или находились в пределах пограничных величин. В этой группе пациентов отмечалось значительное снижение объема ЛП – с 396,5±237,7 мл до 190,7±60,2 мл (p<0,05).
Пациенты Ib группы с МН характеризовались значительным уменьшением объёмных показателей как ЛЖ, так и ЛП. Так, в группе Ib КДО ЛЖ уменьшился с 219,4±84,19 мл до 196,90±78,95 мл (p<0,05), а ИКДО ЛЖ со 131,2±52,5 мл/м2 до 110,60±47,62 мл/м2 (p<0,05). КСО ЛЖ достоверно не снизился, соответственно, составив 104,9±57,34 мл и 99,70±40,34 мл (p>0,05), ИКСО ЛЖ также достоверно не изменился, составив 65,8±27,68 мл/м2 и 52,20±23,65 мл/м2, соответственно (p>0,05), ИКДР ЛЖ уменьшился с 3,63±0,67 см/м2 до 2,86±0,95 см/м2 (p<0,05). Объем ЛП также изменился с 280,0±70,5 мл до 159,4±55,6 мл.
Среди пациентов II группы снижение показателей было заметно в меньшей степени, однако, наблюдалась достоверная связь между ними (p<0,05).
В группе IIa КДО ЛЖ уменьшился со 128,3±25,9 мл до 121,3±19,7 мл (p<0,05), а ИКДО ЛЖ с 63,4±16,8 мл/м2 до 61,7±19,7 мл/м2 (p<0,05). КСО ЛЖ достоверно не снизился, соответственно, составив 61,8±17,6 мл и 60,5±12,8 мл (p>0,05), ИКСО ЛЖ достоверно не изменился, составив 32,8±19,1 мл/м2 и 30,8±17,4 мл/м2, соответственно (p>0,05), ИКДР ЛЖ также достоверно не уменьшился (2,85±0,59 см/м2 и 2,63±0,72 см/м2) (p>0,05). Объем ЛП достоверно изменился с 247,2±39,4 мл до 191,1±26,8 мл (p<0,05).
У пациентов группы IIb КДО ЛЖ уменьшился с 143,4±34,1 мл до 132,7±14,9 мл (p<0,05), а ИКДО ЛЖ с 76,8±25,9 мл/м2 до 69,3±21,1 мл/м2 (p<0,05). КСО ЛЖ также снизился с 68,5±29,7 мл до 62,7±11,4 мл (p<0,05), ИКСО ЛЖ изменился, составив 28,6±11,3 мл/м2 и 32,7±13,5 мл/м2, соответственно (p<0,05), ИКДР ЛЖ достоверно не уменьшился, составив 2,92±0,76 см/м2 и 2,84±0,43 см/м2, соответственно (p>0,05). Объем ЛП изменился с 220,3±41,8 мл до 208,3±23,7 мл (p<0,05).
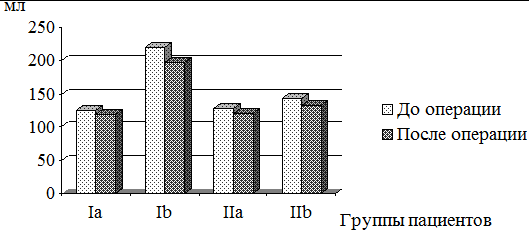
Рис. 1. Динамика изменения КДО ЛЖ в результате хирургической коррекции порока МК у пациентов I и II групп.
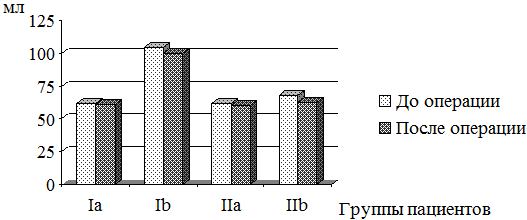
Рис. 2. Динамика изменения КСО ЛЖ в результате хирургической коррекции порока МК у пациентов I и II групп.
Маловыраженные изменения абсолютных значений этих показателей, вероятно, связаны с тем, что исходные характеристики левых отделов сердца были изменены в меньшей степени.
Отношение ММ ЛЖ к КДО ЛЖ достоверно изменилось в Ia, Ib и IIb группах. В группе Ia отмечалось наибольшее снижение этого показателя (на 34,5%) с 2,64±1,39 г/мл до 1,73±1,28 г/мл (p<0,05). В группе Ib на 14,1% с 3,11±1,04 г/мл до 2,67±1,00 г/мл (p<0,05). В группе IIa не отмечено достоверного изменения отношения ММ ЛЖ к КДО ЛЖ – 1,7±0,5 г/мл и 1,66±0,41 г/мл. А в группе IIb данное значение изменилось с 2,4±0,6 г/мл до 1,81±0,7 г/мл (p<0,05). Это могло свидетельствовать о преобладании процесса регресса ММ ЛЖ над процессом уменьшения геометрических размеров ЛЖ. Причем, преобладание этого процесса наблюдалось в группе Ia.
Результаты исследования указывают, что появление ЛГ, как осложнения пороков МК вызывает дальнейшее нарастание функциональных изменений как левых, так и правых отделов сердца и усугубляет СН. Представленные данные позволяют сделать вывод о том, что больные с пороками МК, осложненными высокой ЛГ, являются более тяжелым контингентом пациентов с выраженными объемно-геометрическими изменениями ЭхоКГ показатели, всех отделов сердца. Высокая ЛГ является одной из предпосылок прогрессирования СН у больных с митральными пороками.
С целью оценки влияния хирургического лечения у пациентов с пороками МК на течение послеоперационного ремоделирования ЛП, проведен анализ данных ЭхоКГ исследования в среднеотдаленном периоде.
Для характеристики ремоделирования ЛП проводился анализ соотношения объема ЛП к КДО ЛЖ. Данный показатель позволял оценить степень выраженности дилатации ЛП.
До операции в группе Ia это значение составило в среднем 3,50±3,87, что достоверно указывало на преобладание дилатации ЛП в ремоделировании левых отделов сердца. В группе Ib данное отношение составило 1,15±0,78, что свидетельствовало о меньшей дилатации ЛП. Во IIa группе отношение объёма ЛП к КДО ЛЖ равнялось 1,98±0,62, во IIb группе – 1,6±0,63.
В результате оперативного лечения уменьшение объёма ЛП произошло в обеих группах. В Ia группе у пациентов с МС регресс объёма полости ЛП был менее выраженным в сравнении с группой Ib. Так у всех пациентов Ia группы произошло уменьшение объёма ЛП с 396,5±237,7 до 190,7±60,2 мл (p<0,05). У пациентов Ib группы объём ЛП снизился с 280,0±70,5 до 159,4±55,6 мл (p<0,05). При анализе ремоделирования ЛП выявлено, что в группе пациентов с МС отношение объёма ЛП к КДО ЛЖ значительно уменьшилось с 3,50±3,87 до 1,38±0,10 (p<0,05). В группе пациентов с МН это отношение уменьшилось в меньшей степени с 1,15±0,78 до 0,97±0,09 (p>0,05).
Во II группе также отмечена динамика уменьшения объема полости ЛП. Однако, по сравнению с I группой, тенденция к уменьшению объема была выражена в меньшей степени, что может быть связано с исходными более низкими объемными показателями полости ЛП у пациентов группы без высокой ЛГ. В группе IIa отмечено снижение объема ЛП с 247,2±39,4мл до 191,1±26,8 мл. В группе IIb – с 220,3±41,8 мл до 208,3±23,7 мл.
Наибольшее уменьшение объема полости ЛП отмечалось у пациентов I группы с исходной высокой ЛГ. В Ia и IIa группах наблюдалась достоверная динамика уменьшения объема ЛП, причем этот процесс преобладал в группе Ia у больных с МС (рис. 3).
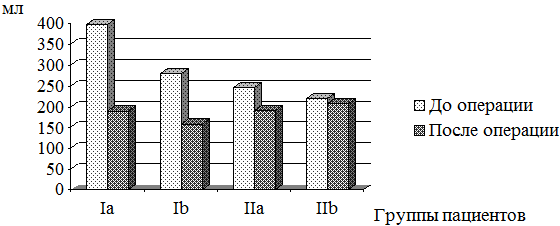
Рис. 3. Динамика изменения объёма ЛП в результате хирургической коррекции порока МК у пациентов I и II групп.
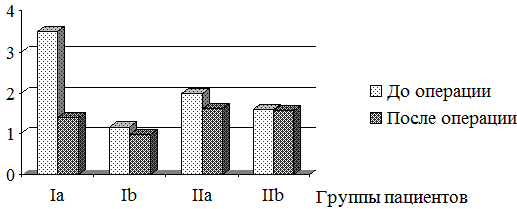
Рис. 4. Динамика изменения отношения объема ЛП к КДО ЛЖ в результате хирургической коррекции порока МК у пациентов I и II групп.
В результате оперативного лечения произошло изменение отношения объема ЛП к КДО ЛЖ. В группе Ia это значение уменьшилось с 3,50±0,87 до 1,38±0,10 (p<0,05), что указывало на выраженное уменьшение объема ЛП по отношению к объему ЛЖ. Во IIa группе отношение объёма ЛП к КДО ЛЖ после операции уменьшилось с 1,98±0,62 до 1,62±0,41 (p<0,05). В группах Ib и IIb данное отношение достоверно не изменилось, составив в группе Ib – 1,15±0,78 до операции и 0,97±0,09 после (p>0,05), а в группе IIb – 1,6±0,63 и 1,58±0,29, соответственно (p>0,05), что свидетельствовало об уменьшении объема как ЛП, так и ЛЖ в одинаковой степени (рис.4).
В связи с большим объёмом ЛП у ряда пациентов во время операции выполнялась пликационная редукционная атриопластика ЛП. Пластика ЛП выполнена у 10 пациентов группы Ia, у 6 пациентов группы Ib и у 2 пациентов группы IIb. Значительная динамика снижения отношения объема ЛП к КДО ЛЖ достоверно отмечена в большей степени у тех пациентов, кому во время операции выполнялась атриопластика ЛП. Так, в группе Ia объем полости ЛП уменьшился на 48,6±26,9%, а в группе Ib – на 40,55±28,5%. (p<0,05). При этом ДЛА через 6-12 месяцев после операции снизилось на 34,2±4,8% у больных группы Ia и на 42,7%±6,2% среди пациентов группы Ib (p<0,05).
Для оценки ремоделирования ЛП и выбора хирургической тактики, исходя из полученных данных, можно использовать показатель отношения объема ЛП к КДО ЛЖ. В случае если это значение более 1,0 следует рекомендовать выполнение редуцирующей атриопластики ЛП.
С целью определения влияния уменьшения объёма ЛП на клиническое течение послеоперационного периода у пациентов после коррекции порока МК проанализирована частота нарушений ритма.
В группе Ia исходно ФП регистрировалась у 26 (92,8%) пациентов. После операции ФП сохранилась у 17 (60,7%) пациентов, среди них 2-м выполнялась атриопластика, синусовый ритм восстановился у 9 больных, среди них 4-м выполнялась атриопластика.
В группе Ib исходно ФП наблюдалась у 20 (83,3%) больных. После операции синусовый ритм регистрировался у 12 пациентов (50%), среди них у 4 была выполнена редукция объёма ЛП, ФП сохранилась у 8 пациентов, у 1 из них выполнялась атриопластика.
В группе IIa до операции ФП осложнила течение заболевания у 6 (25%) пациентов, восстановление синусового ритма в результате хирургического лечения произошло у 5 (83%) больных, аритмия сохранялась у 1 пациента.
В группе IIb у 8 (36,4%) больных до операции имелись нарушения ритма по типу ФП. После оперативного вмешательства у 6 из них регистрировался синусовый ритм (у 2 пациентов была выполнена атриопластика ЛП), а у 2 сохранилась ФП.
Необходимо отметить, что у тех пациентов, у которых при выписке регистрировалась ФП, нарушение ритма рецидивировало на 1-2 сутки, наблюдалась резистентность к антиаритмической терапии.
Выводы. Таким образом, выраженное ремоделирование ЛЖ до операции наблюдалось у пациентов с МН, осложненной высокой ЛГ. У них преобладало изменение геометрии ЛЖ. У пациентов с МС, осложненным высокой ЛГ, также отмечалось ремоделирование левых камер сердца. Однако, преобладающим у них было увеличение ЛП. У пациентов с МС и с МН без исходной высокой ЛГ превалировало ремоделирование за счет увеличения ЛП. Закономерность прослеживалась между структурными изменениями и клинической картиной заболевания. При прогрессировании СН отмечались выраженные изменения ЭхоКГ характеристик левых отделов сердца. После операции уменьшение объемно-геометрических показателей прослеживалось в обеих группах. У пациентов с МС при высокой ЛГ, наиболее выражено отмечалось ремоделирование ЛП. У пациентов с МН и высокой ЛГ преобладало обратное ремоделирование ЛЖ. Среди пациентов без исходной высокой ЛГ степень снижения показателей была достоверно менее выраженной. У пациентов с МН без исходной высокой ЛГ выявлено увеличение отношения ММ ЛЖ к КДО ЛЖ, что указывает на преобладание процесса уменьшения размеров ЛЖ над процессом регресса ММ ЛЖ. Совместная коррекция пороков МК и использование шовной атриопластики ЛП значительно уменьшает полость ЛП, что в свою очередь способствует нормализации объемно-размерных показателей левых отделов сердца. Редукция объема полости ЛП позволяет снизить риск рецидива ФП в послеоперационном периоде на фоне поддерживающей медикаментозной терапии. Для оценки ремоделирования ЛП и выбора хирургической тактики можно использовать показатель отношения объема ЛП к КДО ЛЖ. В случае если это значение является более 1,0 следует рекомендовать выполнение редуцирующей атриопластики ЛП. Изучение ремоделирования левых отделов сердца подтверждает целесообразность и необходимость более ранней хирургической коррекции митральных пороков и может обеспечить оценку своевременного оперативного лечения пациентов с пороками МК.
