Метаболический синдром (МС), характеризуется экспертами Всемирной Организации Здравоохранения (ВОЗ) как «пандемия XXI века», в связи с его широкой распространенностью среди населения, высоким риском развития сердечно-сосудистых заболеваний и преждевременной смертностью. По оценкам ВОЗ в 2005 г. во всем мире приблизительно 1,6 млрд. взрослых людей (в возрасте старше 15 лет) имели избыточный вес, а как минимум 400 млн. страдали ожирением, кроме того 20 млн. детей в возрасте до 5 лет имели избыточной вес. По прогнозам ВОЗ, к 2015 г. примерно 2,3 млрд. взрослых людей будет иметь избыточный вес и более 700 млн. будет страдать ожирением. Существуют убедительные сведения о том, что ожирение может явиться как независимым фактором риска, так и отягощающим моментом, существенно ухудшающим течение и прогноз сердечно-сосудистых заболеваний [1].
Отмечено, что риск развития кардиоваскулярной и общей смертности увеличивается даже при достижении показателя массы тела пределов верхней границы нормы. Установлено, что у больных артериальной гипертензией, страдающих ожирением, риск развития ишемической болезни сердца (ИБС) повышен в 2–3 раза, а риск инсульта - в 7 раз. Результат метаанализа трех проспективных исследований (IRAS, MCDC и SAHS) продолжительностью от 5 до 7,5 лет, в которых отслеживались инциденты развития сахарного диабета (СД) у различных групп с метаболическими нарушениями, показал, что у лиц с МС и нарушением толерантности к глюкозе (НТГ) риск развития СД в ближайшие 5 лет составляет 40%, что в 2,5 раза выше по сравнению с группой больных с НТГ без МС [2,3].
Исследование PIUMA (Progetto Ipertensione Umbria Monitoraggio Ambulatoriale), которое включало 1742 пациентов с АГ без сердечно-сосудистых осложнений (ССО), показало, что МС усиливает риск, связанный с высоким артериальным давлением (АД), независимо от ряда традиционных факторов сердечно-сосудистого риска. В течение среднего периода наблюдения (4,1 года) наличие МС было значительным независимым предиктором как сердечно-сосудистых (отношение рисков 1,5), так и цереброваскулярных (отношение рисков 2,1) событий [4]. В основе патогенеза МС лежит инсулинорезистентность [5].
При выраженной инсулинорезистентности на миокард воздействуют множественные факторы, в том числе свободные жирные кислоты, инсулиноподобный фактор роста, которые приводят к ремоделированию миокарда и формированию его электрической нестабильности. Все это в конечном итоге может приводить к развитию различных нарушений ритма сердца, в т.ч. и желудочковых нарушений ритма (ЖНР). ЖНР достаточно гетерогенная патология по механизму возникновения, с высокой частотой встречаемости среди населения (от 30 до 70%). Наиболее часто ЖНР разделяют на 2 большие группы – функциональные или идиопатические, не связанные с первичным поражением сердца и органические [6]. Сформировалось мнение, что ЖНР у совершенно здоровых людей являются прогностически благоприятными и относятся к группе неопасных для жизни и здоровья [7-11]. Однако ряд рандомизированных исследований подвергают сомнению данное утверждение. В частности Leenhard и соавт. (1995) наблюдали группу из 21 пациента (дети и взрослые) с полиморфной катехоламин-чувствительной желудочковой тахикардии (ЖТ), возникающей на фоне физической нагрузки (ФН) или психоэмоционального стресса, из которой 10 пациентов умерли внезапно в среднем возрасте 19,5 лет [12]. По данным другого исследования у больных ЖНР без видимой патологии миокарда возникала аритмогенная дисплазия правого желудочка через 15 лет наблюдения [13]. Однако проблема ЖНР у пациентов с МС изучена недостаточно. Практически нет исследований, которые бы отражали течение ЖНР в зависимости от наличия МС. Отечественные исследования единичны как в вопросах эпидемиологии МС, так и в вопросах взаимоотношений МС с ЖНР. До настоящего момента не существует четких рекомендаций по тактике ведения пациентов с ЖНР и метаболическим синдромом. Все это указывает на актуальность проводимой работы.
Материалы и методы. В исследование включено 55 человек с ЖНР и МС (подгруппа 1, 20 мужчин и 35 женщин, средний возраст 62,77±9,77) и 20 человек с ЖНР без МС (подгруппа 2, 7 мужчин и 13 женщин, средний возраст 61,84±12,69). Критериями включения в исследование были ЖНР не ниже II градации (по B. Lown, M. Wolf в модификации М. Ryan, 1975 [14]) и наличие критериев МС [15].
В число основных ассоциируемых заболеваний входили:
- артериальная гипертензия (АГ) – 56 (93%);
- ИБС (стенокардия напряжения) – 10 (16,7%);
- хроническая сердечная недостаточность I ФК – 42 (70%);
- хроническая сердечная недостаточность II ФК – 18 (30%);
- нарушение толерантности к углеводам – 24 (40%);
- ожирение – 27 (45%).
В исследование не включали лиц с наличием:
- перманентной фибрилляцией предсердий,
- атриовентрикулярной блокады 2,3 степени,
- дополнительных пучков проведения,
- острого коронарного синдрома,
- гемодинамически значимые врожденными или приобретенными пороки сердца,
- инфарктом миокарда в анамнезе,
- хронической сердечной недостаточностью III-IV функционального класса,
- сахарным диабетом,
- нарушением функции щитовидной железы,
- суб- и декомпенсированный синдромом слабости синусного узла.
Всем пациентам после обследования на исходном фоне (эхокардиоскопия, холтеровское мониторирование ЭКГ (ХМ-ЭКГ), тредмилл-тест) подбиралась эффективная антиаритмическая терапия. В качестве анитаритмической терапии использовались бета-адреноблокаторы, соталол, амиодарон или их комбинации [16-18]. Эффективность антиаритмической терапии оценивалась положительно, если общее количество одиночных желудочковых экстрасистол уменьшалось в 4 раза и более, а количество желудочковых эктопий высоких градаций (IVA и выше по B. Lown, M. Wolf в модификации М. Ryan, 1975 [14]) не менее чем в 10 раз или таковые отсутствовали [19].
Все пациенты, участвующие в исследовании и имевшие показания для катетерной аблации ЖНР, категорически от неё отказались. В соответствии с рекомендациями по МС ВНОК (2009), пациентам 1-й подгруппы, после проведенного лабораторного обследования применялась антигипертензивная, гиполипидемическая терапия, беседы по коррекции образа жизни, назначался метформин [20]. Важное значение придавалось как снижению веса, так и приему метформина в терапевтической дозе.
Группы были сопоставимы по ассоциированным заболеваниям и сопутствующей терапии (табл. 1). В число основных ассоциируемых заболеваний входили:
- артериальная гипертензия (АГ) – 71 (95%);
- ИБС (стенокардия напряжения) – 14 (18,7%);
- хроническая сердечная недостаточность I ФК – 55 (73%);
- хроническая сердечная недостаточность II ФК – 20 (17%);
Нарушение толерантности к углеводам и ожирение выявлялись только в подгруппе 1 и составляли 45% и 48% соответственно. Всем пациентам проводилось лабораторное обследование, при котором определялось содержание общего холестерина (ОХ, ммоль/л), триглицеридов (ТГ, ммоль/л), холестерина липопротеидов высокой плотности (ЛПВП, ммоль/л) стандартным ферментативным методом с последующим расчеом липопротеинов низкой плотности (ЛПНП, ммоль/л) по формуле Friedewald, расчитывался индекс атерогенности (ИА). Уровень гликемии определяли глюкозооксидазным методом на аппарате КФК-3-01 (Россия), инсулина – иммунохемилюминесцентным методом на аппарате Immulite 2000 (США).
Таблица 1. Распределение пациентов (абс. %) в зависимости от получаемой исходно терапии
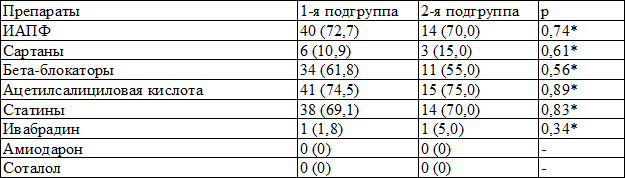
Примечание: ИАПФ – ингибиторы ангиотензинпревращающего фермента, * - χ2
Расчитывали индекс инсулинорезистентности HOMA-2 с помощью компьютерной модели HOMA-2, отражающей логарифмическую зависимость функции бета-клетки поджелудочной железы и чувствительности к инсулину периферических тканей. Оценка качества жизни и толерантности к физической нагрузке проводилась с помощью Миннесотсского опросника для пациентов с сердечной недостаточностью и теста 6-минутной ходьбы. При оценке исходных клинико-лабораторных показателей выявляются более высокие показатели окружности талии, веса, индекса массы тела (ИМТ), артериального давления, триглицеридов (ТГ), инсулина и инсулинорезистентности в подгруппе с метаболическим синдромом (табл. 2).
Таблица 2. Лабораторные и клинические характеристики до лечения (M±m)
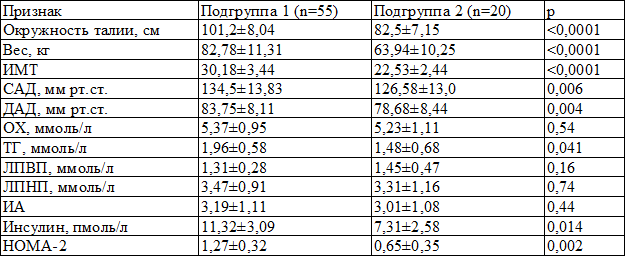
Примечание: САД – систолическое АД, ДАД – диастолическое АД, ИМТ – индекс массы тела
Для оценки структурно-геометрических и функциональных показателей миокарда проводили эхокардиоскопию (ЭХОКС) на аппарате ViVID 3 Pro (США). При оценке показателей выявлены большие показатели объёма левого предсердия, конечного диастолического размера левого желудочка, толщины межжелудочковой перегородки в систолу и диастолу, толщины задней стенки левого желудочка в систолу, конечного диастолического объёма левого желудочка, конечного систолического объёма левого желудочка у пациентов с МС (табл. 3).
Таблица 3. Показатели ЭХОКС в группах сравнения (M±m)
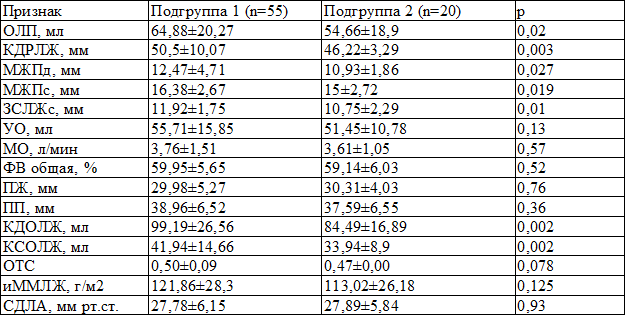
Примечание: ОЛП – объём левого предсердия, иОЛП – индекс объёма левого предсердия, КДРЛЖ – конечно-диастолический размер левого желудочка, МЖПд – межжелудочковая перегородка в диастолу, МЖПс – межжелудочковая перегородка в систолу, ЗСЛЖс – задняя стенка левого желудочка в систолу, УО – ударный объём, МО – минутный объём, ФВ – фракция выброса, ПЖ – правый желудочек, ПП – правое предсердие, КДОЛЖ конечно-диастолический объём левого желудочка, КСОЛЖ – конечно-систолический объём левого желудочка, ОТС – относительная толщина стенок, иММЛЖ – индекс массы миокарда левого желудочка, СДЛА – систолическое давление в легочной артерии
Градация желудочковых эктопий оценивалась с помощью холтеровского мониторирования ЭКГ системы Kenzo 301 (Япония), диагноз ИБС и толерантность к физической нагрузке (ТФН) определялись при проведении тредмилл-теста Schiller (Швейцария). Оценка качества жизни и толерантности к физической нагрузке проводилась с помощью Миннесотского опросника для пациентов с сердечной недостаточностью и теста 6-минутной ходьбы. Здесь не было выявлено достоверно значимых различий (табл. 4). Динамическое наблюдение проводили в течение 3 месяцев, после чего было выполнено повторное обследование. Выбранная длительность наблюдения, с нашей точки зрения, была достаточной для оценки эффекта антиаритмической терапии, эффективности терапии МС и оценки клинических и лабораторных показателей.
Показатели, имеющие нормальное или близкое к нормальному распределение, представлены в виде (M±m), где М – выборочная средняя величина, m - выборочное стандартное отклонение; при отличии выборочного распределения от нормального – в виде медианы и интерквартильного (процентильного) интервала (Ме [25;75]). При анализе динамики изменений проводился расчет в виде Δ%. Основным критерием в оценке значимости различий количественных показателей между обеими группами был критерий Стьюдента: 2-й тип критерия для равных дисперсий, 3-й тип для двухвыборочного теста с неравными дисперсиями. Для выявления существующих различий в группах, отличных от нормального распределения и при порядковых признаках использовали непараметрические критерии Манна-Уитни. Критический уровень значимости принимали равным 0,05.
Таблица 4. Исходные показатели инструментального обследования, показатели ТФН и качества жизни (Me [25;75], M±m)
![Таблица 4. Исходные показатели инструментального обследования, показатели ТФН и качества жизни (Me [25;75], M±m) Таблица 4. Исходные показатели инструментального обследования, показатели ТФН и качества жизни (Me [25;75], M±m)](/images/articles/2013/3.2/13166/t4.png)
Примечание: ЖЭС один. – одиночные желудочковые эктопии по ХМ-ЭКГ, ЖЭС куплеты – парные желудочковые эктопии по ХМ-ЭКГ, ТФН – толерантность к физической нагрузке выполненная на тредмилл-тесте, Т6 МХ – дистанция, пройденная пациентами в тесте 6-минутной ходьбы, Мин. опр. – количество баллов, набранных пациентами в Миннесотском опроснике качества жизни у больных с сердечной недостаточностью, • - критерий Манна-Уитни
Результаты и обсуждение. При оценке клинико-лабораторно-инструментальных показателей через 3 месяца выявлено улучшение клинических, лабораторных и инструментальных показателях в обеих подгруппах. Однако у пациентов подгруппы 1 сохраняются различия с подгруппой без МС по основным показателям. Кроме того эффективность антиаритмической терапии (по количеству одиночных ЖЭС) также выше в подгруппе 2 (табл. 5).
Показатели табл. 5 свидетельствуют, что несмотря на адекватную терапию МС в течение 3-х месяцев у пациентов подгруппы 1 сохраняются различия в основных клинических и лабораторных показателях (окружность талии, масса тела, ИМТ, ТГ, уровни инсулина и инсулинорезистентности). Также пациенты подгруппы 1 имеют большее количество одиночных желудочковых эктопий, что можно расценивать как меньшую эффективность антиаритмической терапии. Однако достоверных различий при оценке качества жизни по Миннесотскому опроснику выявлено не было. Обе подгруппы пациентов через 3 месяца наблюдения были сопоставимы по сопутствующей терапии. Единственным различием в принимаемых препаратов был метформин, который подгруппа 1 принимала в средней дозе 1434±64 мг. Пациенты подгруппы 2 не принимали метформин в связи с отсутствием показаний к его назначению.
Ключевым моментом формирования МС является инсулинорезистентность (ИР), которая запускает порочный круг симптомов, приводящих в итоге к появлению различных сердечно-сосудистых осложнений (в т.ч. нарушений ритма сердца, инфаркта миокарда, мозгового инсульта и недостаточности кровообращения). В то же время ИР не возникает спонтанно, по современным представлениям, инициирующим моментом, как ИР, так и всего метаболического каскада чаще всего служит ожирение, которое, в свою очередь, предрасполагает к развитию АГ и способно вызвать снижение чувствительности периферических тканей к инсулину и последующее накопление избыточной массы тела. В свою очередь инсулинорезистентность приводит к ремоделированию миокарда и формированию его электрической нестабильности, что обуславливает более низкую эффективность антиаритмической терапии у пациентов с МС. Таким образом, терапевтические мероприятия у пациентов с ЖНР и МС должны быть направлены, в первую очередь, на лечение инсулинорезистентности.
Таблица 5. Клинические, лабораторные и инструментальные показатели через 3 месяца наблюдения (M±m, Me [25;75])
![Таблица 5. Клинические, лабораторные и инструментальные показатели через 3 месяца наблюдения (M±m, Me [25;75]) Таблица 5. Клинические, лабораторные и инструментальные показатели через 3 месяца наблюдения (M±m, Me [25;75])](/images/articles/2013/3.2/13166/t5.png)
Примечание: САД – систолическое АД, ДАД – диастолическое АД, ИМТ – индекс массы тела, ЖЭС один. – одиночные желудочковые эктопии по ХМ-ЭКГ, ЖЭС куплеты – парные желудочковые эктопии по ХМ-ЭКГ, ТФН – толерантность к физической нагрузке выполненная на тредмилл-тесте, Т6 МХ – дистанция, пройденная пациентами в тесте 6-минутной ходьбы, Мин. опр. – количество баллов, набранных пациентами в Миннесотском опроснике качества жизни у больных с сердечной недостаточностью, • - критерий Манна-Уитни
Заключение. На фоне базисной терапии у пациентов с МС наблюдается улучшение клинических, лабораторных и инструментальных показателей. Метаболический синдром ассоциируется с меньшей эффективностью антиаритмической терапии у пациентов с желудочковыми нарушениями ритма, в сравнении с пациентами без инсулинорезистентности.
