В последние годы значительно повысилась актуальность проблемы внезапной сердечной смерти (ВСС) в молодом возрасте. Более чем у 80 % внезапно умерших лиц молодого возраста внезапная смерть носит первично аритмогенный характер и при вскрытии не выявляется поражения миокарда или коронарных сосудов [1]. Несмотря на определенный прогресс в области прогнозирования и лечения аритмий сердца, проблема предупреждения жизнеугрожающих нарушений ритма остается актуальной. Одним из центральных звеньев в патогенезе электрической нестабильности миокарда (ЭНМ) и внезапной сердечной смерти является окислительный стресс, представляющий собой состояние, характеризующееся активацией свободно-радикальных процессов (СРП) с одновременным снижением мощности антиокислительных систем.
Усиление свободно-радикального окисления (СРО) приводит к нарушению функционирования ионных каналов, изменению трансмембранного потенциала и возбудимости клеток проводящей системы и кардиомиоцитов, формированию в миокарде зон с нарушенными электрофизиологическими свойствами [2]. В последнее время отмечается прогресс в области изучения различных электрокардиографических (ЭКГ) маркеров ЭНМ: поздние потенциалы желудочков (ППЖ), снижение вариабельности сердечного ритма, удлинение интервала Q-T и увеличение его дисперсии (d Q-T). Кроме того, к предикторам ВСС по данным длительного мониторирования ЭКГ относят альтернацию зубца Т, турбулентность ритма сердца и диагностику синдрома обструктивного сонного апноэ [3]. Доказана высокая прогностическая ценность метода электрокардиографии высокого разрешения (ЭКГ ВР), выявляющего наличие задержки проведения, обусловливающей возникновение угрожающих жизни аритмий с механизмом re-entry [4]. Современная кардиология располагает значительным арсеналом средств оценки аритмологического прогноза больного. Важно, чтобы применяемые методы позволили при формировании группы высокого аритмического риска наиболее полно охватить больных с плохим прогнозом. Многие методики, обладая высокой чувствительностью, не обеспечивают достаточной специфичности.
Роль активации СРП в патогенезе аритмий в проведенных ранее исследованиях оценивалась у больных с острым инфарктом миокарда и при реперфузионных аритмиях [5, 6, 7]. Однако, систематических исследований, показывающих роль оксидативного стресса в проаритмогенной настроенности здорового миокарда до настоящего времени не проводилось.
Целью настоящего исследования явилось выявление зависимости между наличием предикторов внезапной сердечной смерти у лиц молодого возраста и активностью антиоксидантных ферментов в крови, установление роли «окислительного стресса» в проаритмической настроенности миокарда у лиц молодого возраста с риском внезапной сердечной смерти.
Материалы и методы исследования. Обследовано 120 человек в возрасте от 18 до 45 лет. Из них 20 обследуемых составили контрольную группу (средний возраст 23,95±0,8) и 100 человек, имеющие анатомический субстрат, электрический субстрат и триггерные факторы развития ВСС (средний возраст 27,81±0,8) (рис.1) [8].
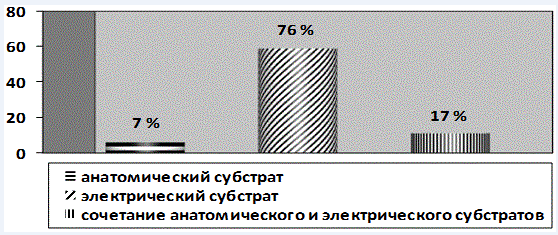
Рис. 1. Распределение обследуемых по группам
Субстрат представляет собой анатомические и/или электрические отклонения, связанные с приобретенными или врожденными заболеваниями сердца.
Анатомический субстрат, лежащий в основе внезапной смерти, чаще всего представляет собой ишемическая болезнь сердца (ИБС) или другое заболевание, не связанное с ишемией миокарда. Анатомическим субстратом не ишемического генеза могут явиться первичные заболевания мышечной ткани, вторичные поражения миокарда вследствие клапанных пороков сердца или перегрузки давлением или объемом [9]. В нашем исследовании в эту группу входили пациенты с пролапсом митрального клапана (ПМК).
Электрические отклонения, которые могут являться субстратом ВСС, включают в себя нарушения и проводимости, и возбудимости [9]. В нашем исследовании в эту группу входили пациенты с желудочковой эктопической активностью (желудочковая экстрасистолия, желудочковая тахикардия), синдромом удлиненного интервала QT, феноменом предвозбуждения желудочков, синоатриальной и атриовентрикулярной блокадами.
Триггерными (пусковыми) факторами могут являться механические, метаболические, неврологические, ишемические или ятрогенные воздействия [9]. В нашем исследовании в качестве таких пусковых факторов рассматривалось наличие поздних потенциалов желудочков (ППЖ), возникновение которых связано с наличием участков дезорганизации мышечной ткани в левом желудочке, которые могут стать причиной re-entry и источником аритмий. ППЖ были выявлены у 9 человек в исследуемой группе.
Всем обследуемым была проведена оценка активности антиоксидантных ферментов (супероксиддисмутаза и каталаза) в лизатах эритроцитов спектрофотометрическим методом. Интенсивность СРО (спонтанная светимость, быстрая вспышка, максимальная светимость, светосумма медленной вспышки) определялась методом железоиндуцирующей хемолюминисценции цельной сыворотки крови и фракций апо-В липопротеинов по методике Фархутдинова Р.Р.
Обработка данных электрокардиографического обследования, оценка показателей ЭКГ высокого разрешения и анализ вариабельности сердечного ритма (ВРС) проводились с помощью программно-аппаратного комплекса Поли-Спектр (фирма «Нейрософт», Россия, Иваново), обработка данных суточного монитортрования ЭКГ с помощью комплекса «Холтер-ДМС» (ООО «ДМС Передовые технологии», Россия, Москва) и системы «Инкарт» (Россия, Санкт-Петербург) с расчетом дисперсии QT. Для оценки ВРС использован компьютерный анализ 5-минутных фрагментов ритмограммы и спектрограммы в покое и в ходе выполнения активной ортостатической пробы по методике В.М. Михайлова. Интервал и дисперсия QT определялся по методике M. Simson.
Для исключения ИБС использовались визуализирующие методы (трансторокальная ЭХОКГ, цветное допплеровское картирование на аппарате «Vingmed Systen Five, GE, USA») с целью определения показателей центральной гемодинамики (фракции выброса и ударного объема), объемов полостей сердца, толщины стенок отделов сердца, а также пробы с дозированной физической нагрузкой. Липидный спектр определялся на автоматическом биохимическом анализаторе COBAS INTEGRA 400 фирмы Roche (Швейцария).
Статистическая обработка полученных данных была проведена на персональном компьютере с помощью программы STATISTIKA 6.0. Результаты исследования представлены как средние арифметические значения (M) ± стандартные отклонения. Для выявления статистически значимых различий в сравниваемых группах были использованы параметрический и непараметрический методы. Полученные данные считали достоверными при значениях р < 0,05. В течение всего периода наблюдений формировалась электронная база данных, что позволило в последующем корректно осуществлять статистическую обработку данных.
Результаты обследований и их обсуждение. Ранней неспецифической реакцией организма при развитии различных заболеваний, действии негативных факторов среды - является изменение свободно-радикального окисления. В начальных стадиях процесс носит защитно-приспособительный характер. Нарушение свободно-радикального окисления предшествует появлению клинических симптомов и сопровождается изменением хемилюминесценции биологического материала [10].
Как следует из данных, представленных на рисунках 2 и 3, у лиц, имеющих предикторы ВСС, интенсивность СРО, оцениваемая по параметрам хемолюминисценции приблизительно в 2,5 раза выше, чем в контрольной группе.
Активность антиоксидантных ферментов также отличается. При этом супероксиддисмутаза (СОД) у лиц с предикторами ВСС на 30% выше, а каталаза, напротив, на 17% ниже, чем в контрольной группе (рис. 4).
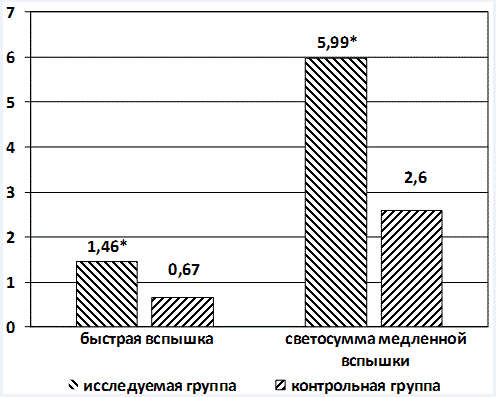
Рис. 2. Интенсивность свободно-радикального окисления по параметрам хемолюминисценции: здесь и далее * - достоверность различий по сравнению с контрольной группой (р<0,05)

Рис. 3. Интенсивность свободно-радикального окисления по параметрам хемолюминисценции
Супероксиддисмутаза играет важную роль в защите клеток от повреждающего действия супероксидного анион-радикала и считается главным ферментом внутриклеточной антиоксидантной системы (АОС). СОД не только стабилизирует клеточные мембраны, предотвращая процессы перекисного окисления липидов. Снижая уровень О2-, она защищает от его дезактивирующего действия каталазу и глутатионпероксидазу. Синергистом СОД в клетке является каталаза, препятствующая накоплению продукта супероксиддисмутазной реакции - пероксида водорода, ингибитора СОД. Между активностями этих двух ферментов обнаружена высокая степень корреляции. Повышенная активность СОД сопровождается увеличением продукции пероксида водорода, который на фоне снижения активности фермента, разрушающего его – каталазы, в еще большей степени усугубляет проявления окислительного стресса.
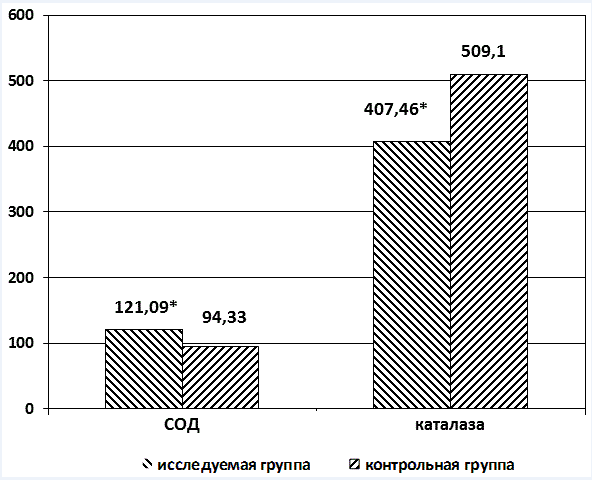
Рис. 4. Активность антиоксидантных ферментов
На рис. 5 и 6 представлены параметры хемолюминисценции пациентов с различными субстратами ВСС. Выявлены статистически достоверные различия параметров интенсивности СРО по сравнению с контрольной группой. Причем, в группе пациентов, имеющих смешанный субстрат (анатомический и электрический), эти показатели в 3,5 раза выше, чем в контрольной группе.
В этих же группах была проанализирована активность антиоксидантных ферментов (рис.7). Выявлены статистически достоверные различия показателей по сравнению с контрольной группой. При этом супероксиддисмутаза (СОД) выше у лиц с анатомическим субстратом (в 1,3 раза, по сравнению с контрольной группой), а каталаза, напротив, наиболее снижена у лиц, имеющих электрический субстрат ВСС (в 1,2 раза, по сравнению с контрольной группой).
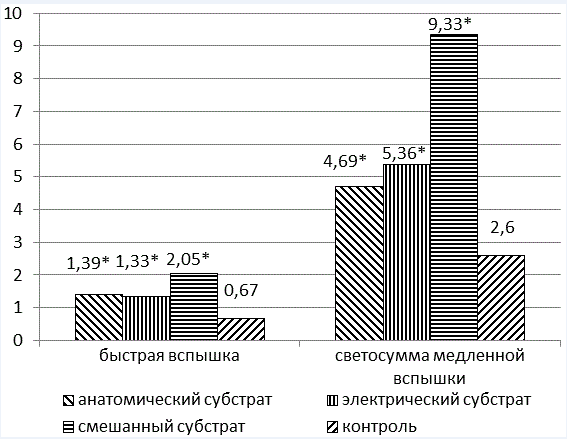
Рис. 5. Интенсивность СРО в различных группах обследуемых
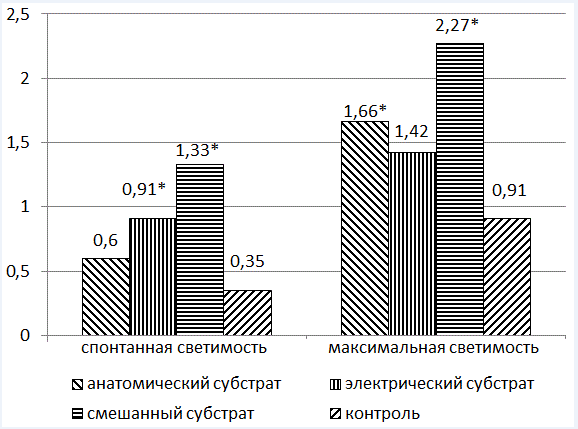
Рис. 6. Интенсивность СРО в различных группах обследуемых
Показатели интенсивности свободно-радикального окисления, оцениваемые по параметрам хемолюминисценции, и активности антиоксидантных ферментов у всех групп обследуемых представлены в табл. 1.
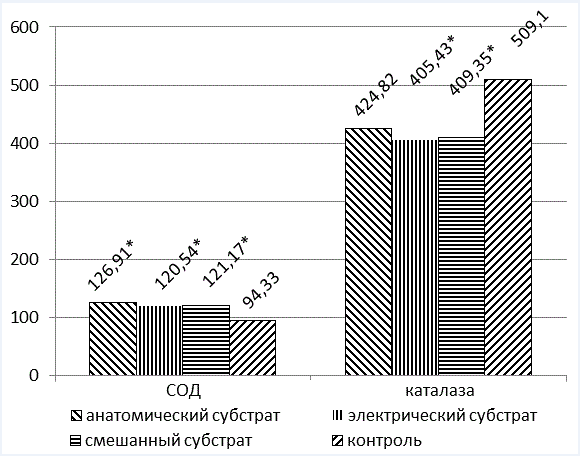
Рис. 7. Активность антиоксидантных ферментов в различных группах обследуемых
Таблица 1. Показатели интенсивности СРО и активности антиоксидантных ферментов (М ±m)
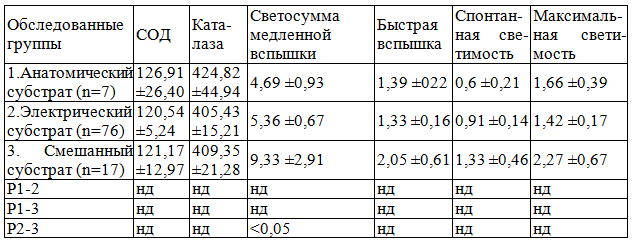
Как видно из представленных данных, в рассматриваемых группах обследуемых не обнаружено достоверных различий в уровне интенсивности свободно-радикального окисления и активности антиоксидантных ферментов.
Выводы. Таким образом, результаты проведенных исследований показывают, что:
1. У лиц с риском внезапной некоронарогенной сердечной смерти имеют место явления окислительного стресса, проявляющиеся как повышением интенсивности СРО, так и снижением активности антиоксидантных ферментов. Это в свою очередь может указывать на роль окислительного стресса в развитии электрической нестабильности миокарда и внезапной сердечной смерти.
2. В выделенных группах обследуемых различий в уровне интенсивности свободно-радикального окисления и активности антиоксидантных ферментов не выявлено.
3. В группе пациентов, имеющих смешанный субстрат (анатомический и электрический), параметры хемолюминисценции в 3,5 раза выше, чем в контрольной группе. Это отражает усиление свободно-радикального окисления при сочетании субстратов ВСС, что приводит к формированию в миокарде зон с нарушенными электрофизиологическими свойствами и предрасполагает к развитию жизненно-опасных аритмий.
4. Хемилюминесцентные методы исследования могут быть использованы для раннего выявления нарушения защитно-приспособительных реакций организма, оценки адаптационных возможностей, углубленного изучения причин и механизмов развития патологических процессов.
