Введение. В настоящее время в Российской Федерации складывается неблагоприятная ситуация в отношении сердечно-сосудистых заболеваний, коэффициенты смертности от ишемической болезни сердца (ИБС) в нашей стране в три раза превышают среднеевропейские показатели [1, 2]. Важнейшим фактором, повышающим риск сердечно-сосудистой заболеваемости и смертности при ИБС и артериальной гипертензии (АГ), является гипертрофия левого желудочка (ГЛЖ) [3, 4]. Независимо от других факторов риска и уровня артериального давления (АД), ГЛЖ увеличивает риск развития инфаркта миокарда, инсульта, сердечной недостаточности [5]. Большая частота инфаркта миокарда и различных осложнений ИБС у лиц с ГЛЖ объясняется прежде всего снижением коронарного резерва и относительной ишемией гипертрофированного миокарда [6].
Ключевую роль в развитии и прогрессировании ГЛЖ играет гиперактивация ренин-ангиотензин-альдостероновой системы (РААС) с повышением уровня ее основных гормонов, в том числе альдостерона. Альдостерону, как независимому фактору развития и прогрессирования кардиоваскулярных повреждений, стали уделять внимание сравнительно недавно, когда были открыты минералкортикоидные рецепторы, локализованные в кардиомиоцитах, гладкомышечных клетках сосудов сердца [7].
Также общепризнанным является, что в возникновении ГЛЖ при АГ и ИБС велика роль генов-модификаторов, генов симпатоадреналовой системы, компонентов РААС, гена, образующего альдостерон [1,8,9]. Несмотря на то, что среди больных с повышенной массой миокарда левого желудочка большинство составляют лица с сочетанием ИБС и АГ, взаимосвязь этих особенностей с определенными генетическими маркерами и характером поражения коронарного русла окончательно не установлена и требует дальнейшего изучения.
Цель исследования - оценить характер поражения коронарного русла, концентрацию альдостерона плазмы и полиморфизм гена альдостеронсинтазы у больных ИБС в сочетании с АГ при различной массе миокарда левого желудочка.
Материалы и методы. Исследование проведено на базе Государственного бюджетного учреждения здравоохранения Новосибирской области «Новосибирский областной клинический кардиологический диспансер». Обследовано 225 больных (мужчины, в возрасте 40-65 лет) со стабильной стенокардией I-III функционального класса (ФК) в сочетании с АГ. У всех больных имела место III стадия гипертонической болезни. Все пациенты дали согласие на участие в исследовании в соответствии с международными этическими требованиями ВОЗ [10].
Средний возраст больных составлял 55,8±0,9 лет, достоверно не различаясь по группам. Давность ишемического анамнеза также оказалась сопоставима. Длительность АГ составляла в среднем 13,0+1,4 лет у больных 1-й группы и 7,3+1,2 лет у больных 2-й (p<0,05).
В группе лиц с ГЛЖ достоверно чаще диагностирована стенокардия напряжения III функционального класса (табл. 1).
Таблица 1. Распределение больных по функциональному классу стенокардии
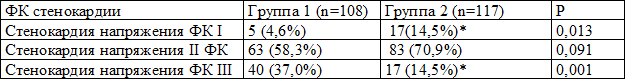
Примечание: здесь и далее * - различия достоверны (при p<0,05) при сравнении с соответствующими значениями в группе без ГЛЖ по критерию χ2
Критерии исключения: сахарный диабета 2 типа, нарушение функции щитовидной железы, острый коронарный синдром давностью до 6 месяцев, постинфарктная аневризма левого желудочка, постоянная форма фибрилляции предсердий, ХСН > II ФК по классификации Нью-Йоркской кардиологической ассоциации (NYHA), ожирение ˃ II степени, выраженная анемия, тяжелая легочная гипертензия и другие, клинически значимые сопутствующие заболевания.
Больные были разделены на 2 группы. Первую группу составили 108 пациентов с признаками ГЛЖ (средний возраст – 56,3±0,5 лет), среднее значение индекса массы миокарда левого желудочка (ИММЛЖ) - 165±3,5 г/м²; во вторую группу было включено 117 мужчин с ИБС с АГ (средний возраст – 55,4±0,6 лет) с нормальным ИММЛЖ (113,8±0,8 г/м²). Средние значения ИММЛЖ у больных 1-й и 2-й групп различались достоверно (p <0,005).
Было выполнено комплексное клиническое обследование с применением инструментальных и лабораторных методов, в том числе была оценена концентрация альдостерона, а также проведена коронарография по Judkins M.[11]. Содержание альдостерона плазмы определяли методом иммуноферментного анализа. Нормальные значения уровня альдостерона составили 25-315 пг/мл. Генетические методы исследования включали в себя определение полиморфизма гена альдостеронсинтазы с помощью полимеразной цепной реакции (ПЦР).
Статистическая обработка полученных данных выполнена на ПК при помощи пакета программ для статистической обработки данных STATISTICA for Windows 7,0. Определение достоверности различий между качественными показателями сравниваемых групп проводили с помощью критерия χ2 (хи-квадрат), для оценки различий значений количественных показателей в разных группах применяли t-критерий Стьюдента для независимых выборок (после проверки распределения признаков на соответствие закону нормального распределения по критерию Колмогорова-Смирнова) или непараметрический U-критерий Манна-Уитни. Количественная характеристика выраженности связи клинических показателей с характером генотипа определялась путем проведения корреляционного анализа с использованием рангового коэффициента корреляции Спирмена (R). Критический уровень достоверности нулевой статистической гипотезы принимали равным 0,05.
Результаты. Ангиографическое обследование больных обеих групп обнаружило выраженные изменения коронарного русла: неизмененные коронарные артерии были выявлены лишь у 2 (1,9%) больных 1-й группы и у 12 (10,3%) 2-й; гемодинамически значимые стенозы коронарных артерий зарегистрированы у 99 (91,6%) больных 1-й группы и у 82 (70,1%) больных 2-й группы; пограничные стенозы (50-70%) были выявлены у 5 (4,6%) и у 15 (12,8%) больных соответственно. Гемодинамически незначимые стенозы (степень стенозирования < 50%) выявлены у 2 (1,85%) пациентов с ГЛЖ и у 8 (6,83%) лиц с нормальным ИММЛЖ.
Оценка анатомических особенностей поражения коронарного русла показала, что у больных с признаками ГЛЖ значимо чаще (p<0,001), чем у пациентов с нормальным ИММЛЖ, встречалось гемодинамически значимое стенозирование ствола левой коронарной артерии (соответственно 16,6 и 6,3% случаев), передней нисходящей артерии (соответственно 56,5 и 23,9% случаев) (p<0,001). У больных 1-й группы по сравнению с больными 2-й группы достоверно чаще были поражены и другие магистральные артерии: диагональная – 27,8% против 4,3%, огибающая – 38,0% против 9,4%, ветвь тупого края (ВТК) - 36,1% против 12,8% и правая коронарная артерия (ПКА) – 59,3% против 35,0% случаев (табл. 2).
Таблица 2. Локализация поражения коронарных артерий у обследованных больных
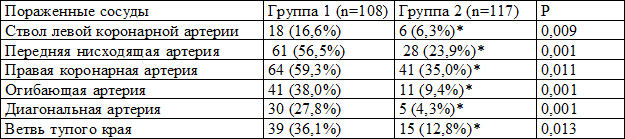
Среднее количество пораженных сосудов хирургического уровня в пересчете на одного больного в 1-й группе составило 3±0,165, что достоверно выше (р=0.001), чем у больных 2-й группы - 1±0.009.
Однососудистое поражение в группе лиц с ГЛЖ выявлено у 12,0% обследованных, тогда как в группе с нормальным ИММЛЖ данное поражение зарегистрировано у половины пациентов 58 (49,5%). Двухсосудистое поражения коронарного русла имело место у 16 (14,8%) больных в 1-й группе и у 22 (19,1%) во 2-й. В то же время у большинства больных с ГЛЖ (77 -71,3%) имелось поражение трех и более сосудов, а в группе без ГЛЖ значение данного показателя было достоверно ниже (p<0,05) и составило лишь 6,83% (табл. 3).
Корреляционный анализ показал наличие ряда достоверных связей. Так, показатель «количество пораженных сосудов» был положительно связан с концентрациями альдостерона (R=0,34; p=0,021). Степень стеноза коронарных сосудов прямо коррелировала с концентрацией альдостерона, хотя выраженность связи была меньше, чем с количеством пораженных сосудов (R=0,25; p=0,033).
Таблица 3. Распределение больных по числу пораженных коронарных сосудов
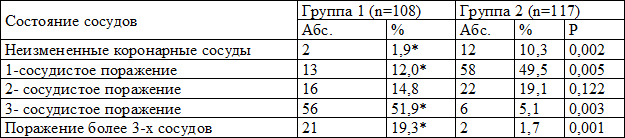
Следует отметить, что наиболее выраженными были корреляции наличия ГЛЖ с показателями поражения коронарных сосудов: значения коэффициента корреляции Спирмена составили соответственно R=0,40 (p=0,042) для количества пораженных сосудов и R=0,35 (p=0,001) для степени стеноза сосудов.
Содержание альдостерона плазмы и полиморфизм гена альдостеронсинтазы определяли методом случайной выборки у каждого 3-го пациента, всего у 32 1-й группы и 31 больного 2-й группы.
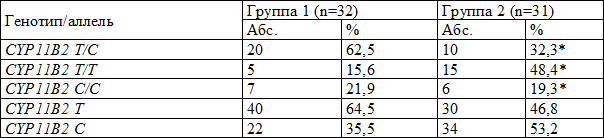
Анализ распределения частот генотипов по полиморфизму Т-344/С гена CYP11В2 (альдостеронсинтазы) показал, что из общей выборки 63 больных 30 (47,6%) имели генотип Т/С, 11 (17,4%) – генотип С/С и 22 (34,9%) – Т/Т генотип. Аллель Т встречалась в 58,7%, аллель С - в 41,3% случаев (табл.4).
Таблица 4. Распределение генотипов и аллелей С-344Т полиморфного гена CYP11В2 у больных ИБС в сочетании с АГ

Сравнительная оценка распределения больных с ИБС и АГ по этим генотипам в сравниваемых группах показала, что в 1-й группе у абсолютного большинства больных выявлен генотип CYP11В2 T/С - в 62,5% случаев, а во 2-й группе частота встречаемости данного генотипа была значимо ниже – 32,3% (p<0,05). В то же время во 2-й группе достоверно чаще (p<0,05) встречался вариант CY11В2 T/T – у 48,4%, а среди больных с ГЛЖ данный генотип имел место в 3 раза реже – только у 15,6% обследованных (р<0,005). Частота обнаружения генотипа CYP11В2 C/С существенно не различалась в сравниваемых группах, и составила у пациентов с ГЛЖ 21,9%, а в группе больных без ГЛЖ – 19,3% (р˃0,005); также в группе лиц с ГЛЖ по сравнению с больными с нормальным ИММЛЖ чаще встречалась аллель Т (64,5% и 46,8%; р<0,05). В тоже время аллель С достоверно чаще встречалась в группе больных с нормальным индексом массы миокарда по сравнению с больными с ГЛЖ (53,2% и 35,5% соответственно; р<0,05) (табл. 5).
Таблица 5. Частота встречаемости аллелей и генотипов полиморфного локуса С-344Т гена альдостеронсинтазы у больных ИБС с АГ с различной массой миокарда
Оценка зависимости уровней систолического и диастолического артериального давления от нуклеотидного полиморфизма показала, что пациенты с генотипом CYP11В2 Т/С присущи достоверно более высокие значения систолического артериального давления (САД) и диастолического артериального давления (ДАД) по сравнению с лицами с генотипом CYP11В2 С/С и CYP11В2 Т/Т независимо от наличия ГЛЖ (табл. 6).
Таблица 6. Уровень САД и ДАД в зависимости от генотипа у больных ИБС в сочетании с АГ, M±m

Примечания: - * различия достоверны (р<0,05) по U-критерию Манна-Уитни между группами больных с генотипом CYP11В2 T/C и генотипом CYP11В2 С/С; **различия достоверны (р<0,01) между группами больных с генотипом CYP11В2 T/C и генотипом CYP11В2 Т/Т
Был проведен анализ ассоциаций полиморфизма С-344Т гена альдостеронсинтазы с учетом основных эхокардиографических параметров. Так, у больных с ГЛЖ с генотипом CYP11В2 Т/С диаметр аорты был значимо (p<0,05) больше, чем у больных с другими генотипами. Также у пациентов данной группы отмечалось увеличение относительно больных с иным генотипом значений фракции выброса (ФВ) и фракции укорочения (ФУ) (p<0,05) и достоверно увеличение значений показателей массы миокарда левого желудочка (ММЛЖ) и ИММЛЖ.
Сопоставление концентрации альдостерона с ИММЛЖ обнаружило, что у лиц с ГЛЖ данный показатель был на 39,4% выше (р=0,007), чем при нормальном ИММЛЖ, хотя абсолютные значения уровня альдостерона оставались в пределах нормы в обеих группах больных.
Изучение зависимости концентраций альдостерона у больных АГ от генотипа позволило выявить существенное увеличение при генотипе CYP11В2 T/С – до 140,5±3,9 пг/мл, что было значимо выше, чем при генотипах CYP11В2 C/С - 90,0±1,3 пг/мл и CYP11В2 Т/Т - 93,8±0,7 пг/мл (p<0,05). В то же время достоверных отличий концентрации альдостерона между группами больных с генотипами CYP11В2 C/С и CYP11В2 T/T выявлено не было независимо от показателя ИММЛЖ и данные взаимосвязи не зависели от показателя ИММЛЖ.
Полученные данные позволили сделать предположение о наиболее неблагоприятном сочетании параметров, характеризующих состояние сердечно-сосудистой системы у пациентов с генотипом CYP11В2 T/С.
Проведенный корреляционный анализ выявил наличие ряда взаимосвязей концентрации альдостерона с клиническими и лабораторными параметрами. Так, прослежена значимая отрицательная корреляция индекса массы тела с уровнем альдостерона (R=-0,21), положительная связь альдостерона с параметрами ЭхоКГ: ударным объемом (УО) (R=0,25) и конечным диастолическим объемом (КДО) (R=0,50). Закономерным представляется и обнаружение значимых коэффициентов корреляции Спирмена умеренной силы с показателями, свидетельствующими о наличии признаков ГЛЖ у больных с ИБС и АГ: межжелудочковая перегородка (МЖП) (R=0,32), ММЛЖ (R=0,36), и ИММЛЖ (R=0,33).
Результаты корреляционного анализа свидетельствовали также о наличии ряда значимых связей показателей клинического обследований больных ИБС с АГ с вариантами полиморфизма генов. Так, при генотипе CYP11В2 T/С обнаружена положительная связь с наличием признаков ГЛЖ (R=0,30) и концентрацией альдостерона (R=0,31). При генотипе CYP11В2 T/С корреляция со значением ФВ была менее выраженной (R=0,26), но коэффициент Спирмена был достоверным (p<0,05).
Наличие генотипа CYP11В2 С/С было отрицательно связано с уровнем ФВ слабой (R=-0,25). Более выраженной, также отрицательной, была корреляция уровня ФУ с данным генотипом (R=-0,34).
Генотип CYP11В2 T/Т был связан с наличием ГЛЖ; корреляция отрицательная, коэффициент корреляции – значимый и максимальный среди всех выявленных корреляционных связей (R=-0,41). Также данный генотип был отрицательно ассоциирован с такими показателями ультразвуковое исследование сердца (УЗИ) сердца, как задняя стенка левого желудочка (ЗСЛЖ), МЖП и ИММЛЖ, однако сила связи была в этих случаях несколько меньше, хотя значения R были достоверными и составили, соответственно -0,27; -0,27 и -0,31.
Обсуждение результатов. Проведенные исследования показали, что распределение частот встречаемости генотипов полиморфного локуса С-344Т гена альдостеронсинтазы в группах больных ИБС в сочетании с АГ соответствовало таковому у европеоидов [4]. Ген альдостеронсинтазы отнесен к генам-кандидатам в развитии ремоделирования сердечно-сосудистой системы. Предпосылками к поиску генетических маркеров ГЛЖ и ремоделирования сосудов послужили данные клинических и экспериментальных исследований. Было установлено, что ГЛЖ достаточно часто распространена среди лиц, у которых нет гемодинамических причин к ее развитию [12], у нормотензивных лиц с отягощенной по АГ наследственностью наблюдаются более высокие значения ММЛЖ, чем в контроле [13], у больных с АГ, так же, как и в общей популяции, отмечается наследование предрасположенности к гипертрофии левого желудочка [14]. Полученные данные свидетельствовали о том, что генотип CYP11В2 T/С ассоциирован с повышением уровня альдостерона и признаками ГЛЖ, в то время как при генотипе CYP11В2 T/Т, напротив, эти сдвиги отмечаются значительно реже.
Установлено, что альдостерон и АТ II вызывают гиперпродукцию коллагена в миокарде, а катехоламины и АТ II способствуют развитию вазоконстрикции, в свою очередь все эти сдвиги участвуют в патогенезе как ИБС, так и АГ [8,16]. Результаты исследований последних десятилетий позволили предложить схему «сердечно–сосудистого континуума», представляющую из себя цепь связанных между собой событий, начиная от факторов риска (включающих и АГ) и заканчивающихся терминальной хронический сердечной недостаточностью [2].
Экспрессия совокупности генов ренин-ангиотензин-альдостероновой системы реализуется в фенотипе высоким уровнем АД, гипертрофией левого желудочка, электрокардиографическими изменениями, утолщением комплекса интима–медиа сонных артерий [15]. Полученные нами данные подтверждают, что использование генетических маркеров у больных ИБС и АГ поможет выделить группу лиц, требующих более «агрессивного» ведения и более пристального последующего наблюдения. Такой подход эффективнее учета одиночных параметров, при этом возможность включения генетических факторов в модели стратификации риска необходимо подтвердить исследованиями, проведенными с участием больных российской популяции [16].
ГЛЖ является самостоятельным фактором риска развития сердечно-сосудистой заболеваемости и смертности, среди больных с ГЛЖ большой процент составляют пациенты с наличием сопутствующей ИБС. С учетом полученных данных становится очевидно, что повышенный индекс массы миокарда является маркером неблагоприятного течения ИБС.
Результаты исследований подтверждают необходимость мультидисциплинарного подхода к ведению больных ИБС и АГ с использованием расширенного арсенала современных диагностических методов.
Заключение. У больных ИБС с повышенным ИММЛЖ достоверно чаще, чем у больных без ГЛЖ, выявляются гемодинамически значимые многососудистые поражения коронарного русла и с большей частотой поражаются магистральные сосуды.
Генотип CYP11В2 Т/С гена альдостеронсинтазы имеют 46,7% больных ИБС в сочетании с АГ независимо от величины ИММЛЖ. Для больных с ГЛЖ характерны: генотип CYP11В2 Т/С (62,5%) и наличие аллели Т, выявленной в 1,3 раза чаще, чем у больных с нормальным ИММЛЖ. При этом, у больных с ГЛЖ в 3 раза реже встречается вариант генотипа CYP11В2 Т/Т и в 1,5 раза реже выявляется аллель С.
У больных ИБС в сочетании с АГ генотип CYP11В2 T/С ассоциирован с повышением уровня альдостерона независимо от показателя ИММЛЖ.
Внедрение в практику популяционного генетического анализа представляется актуальным для оценки вероятности формирования ГЛЖ у больных с сочетанием ИБС и АГ, в связи с тем, что регресс ГЛЖ связан с улучшением прогноза.
