Введение. Интерес к исследованию возрастных особенностей системы кровообращения – структуры, функции и регуляции ее деятельности – объясняется, прежде всего, тем, что развивающиеся возрастные изменения в сердечно-сосудистой системе, являясь вторичными в генезе старения, в значительной мере определяют характер и темп старения организма. Они, во-первых, значительно ограничивают адаптационные возможности стареющего организма, во-вторых, создают предпосылки для развития патологии, являющейся основной причиной инвалидизации и смерти человека: атеросклероза, артериальной гипертензии, ишемической болезни сердца и мозга [3].
Значительный интерес представляет изучение биомеханики сердца и малого круга кровообращения (МКК) в процессе онтогенеза человека с целью прогнозирования течения сердечно-сосудистых заболеваний. В медицинской литературе встречается большое количество работ, посвященных анатомо-функциональным особенностям сердца у детей и подростков, а также детально освещены проблемы старения сердечно-сосудистой системы (ССС). Однако в современной литературе, практически отсутствуют исследования, в которых внимание уделено проблемам возрастных и половых особенностей биомеханики сердца. Данные по биомеханике МКК еще более скудны. В основном исследования биомеханики легочной артерии (ЛА) и гемодинамики МКК сводятся к изучению проблемы хронических обструктивных заболеваний легких. В этой связи необходимо проводить фундаментальные исследования у женщин и мужчин разных возрастов, с целью распознавания ранних нарушений биомеханики сердца и МКК в процессе онтогенеза человека, связи этих нарушений с полом, а также выявления взаимоотношений сердца и бассейна ЛА и формирования центральной гемодинамики в соответствии с возрастно-половыми различиями.
Цель. Изучить особенности биомеханики сердца и МКК у мужчин и женщин разных возрастных групп и выявить изменения центральной гемодинамики.
Материал и методы исследования. В работе представлены результаты обследования 120 практически здоровых человек без клинических признаков сердечно-сосудистых заболеваний и сахарного диабета. Кроме того, исключалось наличие среди обследованных всех групп факторов риска сердечно-сосудистых заболеваний и отягощенного анамнеза по атеросклерозу. Проведено распределение по четырем группам (по 30 человек): 1 группу составили женщины (средний возраст 20±1 год), во 2 группу вошли женщины (средний возраст 50±2 года, находящиеся в менопаузе), 3 и 4 группы сравнения составили мужчины с аналогичным делением по возрасту. Всем обследуемым проведен антропометрический анализ, определен индекс массы тела, который составил: в группе 1 – 24,3±1,1, в группе 2 – 25,6±2,4, в группе 3 – 25,2±1,9, в группе 4 – 26,1±1,7.
Биомеханику миокарда изучали методом компьютерной апекскардиографии; МКК – посредством биполярной реографии, с использованием пластинчатых электродов. Всем обследованным регистрировали апекскардиограммы (АКГ) и реограммы легочной артерии (РеоЛА) в покое. Регистрация РеоЛА и АКГ осуществлялась по стандартной традиционной методике на уникальном поликардиографе «Элон-2», с использованием пластинчатых электродов и тензометрического датчика. Внутри аппарата расположен аналого-цифровой преобразователь. Прибор соединяется кабелем с ЭВМ через универсальный USB 2.0 порт. Частота дискретизации при записи кривых составила 50 Гц.
Для устранения влияния различного аппаратного усиления сигнала введенные амплитуды нормировали, т.е. программно приводили их размах к единице. Колебания пронормированных амплитуд, вызванные случайными ошибками, сглаживались при аппроксимации амплитуд квадратичной параболой по методу наименьших квадратов, проходящей через пять последовательных точек. По сглаженным значениям амплитуд вычисляли первую и вторую производную кривых.
Анализ биомеханических показателей ЛА проводился согласно новой фазовой структуре, предложенной профессором В.Н. Фатенковым [10].
При этом в сосудистом цикле МКК выделяются систола и диастола по аналогии с сердечным циклом. Систола ЛА состоит (рис. 1) из фаз эластического (точки 3-4) и мышечного компонента оттока (точки 4-5) (ЭКО и МКО) и капиллярно-венозного оттока (точки 5-6) (КВО). Диастола ЛА включает фазы распространения пульсовой волны (точки 0-1) (РПВ), быстрого (точки 1-2) и медленного (точки 2-3) притока (БП и МП).
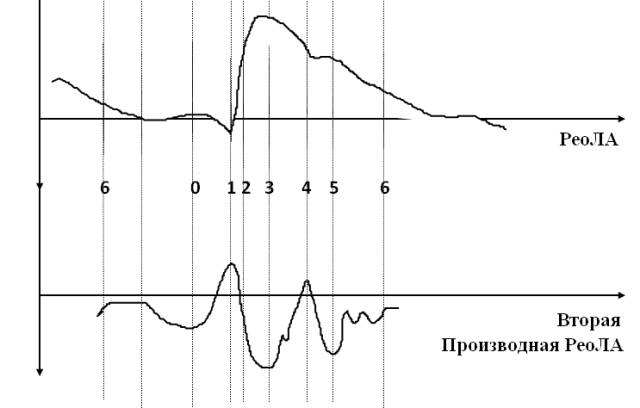
Рис. 1. Фазовая структура цикла легочной артерии.
Оценка механической активности миокарда основывалась на теории биомеханики сердца, предложенной профессором В.Н. Фатенковым [11], согласно которой выделяются следующие фазы сердечного цикла: систола предсердий (СП), фаза внутрижелудочкового перемещения крови (ПК) и повышения внутрижелудочкового давления (ПД), первая и вторая фазы максимального изгнания (МИ-1, МИ-2), редуцированного изгнания (РИ), фаза снижения внутрижелудочкового давления (СД), быстрого (БН) и медленного наполнения (МН).
В автоматизированном режиме выделялись перечисленные выше фазы, границы которых устанавливались по второй производной (рис. 2). В ходе исследования изучались следующие параметры биомеханики миокарда и ЛА: длительность фаз (t), средние и экстремальные скорость (v и vэ соответственно), ускорение (a и аэ соответственно) и мощность (N и Nэ соответственно), работа (W). Показатели биомеханики миокарда и ЛА исследовали в процессе компьютерной обработки.
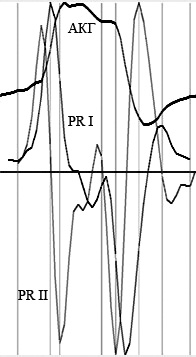
Рис. 2. АКГ, ее первая и вторая производные.
В целом ряде работ продемонстрировано, что при помощи компьютерных апекскардиографии и реопульмонографии можно выявлять дисфункцию миокарда и МКК у больных с незначительными изменениями сердечно-сосудистой и дыхательной систем [2,9,10,12].
Получаемые при помощи данных методов результаты не подчиняются закону нормального распределения. В этой связи статистический анализ проводился с использованием непараметрических методов, посредством критерия Вилкоксона, при помощи программы Statistica 6.0. Достоверными считались различия при p<0,05.
Полученные результаты и их обсуждение. Все результаты представлены в табл. 1 и 2 в виде абсолютных величин. Анализ параметров биомеханики сердца (табл. 1) показал уменьшение длительности фазы МИ-2 у мужчин зрелого возраста, в сравнении с женщинами, на 25% (р=0,028). В фазу БН у молодых мужчин снижалась продолжительность на 15% (р=0,029), однако с возрастом длительность этой фазы возрастала на 12% (р=0,015).
Выраженные изменения скоростных показателей отмечены у женщин зрелого возраста: vср снижалась во 2 группе, в сравнении с 1 группой, в фазу СД на 72% (р=0,028), в фазу БН на 19% (р=0,047). аср снижалась во 2 группе п отношению к 1 группе в фазу БН на 26% (р=0,017).
Таблица 1. Показатели биомеханики миокарда
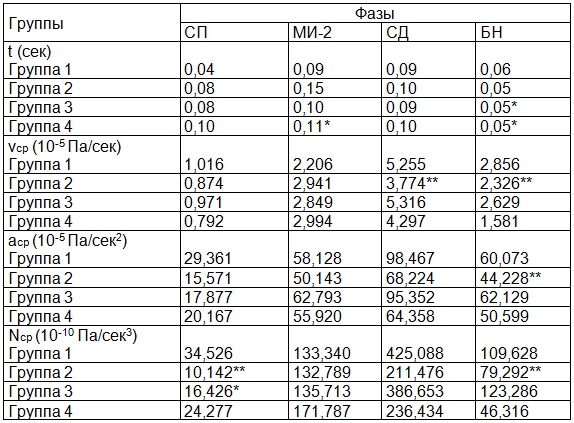
Примечания: здесь и далее * - достоверное различие по полу; ** - достоверное различие по возрасту; фазы сердечного цикла и параметры биомеханики: объяснения в тексте.
Значительно менялись и силовые показатели биомеханики сердца с возрастом. Так, во 2 группе Nср была ниже, чем в группе 1, в фазы СП, СД, БН 3,4 раза (р=0,047), в 2 раза (р=0,046) и на 28% (р=0,017) соответственно. Также в фазу СП произошло снижение Nср в 3 группе, по сравнению с 1 группой, в 2,1 раза (р=0,034).
Таким образом, у женщин среднего возраста наблюдается выраженная диастолическая дисфункция сердца, связанная с поражением субэпи- и субэндокардиальных слоев миокарда, что обусловлено, вероятно, наступлением климактерического периода и снижением количества эстрогенов, как миопротектора [14]. Кроме того, согласно теории профессора В.Н. Фатенкова, диастолическая дисфункция определяется поражением субэпи- и субэдокардиальных слоев миокарда [10,11].
При этом, у мужчин среднего возраста наблюдается систолическая гиперфункция и диастолическая гипофункция миокарда, свидетельствующие о возрастной перестройке сердца, связанные с ремоделированием и апоптозом кардиомиоцитов. Полученные нами данные согласуются с исследованиями других ученых.
Проведенные К.Г. Саркисовым, А.С. Ступиной (1978) исследования состояния капилляров в биоптатах кожи методом электронной микроскопии показали, что с возрастом происходят утолщение базальной мембраны капилляров, коллагенизация фибрилл, уменьшение диаметра пор, снижение активности пиноцитоза [14]. Эти изменения приводят к снижению интенсивности транскапиллярного обмена. В этой связи можно согласиться с высказываниями P. Bastai (1955) и М. Burger (1960), которые в качестве одной из причин старения выдвигают изменения в системе микроциркуляции [1]. Коркушко О.В. и соавт. было показано значительное снижение почечного кровообращения при старении, что непосредственно связано с уменьшением микроваскуляризации [4]. При эндоскопических исследованиях слизистой желудка и взятых биоптатов выявлено уменьшение количества микрососудов. Было также установлено значительное снижение при старении человека мышечного кровотока, как в состоянии покоя (МКП), так и максимального мышечного кровотока (ММК) при выполнении дозированной физической нагрузки [5]. Исследования мышечного кровотока осуществляли методом локального клиренса Хе133 на радиометрической установке "Ксенон". Такое уменьшение ММК свидетельствует о значительном ограничении функциональных возможностей микроциркуляторной системы в скелетных мышцах, что является одной из причин ограничения мышечной работоспособности. Рассматривая причины снижения мышечного кровотока при старении, следует учитывать следующие обстоятельства: возрастные изменения центральной гемодинамики – снижение сердечного выброса, процессы физиологического артериосклероза артериальных сосудов, ухудшение реологических свойств крови. Однако ведущее значение в этом феномене имеют возрастные изменения в микроциркуляторном звене: облитерация артериол и уменьшение капилляризации мышц [6].
В результате потери эластичности крупных артериальных стволов деятельность сердца с возрастом становится менее экономной. Это подтверждается следующими фактами: во-первых, у пожилых и старых, по сравнению с людьми молодого возраста, наблюдается повышенный расход энергии левым желудочком сердца на 1 л минутного объема кровообращения (МОК); во-вторых, с возрастом значительно снижается МОК, однако работа, выполненная левым желудочком за 1 мин, практически не изменяется ((61,78±0,98) Дж в 20–40 лет и (59,82±3,92) Дж в 90–99 лет); в-третьих, изменяется соотношение между общим эластическим сопротивлением (Ео) и периферическим сосудистым сопротивлением (W) [3]. Согласно данным литературы, показатель (Eo/W) характеризует отношение между количеством энергии, которое расходуется сердцем непосредственно на продвижение крови по сосудам, и тем количеством, которое аккумулируется стенками сосудов. С возрастом указанное отношение закономерно увеличивается, составляя в среднем для 20–40 лет 0,650±0,075; для седьмого десятилетия – 0,77±0,06; для восьмого – 0,86±0,05; для девятого – 0,930±0,044; для десятого – 1,090±0,075 (Р<0,01) [6-8,14].
Таким образом, представленные факты показывают, что в связи с возрастными изменениями крупных артериальных сосудов происходит потеря их эластичности и тем самым создаются условия, при которых сердце затрачивает больше энергии на продвижение крови. Эти изменения особенно выражены со стороны большого круга кровообращения и обусловливают развитие компенсаторной гипертрофии левого желудочка и увеличение массы сердца.
На основании анализа биомеханики МКК (табл. 2) получены следующие данные: во 2 группе увеличилась продолжительность фаз МКО и КВО на 38% (р=0,018) и на 27% (р=0,017) соответственно, в сравнении с 1 группой. В 4 группе произошло увеличение длительности фазы ЭКО на 46% (р=0,035) в сравнении с группой 3. Различия в продолжительности фаз в молодом возрасте между полами наблюдались как в систолу, так и в диастолу. Так, длительность фазы РПВ в 3 группе, в сравнении с 1 снизилась на 25% (р=0,009), в фазу МП – на 33% (р=0,004), в фазу ЭКО – на 46% (р=0,0006). С возрастом сохранялась тенденция снижения продолжительности фаз у мужчин, однако касалось это преимущественно периода оттока. Например, в 4 группе, по сравнению со 2, произошло снижение длительности фаз МКО и КВО в 2 раза (р=0,027) и на 46% (р=0,028) соответственно.
Значительно изменялись скоростные показатели биомеханики ЛА: так, во 2 группе, в сравнении с 1, произошло снижение vср в фазы РПВ и КВО на 9% (р=0,049) и на 30% (р=0,049) соответственно. В 4 группе возрастала vср в фазу РПВ по отношению к группе 3 на 63% (р=0,036), в фазу МКО - в 3,2 раза (р=0,011), в фазу КВО, напротив, снижалась в 1,8 раза (р=0,012). Vср изменялась с возрастом и между полами – в 4 группе, в сравнении со 2, данный показатель увеличился в 2 раза (р=0,025).
Однако наиболее значимые различия в средней скорости биомеханики ЛА наблюдались между мужчинами и женщинами молодого возраста. В 3 группе по отношению к 1 vср снизилась на 26% (р=0,008), и в 2,9 раза (р=0,0001) в фазы РПВ и МКО соответственно. А в фазы МП и КВО этот показатель увеличился на 27% (р=0,011) и в 2,6 раза (р=0,00009) соответственно. Изменения касались и среднего ускорения. Во 2 группе в фазу РПВ произошло снижение данного показателя, в сравнении с группой 1, на 7% (р=0,017). В 3 группе произошло увеличение аср в 2 раза, по сравнению с группой 4, (р=0,049) в фазу МКО. В этой же группе наблюдалось увеличение указанного показателя в сравнении с группой 1 в фазы ЭКО и МКО на 19% (р=0,027) и в 2,1 раза (р=0,002) соответственно.
Таблица 2. Показатели биомеханики легочной артерии
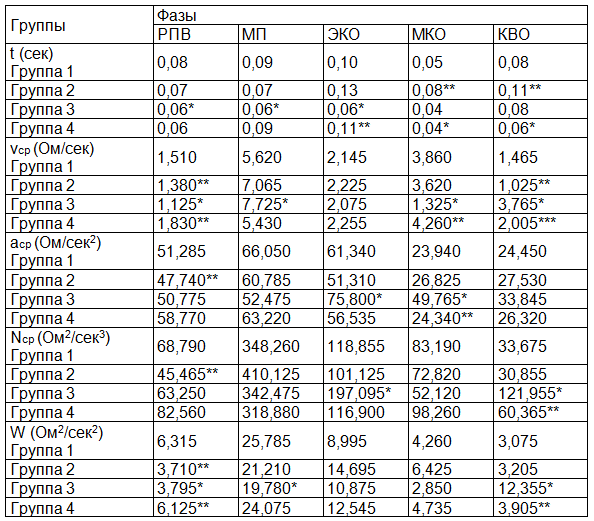
Примечание: *** - достоверное различие по полу и возрасту.
Наблюдались выраженные изменения силовых показателей биомеханики МКК: Nср во 2 группе снижалась на 34% (р=0,017), в сравнении с группой 1, в фазу РПВ. В 3 группе произошло увеличение данного показателя в 2 раза (р=0,017), в сравнении с 4 группой, в фазу КВО. Отмечались и половые различия в биомеханике ЛА: в 3 группе произошло увеличение указанного показателя в фазы ЭКО и КВО на 40% (р=0,02) и в 3,6 раза (р=0,0002) соответственно по сравнению с группой 1. Существенно изменялась работа сосудов бассейна ЛА: во 2 группе снижалась в 1,7 раза (р=0,025), в сравнении с 1 группой, в фазу РПВ. В 3 группе в указанной выше фазе этот показатель снижался по отношению к 1 и 4 группам на 40% (р=0,025) и на 38% (р=0,049) соответственно. В фазу МП в 3 группе происходило снижение W на 23% в сравнении с 1 группой (р=0,036). В фазу КВО в 3 группе наблюдалось увеличение указанного показателя в 4 раза (р=0,0002) и 3,2 раза (р=0,017) по отношению к группе 1 и 4 соответственно.
Очевидно, что у женщин с возрастом происходит формирование выраженной диастолической дисфункции МКК, гиперфункции в систолу ЛА и увеличение преднагрузки на левые отделы сердца. У молодых мужчин наблюдается систоло-диастолическая гиперфункция МКК, особенно выраженная в фазы, обусловленные мышечным сокращением артерий бассейна ЛА, которая с возрастом закономерно снижается в связи с гормональной перестройкой организма. В результате, функцию по перемещению ударного объема (УО) крови на себя принимают эластические структуры стенки артерий МКК. Систоло-диастолическая гиперфункция МКК у мужчин молодого возраста объясняется гормональным фоном и активирующим влиянием тестостерона на мышечные компоненты артериальной стенки [14]. Отсутствие гиперфункции у молодых женщин объясняется преобладанием эстрогенов и их вазодилатирующим и ангиопротективным действием. Результаты нашего исследования коррелируют с рядом исследований других авторов [1,3-6,13,14].
Выводы
- У женщин среднего возраста наблюдается выраженная диастолическая дисфункция миокарда, как следствие поражения субэпи- и субэндокардиальных слоев, обусловленная гормональной перестройкой на фоне климактерических изменений.
- У мужчин среднего возраста отмечена систолическая гиперфункция и диастолическая гипофункция левого желудочка, связанная с процессами, происходящими в миокарде в ходе онтогенеза.
- У женщин среднего возраста формируется диастолическая дисфункция МКК, систолическая гиперфункция и увеличение преднагрузки на левые отделы сердца.
- У молодых мужчин имеет место систоло-диастолическая гиперфункция МКК, связанная с функционированием мышечных волокон сосудистой стенки, которая не наблюдается у молодых женщин. Это обусловлено половыми гормональными различиями. С возрастом указанная выше гиперфункция ослабевает, а в процессе перемещения УО крови большую роль начинают играть соединительнотканные структуры сосудистой стенки.
