Артериальная гипертензия (АГ) - ведущий фактор риска развития основных сердечно-сосудистых заболеваний (ишемического и геморрагического инсультов, инфаркта миокарда и др.), доля которых в структуре заболеваемости, инвалидизации и смертности среди взрослого населения неуклонно возрастает [3,5,6]. Совершенно очевидно, что истоки формирования АГ необходимо искать в детском и подростковом периодах жизни [1-4, 8, 9,10].
Новое осмысление патогенеза АГ вносит изучение взаимосвязи состояния эндотелия сосудов и метаболических факторов риска. В случае эндотелиальной дисфункции возникает дисбаланс между факторами, обеспечивающими сосудистый тонус, местные процессы гемостаза, пролиферацию и миграцию клеток в сосудистую стенку [2,4,6,10,11,13,14]. В последние годы существенно возрос интерес к изучению сочетания нескольких факторов риска сердечно-сосудистых заболеваний, в том числе и АГ - ожирение, дислипидемия, гиперурикемия, гиперандрогения, а также сниженная толерантность к глюкозе, обусловленная гиперинсулинемией. Сочетание перечисленных состояний в литературе получило название «метаболический синдром» [5,10,12,13].
В этой связи интересными представляются изменения, происходящие на уровне микроциркуляторного русла у больных ожирением и артериальной гипертензией (особенно АГ «белого халата»), которые, очевидно, будут возникать на самых ранних этапах патологического процесса. В течение последнего десятилетия для оценки состояния кровотока в микрососудах все большее применение находит методика лазерной допплеровской флоуметрии (ЛДФ) [7]. Данный метод основан на проникающей способности лазерного излучения определенной длины волны в толщу кожных покровов. Изменение длины волны при отражении от движущихся клеток крови (принцип допплера) интерпретируется для оценки капиллярного кровотока [7].
Цель исследования: оценить эффективность применения таурина с целью коррекции метаболических нарушений и эндотелиальной дисфункции на микроциркуляторном русле у детей подросткового возраста с ожирением и артериальной гипертензией («истинной» и АГ «белого халата»).
Материалы и методы исследования. Нами были обследованы 75 детей подросткового возраста (средний возраст составил 12,8 лет) с ожирением и АГ («истинной» или «белого халата»). В 1-ю группу вошли 40 детей с АГ «белого халата» и ожирением (индекс времени (ИВ) систолическое артериальное давление (САД) и диастолическое артериальное давление (ДАД) в дневное, ночное время и в течение суток не превышало 25 % по результатам суточного мониторирования артериального давления (СМАД). 2-ю группу составили 35 детей с «истинной» АГ и ожирением (индекс времени (ИВ) САД и ДАД в дневное и/или ночное время и/или в течение суток превышал 25 % по результатам СМАД). Контрольную группу составили 10 детей 1-2-й групп здоровья. Контрольная, 1-я и 2-я группы были однородными по полу и возрасту.
У всех обследованных детей определяли антропометрические (индекс массы тела, окружность талии) и гормонально-лабораторные параметры (липидограмма, глюкоза крови, базальный уровень инсулина).
Для определения состояния микроциркуляции и сосудодвигательной функции эндотелия использовали бесконтактный лазерный допплер Research LDI компании Aimago (Швейцария), принцип действия которого основан на использовании инфракрасного излучения (808 нм), проникающего в кожу до 2 мм, на площади до 7х7см. С помощью бесконтактного датчика, направленного на область thenar оценивали перфузию (P, отн. ед.). О состоянии эндотелиальной функции сосудов судили по данным лазерной допплерографии перфузии кожи на фоне пробы с реактивной гиперемией. Регистрировали % изменения перфузии после нагрузочного теста (∆Р, %). Признаком эндотелиальной дисфункции считали увеличение менее чем на 10 % перфузии (P, отн. ед.) на фоне пробы с реактивной гиперемией (∆Р, %), свидетельствующее о недостаточной вазодилатации [7]. При этом выделялись 2 типа патологической ответной реакции: недостаточная степень вазодилатации (±10% ∆Р) и вазоконстрикция (% ∆Р от (– 10%) и менее).
Оценку параметров свободнорадикального окисления (СРО) проводили методом индуцированной хемилюминесценции (ИХЛ) на отечественном биохемилюминометре БЛМ 3606 М-01 (г. Красноярск, СКТБ «Наука»). Определяли величину общей светосуммы (S общ. (усл. ед.)) и первый пик индуцированной хемилюминесценции (Н (усл. ед.)). Дополнительно у обследованных детей рассчитывали интегральный показатель – хемилюминесцентный оксидативный коэффициент (ХОК): (S общ. х Н)/106 (усл. ед.), свидетельствующий о состоянии оксидативного статуса ребенка в целом.
Исследования проводили в динамике: до лечения и через 2 месяца после терапии. В зависимости от лечения 1-я и 2-я группы были разделены на 2 подгруппы (А и Б). Дети подгруппы А получали в лечении наряду с немедикаментозной терапией препарат таурин в дозе 250 мг 2 раза в сутки в течение 2 месяцев. Дети подгруппы Б находились только на немедикаментозной терапии (диета, дозированные динамические физические нагрузки).
Статистическая обработка материала проведена с использованием программ STATISTICA 6.0, Microsoft Excel 2003. Для данных с нормальным распределением вычисляли среднее арифметическое (M), стандартное отклонение (SD) и ошибку среднего (m). При сравнении выборочных средних для данных с нормальным распределением использован критерий Стьюдента. Для сравнения выборочных оценок долей использован критерий Фишера. Различия считали статистически значимыми при р<0,05.
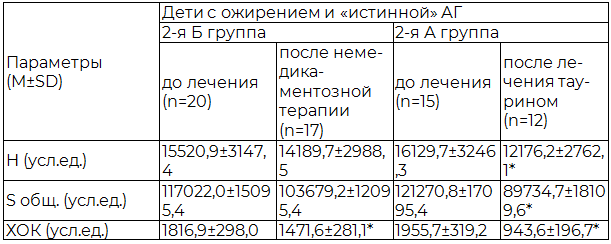
Результаты и их обсуждение. Исходные параметры оксидативного статуса у детей с ожирением и АГ свидетельствовали о регистрации более высокой интенсивности процессов СРО (Н) на фоне более низких значений антиоксидантной активности (АОА) сыворотки (S общ.) у детей 1-й группы по сравнению с детьми 2-й группы (табл. 1,2). Так, окислительный стресс (высокая интенсивность процессов СРО на фоне более низких значений АОА по сравнению с детьми контрольной группы (М±SD): Н=8237,3±1874,1 усл. ед.; S общ. =69124,7±9349,1 усл. ед.) исходно регистрировался у 62,5 % детей с ожирением и «истинной» АГ и у 25,7 % детей с ожирением и АГ «белого халата». На фоне медикаментозной терапии таурином регистрировалось уменьшение ХОК - интегрального показателя, характеризующего состояние оксидативного статуса, у детей с АГ «белого халата» в 1,49 раза, а у детей с «истинной» АГ – в 2,1 раза. При этом у детей с ожирением и АГ на фоне немедикаментозной терапии достоверных изменений в динамике параметров оксидативного статуса не выявлялось (табл. 1, 2).
Таблица 1. Динамика показателей СРО липидов сыворотки у детей с ожирением и АГ «белого халата»
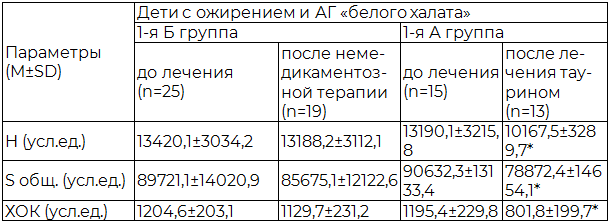
Примечания: здесь и далее * - достоверность различий (р<0,05) между параметрами детей 1-й (А и Б) группы до и после терапии.
Таблица 2. Динамика показателей СРО липидов сыворотки у детей с ожирением и «истинной» АГ
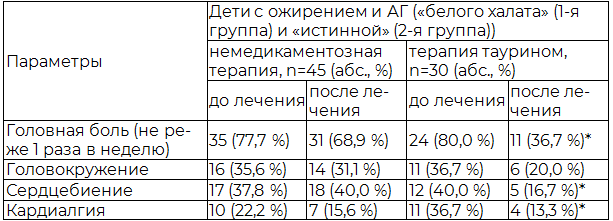
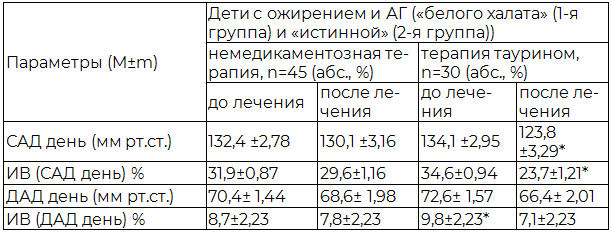
На фоне терапии таурином у детей с ожирением и АГ (1-я и 2-я группы) регистрировалось снижение уровня среднего АД (систолическое (САД) за день), индекса времени САД (ИВ, %) и уменьшение частоты таких клинических симптомов как головная боль, сердцебиение и кардиалгия, что отражено в таблицах (табл. 3,4). В то время как у детей с ожирением и АГ на фоне немедикаментозной терапии достоверных изменений в динамике вышеуказанных параметров не отмечалось (табл. 3, 4).
Таблица 3. Динамика клинических симптомов у детей с ожирением и АГ на фоне различной терапии
Примечания: здесь и далее * - достоверность различий (р<0,05) между параметрами детей с ожирением и АГ до и после терапии.
Таблица 4. Динамика параметров АД по данным суточного мониторирования у детей с ожирением и АГ на фоне различной терапии
Результаты исследования (табл. 5) свидетельствуют об улучшении исходных (базальных) показателей перфузии на микроциркуляторном уровне на фоне терапии таурином у детей с ожирением и АГ. Так, у детей 1-й группы регистрировалось увеличение перфузии на 22,5% в динамике (р<0,05), показатель которой после 2 месяцев терапии таурином достоверно не отличался от такового у детей контрольной группы. У детей с ожирением и «истинной» АГ отмечалось более значимое улучшение перфузии (+35,4%), чем у детей 1-й группы. Однако после курса терапии таурином у детей 2-й группы сохранялись еще более низкие значения перфузии по сравнению со здоровыми детьми (р<0,05).
Результаты функционального теста также свидетельствовали о положительных изменениях со стороны сосудов микроциркуляторного русла на фоне метаболической терапии. Функциональный тест (окклюзионная проба), позволяющий оценить состояние эндотелийзависимой вазодилатации (ЭЗВД), выявил плюсовой (положительный) прирост (%) изменения перфузии после нагрузочного теста у детей с ожирением и АГ (табл. 5).
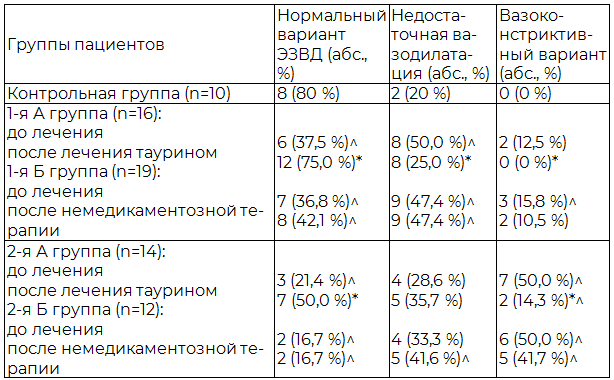
У 75% детей 1-й группы на фоне лечения таурином регистрировался нормальный вариант ЭЗВД и лишь у 25% детей отмечалась недостаточная вазодилатация. У детей с ожирением и «истинной» АГ в 3,5 раза уменьшилась частота регистрации вазоконстриктивного варианта ЭЗВД, а частота встречаемости нормального варианта ЭЗВД увеличилась в 2,38 раза (табл. 6).
Таблица 5. Динамика интенсивности кожного кровотока (перфузия) на фоне проведения функционального теста по данным лазерной допплерографии у детей подросткового возраста с ожирением и АГ на фоне терапии
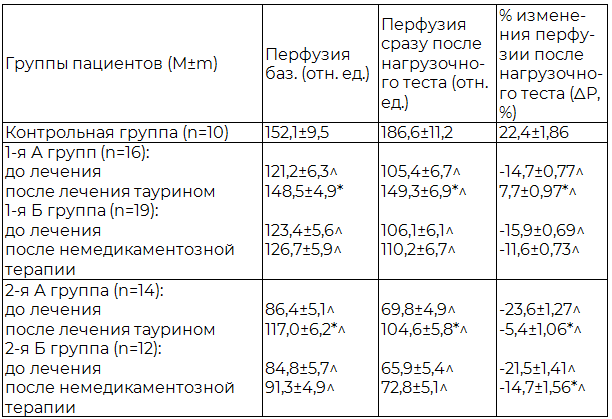
Примечания: здесь и далее ^ - достоверность различий (р<0,05) между параметрами детей контрольной группы и детей 1-й (А и Б) или 2-й (А и Б) групп; * - достоверность различий (р<0,05) между параметрами детей 1-й и 2-й групп до и после терапии.
Таблица 6. Частота встречаемости различных вариантов эндотелийзависимой вазодилатации по данным лазерной допплерографии у детей подросткового возраста с ожирением и АГ на фоне терапии
Учитывая, что таурин участвует в регуляции синтеза белков дыхательной цепи в митохондриях, опосредованно уменьшает воспалительные реакции и повышает общий холестерин липопротеидов высокой плотности [8], вероятно, его применение способствовало нормализации отдельных функций эндотелия, в том числе сосудодвигательной, и уменьшению интенсивности процессов свободно-радикального окисления. При этом положительная эффективность препарата была выявлена, как у детей с ожирением и АГ «белого халата», так и у детей с «истинной» (лабильная или стабильная) АГ. Побочных эффектов в виде гипотензивных реакций и других проявлений вегетативной дисфункции не регистрировалось.
Заключение. Таким образом, назначение метаболических препаратов с антиоксидантной и/или эндотелиопротекторной активностью у детей подросткового возраста с ожирением и АГ является оправданным с патогенетической точки зрения. Применение таурина у детей и подростков с ожирением и «истинной» АГ сопровождается нормализацией уровня АД на фоне уменьшения окислительного стресса и улучшения сосудодвигательной функции эндотелия.
Таурин следует рекомендовать для профилактики эндотелиальной дисфункции и риска формирования «истинной» АГ у детей с абдоминальным ожирением и АГ «белого халата».
