Введение. Проблема борьбы с сердечно-сосудистыми заболеваниями (ССЗ) в целом и с метаболическим синдромом (МС) в частности является одной из приоритетных задач медицинской практики. Будучи широко распространенным в популяции (от 8 до 26% взрослого населения), МС является самостоятельным фактором риска развития сердечно-сосудистых осложнений и смертности [1,2]. Накопленные данные свидетельствуют о том, что ключевую роль в патогенезе этого сложного патологического процесса играет инсулинорезистентность (ИР). ИР сопровождается повышенным риском ССЗ и нарушения функции сосудов и рассматривается как триггерный фактор, приводящий к постепенному появлению и последующему усугублению всех компонентов МС. К числу факторов риска, обусловливающих ИР и последующее развитие гиперинсулинемии, относят неправильный образ жизни (избыточное питание и низкая физическая активность) и частые психо-эмоциональные стрессы [3,4]. ИР имеет четкую ассоциацию с характером распределения жировой ткани в организме. Именно абдоминальный тип ожирения и увеличенная масса жировой ткани приводит к повышению потребности организма в инсулине, что способствует развитию гиперинсулинемии и других признаков МС. Андроидное ожирение сочетается с повышением содержания в плазме крови свободных жирных кислот, что в дальнейшем усиливает синтез липопротеинов очень низкой плотности и снижает чувствительность периферических тканей к инсулину, тем самым усугубляя ИР. Развитие ИР вызывает ухудшение утилизации глюкозы, повышению ее содержания в крови, что оказывает стимулирующее действие на бета-клетки островков Лангерганса поджелудочной железы и приводит к развитию адаптивной гиперинсулинемии. Избыток инсулина оказывает прямое влияние на тонус гладких мышц сосудов и активность бета-адренорецепторов сосудистой стенки, что способствует усилению сосудистого тонуса, повышению общего периферического сопротивления и повышению артериального давления (АД). Известно, что уменьшение плотности инсулиновых рецепторов на увеличенных, вследствие ИР, в размерах и в численности адипоцитах приводит к активации симпатоадреналовой системы. Повышение тонуса симпатоадреналовой системы сопровождается активацией ренин-ангиотензиновой систем, усилению реабсорбции воды и натрия в почках, что также суммарно ведет к развитию артериальной гипертонии (АГ) [5,6]. Объединяющим звеном между МС и ассоциированными с ним заболеваниями также служит хроническое воспаление. Результаты проводимых в течение последнего десятилетия экспериментальных и клинических научных исследований выявили, что ожирение сопровождается воспалением жировой ткани, которое протекает с инфильтрацией жировой ткани иммуннокомпетентными клетками. Выраженность этого воспаления четко коррелирует со степенью ожирения. Поскольку воспалительная реакция происходит в ткани, доля которой может составлять до 50% и более от всей массы тела, предположение системных проявлений становится закономерным. То есть локальные воспалительные процессы в жировой ткани сопровождаются хроническим слабовыраженным системным воспалением [7-11]. Многочисленные исследования показывают прямую связь выраженности клинико-лабораторных проявлений МС и риска развития заболеваний ССЗ [12], возникновения инсульта [13], развития нарушения толерантности к глюкозе, ИР и сахарного диабета 2 типа [14,15], атеросклероза и общей смертности с уровнем маркеров системного воспаления [16-19]. При этом чем больше компонентов МС в наличии, тем сильнее выражена ИР и тем выше С-реактивный белок [20-24].
Таким образом, больные АГ с МС относятся к группе высокого или очень высокого риска сердечно-сосудистых осложнений и терапевтическими целями у них являются, помимо контроля АГ, воздействие на маркеры воспаления. Улучшение чувствительности к инсулину и уменьшение хронического системного воспаления даже у лиц без клинических проявлений синдрома способны предотвратить клиническую манифестацию синдрома, а при развившихся клинических проявлениях снизить тяжесть их течения. В связи с этим представляет интерес изучение влияния препаратов различных классов антигипертензивных препаратов на маркеры воспаления (высокочувствительный С-реактивный белок (hsСРБ), молекулы межклеточной адгезии (iCAM-1)) и индекс инсулинорезистентности (индекс НОМА) у больных АГ с МС.
Материалы и методы. Было проведено открытое сравнительное исследование без применения плацебо по оценке фармакодинамических эффектов 4-х лекарственных средств - ингибиторов ангиотензинпревращающего фермента (иАПФ) с различными фармакологическими свойствами зофеноприла, периндоприла, эналаприла и бета1-адреноблокатора небиволола у 111 больного АГ I- II степени и МС (мужчин - 53, женщин – 58) в возрасте от 29 до 79 лет (средний возраст 53,2±12,8 года). После «отмывочного периода» в 7 дней больных произвольным способом распределяли в одну из четырех групп: принимавших зофеноприл в начальной дозе 15-30 мг один раз в день, принимавших периндоприл в начальной дозе 2,5-5 мг один раз в день, эналаприл 2,5-5 мг два раза в сутки и принимавших небиволол в начальной дозе 2,5-5 мг один раз в день. Больные, разделенные в группы зофеноприла, периндоприла, эналаприла и небиволола были сопоставимы по основным демографическим и клиническим характеристикам. Если при контрольном исследовании на фоне приема препарата достигался целевой уровень АД (систолическое артериальное давление (САД) <140 мм рт.ст., диастолическое артериальное давление (ДАД) <90 мм рт.ст., или снижение АД не менее 10% от исходного), то дальнейшего увеличения дозы препарата не проводили, в противном случае дозу зофеноприла, периндоприла, эналаприла и небиволола увеличивали до 45-60 мг/сут., 10 мг/сут., 10-20 мг/сут. и 7,5-10 мг/сут. соответственно. При сохраняющейся АГ на фоне монотерапии исследуемыми препаратами и невозможности наращивания дозы к терапии добавляли диуретик (индапамид-ретард 1,5 мг). Больные, которым был добавлен диуретик, исключались из дальнейшего статистического анализа показателей. Пациенты продолжали терапию сопутствующих заболеваний в прежнем объеме. Длительность лечения составила 12 недель.
Антигипертензивную эффективность оценивали по результатам офисного измерения АД и суточного мониторирования АД (СМАД).
Лабораторные исследования включали биохимическое исследование крови (общий холестерин, триглицериды, холестерин липопротеидов высокой плотности, холестерин липопротеидов низкой и очень низкой плотности, калий, креатинин сыворотки крови, глюкоза, инсулин). Концентрацию ICAM-1 определяли методом твердофазного иммуноферментного анализа ELISA с использованием диагностического набора (MedSystems Diagnostics GmbH, Австрия). Концентрация hs-СРБ определялась методом иммунотурбидиметрии с латексным усилением в микропланшетном формате («Orion Diagnostics», Финляндия). Для оценки инсулинорезистентности рассчитывали индекс НОМА (homeostasis model assesment). Этот метод расчета чувствительности к инсулину базируется на следующем положении: уровни инсулина и глюкозы натощак являются высокоинформативными показателями наличия ИР [25,26]. Модель НОМА позволяет рассчитывать индекс ИР по уравнению: Индекс инсулинорезистентности = гликемия натощак (моль/л)/ х базальный уровень инсулина (мкЕд/мл)/22,5. Чем выше индекс HOMA, тем ниже чувствительность к инсулину и, следовательно, выше ИР. Значение индекса ИР больше 2,27 рассматривается как наличие ИР [27,28]. При оценке уровня hsСРБ, iCAM-1 и индекса НОМА в группу лабораторного контроля были включены 20 больных с АГ и нормальным индексом массы тела (ИМТ) (18,5<ИМТ≤24,9 кг/м2) без МС.
Результаты исследований обработаны с помощью пакета программ «SPSS Statistics 17.0». Для сравнения четырех независимых групп количественных данных использовали одномерный (однофакторный) дисперсионный анализ и Хи-квадрат. Для нормально распределенных показателей данные представлены в виде М±σ, где М – среднее значение, σ – стандартное отклонение. Для показателей с негауссовским распределением количественные показатели представлены в виде медианы и процентилей Ме (25; 75) (Ме – медиана, 25, 75 – 25-й и 75-й процентиль). Сравнение количественных показателей проводили при помощи рангового U‑образного критерия Манна-Уитни. При анализе повторных измерений количественных признаков применяли критерий Вилкоксона. Статистически значимыми считались различия при р<0,05.
Результаты и обсуждение. Проведенное исследование позволило выявить ряд клинико-лабораторных особенностей АГ у больных с МС. При оценке активности маркеров воспаления и ИР у больных АГ с МС выявлено, что изученные параметры достоверно выше, чем в группе контроля у больных АГ без МС. У больных АГ с МС исходный уровень hsСРБ составил 3,37 (2,3;6,4) мг/л, что статистически значимо превышает аналогичный показатель в группе контроля - 2,14 (1,78;2,62) мг/л (р=0,001). Уровень iCAM-1 составил 331,6 (297,3;396,4) нг/мл, что выше аналогичного показателя в группе контроля - 234,7 (195,4;268,14) нг/мл (р=0,003). Показатель индекса НОМА составил 3,82 (2,93;4,40), что статистически значимо превышает аналогичный показатель в группе контроля - 2,09 (1,53;2,87) (р=0,006). Также был проведен раздельный индивидуальный анализ показателей маркеров воспаления у разных категорий пациентов в зависимости от дополнительных факторов риска. При изучении активности hsСРБ у обследованных больных выявлены достоверные половые различия: уровень hsСРБ у женщин составил 3,43 (2,74;6,31) мг/л, у мужчин - 3,17 (2,12;5,64) мг/л (р=0,02). Активность hsСРБ и индекс НОМА у женщин в постменопаузе составили 3,49 (2,59;7,0) мг/л и 3,44 (2,63;4,15) и были достоверно выше аналогичных показателей в группе женщин до менопаузы: 3,29 (2,63;6,38) мг/л (р=0,04) и 4,02 (3,24;4,72) (р=0,044), соответственно. Известно, что уровень hsСРБ имеет тесную связь с курением – более высокая активность отмечается у курящих лиц [29]. В нашем исследовании получены аналогичные результаты: выявлено достоверное повышение активности маркеров воспаления в группе курящих лиц по сравнению с некурящими больными. Активность hsСРБ у курящих составила 4,08 (2,96;7,04) мг/л по сравнению с некурящими лицами - 2,92 (1,78;4,70) мг/л (р=0,001), активность iCAM-1 у курящих больных составила 344,23 (301,22;400,3) нг/мл по сравнению с некурящими - 316,68 (268,92;376,2) нг/мл (р=0,005). Результаты нашей работы также демонстрируют связь активности hsСРБ и ИР, а также других факторов риска, что согласуется с данными последних исследований [23,30,31]. Выявлена достоверная прямая связь уровня hsСРБ с индексом НОМА (r=0,60, p=0,024), iCAM-1(r=0,35, p=0,009), курением (r=0,28, p=0,001), возрастом (r=0,38, p=0,002), ИМТ (r=0,43, p=0,004), женским полом (r=0,30, p=0,023) и менопаузой (r=0,32, p=0,016).
Динамика маркеров воспаления была следующей. Отмечено снижение hsСРБ под влиянием зофеноприла с 3,35 (2,25; 6,31) до 2,9 (1,34; 3,68) мг/л (р=0,043), под влиянием периндоприла с 3,23 (2,73; 4,59) до 2,67 (2,35; 3,89) мг/л (р=0,04), под влиянием эналаприла с 3,21 (2,6;4,62) до 2,98 (1,43; 3,9) мг/л (р=0,08) и небиволола с 3,15 (2,0; 4,18) до 2,3 (1,18; 4,03) мг/л (р=0,001). Аналогичные изменения были выявлены и в отношении динамики уровня iCAM-1. Уровень iCAM-1 снизился под влиянием зофеноприла с 330,2 (296,5;385,14) до 308,2 (253,6;361,2) нг/мл (р=0,045), под влиянием периндоприла с 331,1 (294,9;393,28) до 306,85 (247,12;366,1) нг/мл (р=0,036), под влиянием эналаприла с 329,4 (292,07;379,84) до 312,3 (260,9;365,8) нмг/мл (р=0,07) и небиволола с 330,23 (295,7;387,3) нг/мл до 310,07 (252,72;370,4) нг/мл (р=0,044).
Влияние изучаемых препаратов на степень ИР состояло в том что, на фоне зофеноприла индекс HOMA снизился с 3,71 (2,8;4,2) до 2,44 (1,56;3,3) (р=0,0064), на фоне периндоприла с 3,34 (2,6;4,0) до 2,82 (1,9;3,84) (р=0,01), на фоне эналаприла с 3,9 (2,9; 4,5) до 3,24 (2,72;3,96) (р=0,03). Изменения индекса НОМА под влиянием небиволола не выявлено: 3,75 (2,7;4,3) исходно и 3,4 (2,5;4,1) через 12 недель терапии (р=0,62).
Антигипертензивная эффективность зофеноприла, периндоприла, эналаприла и небиволола по данным офисного измерения САД и ДАД через 12 недель терапии была сопоставимо одинакова и составила 73,3%, 79%, 68%, 76% соответственно. Степень снижения САД была максимальной на фоне периндоприла, минимальной - на фоне эналаприла. Степень снижения ДАД была сопоставимо одинакова во всех группах.
По результатам СМАД под влиянием исследуемых препаратов отмечено улучшение суточного профиля АД. Через 12 недель лечения количество больных с нормальным суточным профилем увеличилось на 20% в группе зофеноприла, на 20,9% в группе периндоприла, на 17,6% в группе эналаприла и на 17,3% в группе небиволола.
Хорошая антигипертензивная эффективность препаратов сочеталась с хорошим профилем безопасности. Не выявлено достоверной динамики показателей липидного обмена, уровня калия и креатинина сыворотки крови. Ни один больной не выбыл из исследования из-за побочных эффектов.
Таким образом, по влиянию на маркеры воспаления преимущество имеет бета1-адреноблокатор небиволол, на индекс НОМА – ингибиторы АПФ.
Большой интерес представляла зависимость влияния изученных препаратов на активность маркеров воспаления и ИР от выраженности антигипертензивного эффекта препаратов. Нами был проведен раздельный анализ влияния антигипертензивной терапии на активность hsСРБ, iCAM-1 и индекса НОМА у больных, ответивших на лечение и у больных с недостаточной степенью снижения АД. Результаты показали, даже при отсутствии достижения целевых значений АД, отмечено снижение hsСРБ на 11,3 %, iCAM-1 на 5% и индекса НОМА на 12,1% хотя и не достигшее статистической значимости (p>0,05) (табл. 1).
Таблица 1. Динамика активности маркеров воспаления и инсулинорезистентности под влиянием антигипертензивной терапии
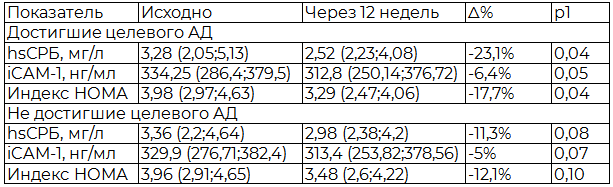
Примечание: 1 – достоверность внутригрупповых различий показателей до и через 12 недель приема препаратов.
Заключение. Ингибиторы АПФ зофеноприл, периндоприл и эналаприл и бета1-адреноблокатор небиволол оказывают положительное влияние на маркеры воспаления и ИР у больных АГ с признаками метаболического синдрома. По влиянию на индекс инсулинорезистентности преимущества имеют ингибиторы АПФ, по влиянию на биохимический маркер hsСРБ - бета1-адреноблокатор небиволол. Влияние изученных препаратов на активность маркеров воспаления и ИР проявляется независимо от выраженности гипотензивного действия препаратов. Применение зофеноприла, периндоприла, эналаприла и небиволола позволяет достичь высокой антигипертензивной эффективности в сочетании с улучшением показателей суточного профиля АД по данным СМАД и хорошим профилем безопасности.
