Введение. Острый коронарный синдром (ОКС) у большинства пациентов является первым клиническим проявлением коронарного атеросклероза, и поэтому продолжает быть ключевой темой научных исследований [16].
В настоящее время показано [6, 9], что разрыв, эрозия бляшки и функциональные повреждения коронарного кровообращения, ответственные за развитие ОКС и идентифицируемые оптической когерентной томографией, ассоциируются с различными биомаркерами и их уровнями. Будущие исследования механизмов, биомаркеров и факторов риска должны привести к более персонифицированному и таким образом, более эффективному и безопасному лечению.
Роль С-реактивного белка (СРБ) и связь его с системным воспалением и разрывом бляшки достаточно часто обсуждается на страницах научных публикаций [1, 2, 6, 12-14]. С другой стороны, остается менее изученной роль миелопероксидазы (МПО) для стратификации риска, уровни которой выше в случаях эрозий бляшек, что может быть триггером формирования тромбов [10]. Обсуждается также роль нарушений в системе Fas-опосредованного апоптоза у пациентов с коронарным атеросклерозом и связь этих нарушений с развитием ОКС [4].
Оценка риска по шкале SCORE призвана, прежде всего, выделить пациентов с высоким и очень высоким риском сердечнососудистых осложнений, и именно они оказываются в центре внимания кардиологов, занимающихся первичной профилактикой коронарной болезни. Меньше внимания привлечено к людям с низким и умеренным риском.
Цель исследования: определить взаимосвязи между традиционными факторами сердечнососудистого риска и новыми биомаркерами эндотелиальной дисфункции и возможность их для стратификации риска развития ОКС у лиц умеренного и низкого риска по шкале SCORE.
Методы. Исследование являлось аналитическим, одномоментным. Набор группы здоровых людей в возрасте от 30 до 60 лет проводился из числа медицинских работников, давших согласие на участие в исследовании по оценке факторов риска сердечнососудистых заболеваний с определением традиционных факторов риска и новых биомаркеров эндотелиальной дисфункции и апоптоза: МПО, растворимых Fas-рецептора (sFas) и лиганда (sFasL), циркулирующих эндотелиальных клеток (ЦЭК).
Критерии исключения: наличие ишемической болезни сердца (ИБС) и сахарного диабета (СД), очень высокий риск развития сердечно-сосудистых заболеваний (по шкале SCORE) [11], наличие значимой соматической патологии, отказ от участия в исследовании.
Объектом исследования стали группа практически здоровых людей, (n=31, 14 мужчин и 17 женщин), представленная преимущественно медицинскими работниками, средний возраст которых составил 43,9±8,5 года и 10 пациентов, поступивших в стационар с диагнозом ОКС с подъемом сегмента ST, 2 женщины и 8 мужчин, возраст 52,1±6,7, основная группа. Здоровым лицам контрольной группы однократно и пациентам основной группы при поступлении в стационар проводились:
- опрос о состоянии здоровья: наличие отягощенной наследственности (наличие заболеваний у родственников 1-2 линии моложе 60 лет), хронических заболеваний, включая артериальную гипертензию (АГ), курение, хронического психосоциального стресса (по шкале Холмса и Раэ) и гиподинамии (у пациентов с ОКС эти данные получали при стабилизации состояния);
- физикальное исследование: измерение роста (м) и веса (кг) с расчетом индекса массы тела (ИМТ) по формуле Кетле и оценкой степени ожирения, окружности талии (см) и бедер (см) с расчетом индекса талия/ бедро, артериального давления (АД), частоты сердечных сокращений (ЧСС);
- забор крови натощак путем пункции кубитальной вены, (у пациентов ИБС кровь на биомаркеры забиралась при поступлении до выполнения коронарной ангиографии и интервенционных вмешательств).
Рутинное лабораторное исследование выполнялось в лаборатории ГБУЗ Архангельской области «Первая городская клиническая больница им. Е.Е. Волосевич». Цельная кровь подвергалась общему анализу на гематологическом анализаторе SP-1000i фирмы F. Hoffman-LaRoche Ltd. (Швейцария).
Биохимический анализ сыворотки крови выполнялся по стандартной методике на аппарате «CobasIntegra 400» фирмы F. Hoffman-LaRoche Ltd. (Швейцария): определялись уровни креатинина с расчетом скорости клубочковой фильтрации (СКФ) по формуле MDRD, глюкозы, вчСРБ, липидов: общего холестерина (ОХС), триглицеридов (ТГ), ХС липопротеидов высокой плотности (ХСЛПВП), ХС липопротеидов низкой плотности (ХСЛПНП).
Проточная цитометрия и ИФА выполнялась на базе Центральной научно-исследовательской лаборатории ГБОУ ВПО «Северный государственный медицинский университет» Минздрава РФ. Для проточной цитометрии (проточный цитометр BeckmanCoulter 2000) использовалась цельная кровь и наборы коммерческих конъюгированных антител фирмы BeckmanCoulter Inc. (Франция): CD45-FITC и CD14-PE – для исключения неспецифического связывания, CD3-FITC и CD146-PE– для измерения количества ЦЭК.
Сывороточные уровни биомаркеров sFasL, sFas и МПО определяли методом ИФА на автоматическом анализаторе ANTHOS LABTEC INSTRUMENTS 2020 c использованием коммерческих наборов антител (BenderMedSystem GmbH, Австрия).
Для математической обработки результатов исследования использовалась компьютерная программа SPSS for Windows (версия 18). Для проверки вариационных рядов на нормальность распределения применялся тест Шапиро-Уилка. Количественные данные представлены как среднее арифметическое (M) ± стандартное отклонение (SD) в случае нормального распределения и как медиана (Me) и квартили (Q25 - 75) при иных распределениях. Достоверность различий определяли по парному и непарному t-критерию Стъюдента и критериям непараметрической статистики: χ2 для порядковых и качественных переменных, Уилкоксона для двух связанных выборок, Манна-Уитни для двух независимых выборок. При сравнении нескольких связанных групп использован анализ повторных измерений и непараметрический тест Фридмана. Статистическая достоверность присваивалась при значении p<0,05. Проводился корреляционный анализ с определением коэффициента линейной корреляции Пирсона (r) и ранговой Спирмена (ρs). Использован метод логистической регрессии и ROC-кривых (кривые операционной характеристики для диагностических тестов), по которым определяли точку разделения, чувствительность и специфичность предложенных прогностических тестов.
Результаты и обсуждение. При использовании классических способов стратификации риск развития сердечнососудистых событий у лиц контрольной группы (n=31) был низким в подавляющем большинстве случаев и варьировал по шкале SCORE от 0,10% до 4,41% (Me 0,38 (0,10; 0,62%)), по шкале Framingham – от 1% до 16% (Me 1 (1; 3%)).
При использовании классической шкалы SCORE 25 человек (80,6%) оказались в группе низкого риска (риск развития сердечнососудистых событий в ближайшие 10 лет составляет менее 1%), причем в 11 случаях (44,0%) уровень ХСЛПНП превышал рекомендуемый целевой (3,5 ммоль/л). 6 человек (19,4%) попали в группу промежуточного риска (1-5%), а уровень ХСЛПНП превышал целевое значение (3,0 ммоль/л) в 5 случаях. Определено значение биомаркера эндотелиальной дисфункции и оксидативного стресса – МПО, уровень которой составил 938,9±0,489,7 пг/мл. Значения маркеров апоптоза – sFas и sFasL (Me (Q25-Q75)) были в этой группе 49,6 (35,5; 99,3) пг/мл и 36,2 (33,0; 44,9) пг/мл, соответственно.
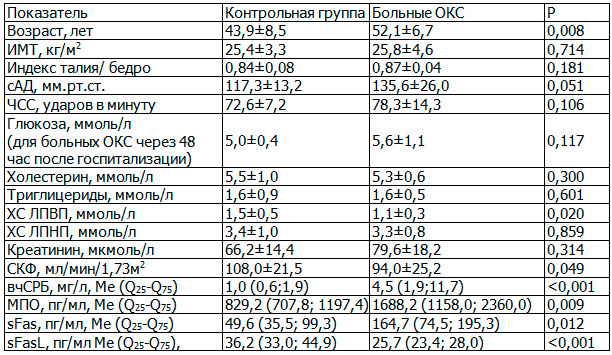
Проведено сравнение частоты традиционных факторов риска и новых биомаркеров между группами пациентов с ОКС и контрольной (табл. 1). Не было значимых различий между группами по индексу ИМТ, уровню общего ХС, ХСЛПНП, триглицеридов, сывороточного креатинина, однако уровни ХСЛПВП, вчСРБ, МПО, sFas, sFasL имели значимые различия.
Таким образом, пациенты с ОКС без метаболических нарушений, которые были сопоставимы с контрольной группой по традиционным факторам риска, за исключением ХСЛПВП, имели достоверное различие по новым биомаркерам воспаления и апоптоза. Выявлена обратная корреляционная связь между уровнем ХСЛПВП и СРБ (ρ sp.=-0,372, p=0,047), а также sFas (ρ sp.= -0,430, p=0,036), sFasL (ρ sp.= 0,497, p=0,014), МПО (ρ sp.=-0,762; p=0,028).
Таблица 1. Сравнение клинико-лабораторных показателей больных ОКС и здоровых лиц контрольной группы
Полученные нами данные согласуются с современными представлениями о проатерогенных механизмах МПО, таких как окисление липопротеидов низкой плотности, функциональная инактивация липопротеидов высокой плотности, нарушение функции эндотелия вследствие снижения оксида азота, активация матричной металлопротеиназы-7, повышение апоптоза сосудистых клеток, которые приводят к эрозированию и нестабильности бляшек [3,7-10, 15].
В 2008 г. были получены данные о повышенном содержании sFas у пациентов с нестабильной стенокардией по сравнению со здоровыми добровольцами [5], которые согласуется с полученными нами данными. Эти факты дают основание для оценки этих биомаркеров в прогностических моделях для определения риска развития ОКС.
Методом однофакторной логистической регрессии установлены предикторы развития ОКС (табл. 2, 3) – МПО и sFas.
Таблица 2. Предиктор развития ОКС – МПО
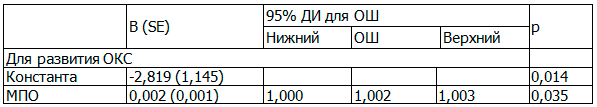
Примечание: ОШ – отношение шансов. R2=0,260 (Кокса и Снелла); R2=0,358 (Нэйджелкерка).
Площадь под ROC-кривой для МПО: 0,810 (95% ДИ 0,579 - 1,000), p=0,010. Точка разделения: МПО – 1346,4 пг/мл. Чувствительность 77,8%, специфичность 88,2%.
Таблица 3. Предиктор развития ОКС – sFas
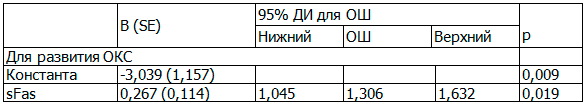
Примечание: ОШ – отношение шансов. R2=0,347 (Кокса и Снелла); R2=0,473 (Нэйджелкерка).
Площадь под ROC-кривой для sFas: 0,809 (95% ДИ 0,627 – 0,991), p=0,012. Точка разделения: sFas – 74,5 пг/мл. Чувствительность 78,8%, специфичность 73,3%.
Методом множественной логистической регрессии установлено усиление предсказательной ценности модели для развития ОКС при сочетании предикторов (табл. 4).
Таблица 4. Предикторы развития ОКС
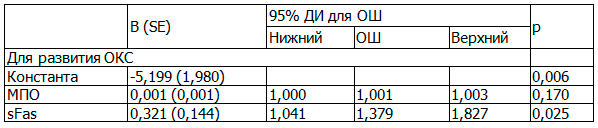
Примечание: ОШ – отношение шансов. R2=0,476 (Кокса и Снелла); R2=0,649 (Нэйджелкерка).
Содержание ЦЭК у здоровых лиц варьировало: абсолютное от 0 до 5760 в 1 мл, относительное от 0 до 0,30 %. В большинстве случаев (в образцах крови 20 человек – 64,5 %) ЦЭК не были обнаружены, у 11 человек (35,5 %) их абсолютное содержание составило от 1173 до 5760 клеток в 1 мл (Me 2295 (1357; 3900) клеток в 1 мл), относительное – от 0,05 до 0,30 % (Me 0,10 (0,06; 0,24) %). Напротив, ЦЭК были выявлены у 6 больных ОИМ при поступлении из 10 пациентов (60%). Их относительное содержание также было выше – от 0,07 до 0,85 % (Me 0,26 (0,09; 0,46) %). Определена значимая динамика (p=0,039) в частоте обнаружения ЦЭК через 48 часов и 7 суток от начала ОИМ (50 и 25% соответственно).
На объединенной группе исследуемых лиц контрольной группы и больных ОКС методом логистической регрессии не найдено влияния возраста на частоту обнаружения ЦЭК (Exp(B) 1,009; p=0,800). В группе здоровых лиц наличие ЦЭК было ассоциировано с избыточной массой тела/ожирением (p=0,034). Различия ИМТ в группе здоровых лиц при наличии (n=11) / отсутствии (n=20) определяемых ЦЭК в периферической крови оказались значимыми (рис. 1).
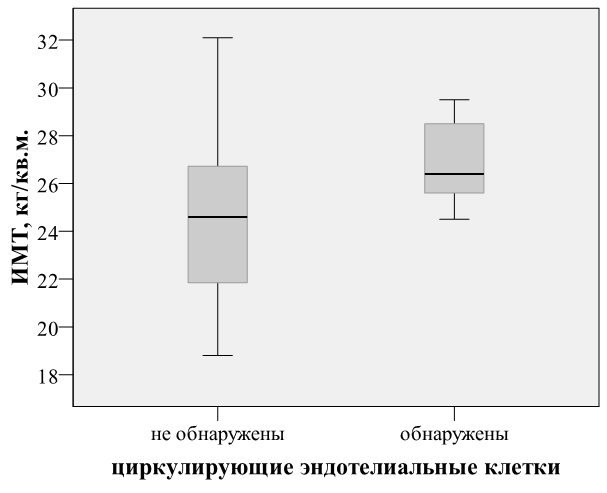
Рис. 1. Различия ИМТ у здоровых людей при наличии (n=11) / отсутствии (n=20) определяемых ЦЭК в периферической крови: U-тест Манна-Уитни: 24,5±0,8 кг/м2 против 26,9±0,5 кг/м2, U = 61500, z = -2,346, p=0,048.
Подобная динамика характеризовала и сывороточные уровни глюкозы: 5,40±0,14 ммоль/л в случае определяемых ЦЭК против 4,85±0,37 ммоль/л у остальных (Манна-Уитни U=4,000, z=-2,160, p=0,034).
Представляет интерес обнаруженная прямая корреляционная связь уровней СКФ и ЦЭК (ρ sp.=0,389; p=0,030).
Таким образом, ЦЭК, появление которых в периферической крови рассматривается как маркер эндотелиальной дисфункции, были определены у 60% больных ОИМ в день госпитализации, частота обнаружения ЦЭК снижется в течение 7 дней от начала заболевания. У здоровых лиц с факторами риска ИБС частота и содержание ЦЭК были ниже, чем у больных ОИМ со сходными параметрами традиционных факторов риска при поступлении в стационар.
Выводы. Выявлены множественные взаимосвязи между традиционными факторами сердечнососудистого риска и новыми биомаркерами оксидативного стресса, эндотелиальной дисфункции и апоптоза. Получены диагностические тесты для стратификации дополнительного риска развития острых коронарных событий у лиц с низким и умеренным риском по традиционной шкале SCORE.
