Актуальность. Многочисленные попытки доказать генетическую природу ишемической болезни сердца (ИБС), гипертонической болезни (ГБ) и атеросклероза привели к открытию новых маркеров, в роли которых выступает класс некодирующих рибонуклеиновых кислот (РНК), так называемые «малые РНК» [9, 14].
Микрорибонуклеиновые кислоты (микроРНК) – класс некодирующих РНК, обычно имеющих длину 19-24 нуклеотида, образуемые из более длинных РНК-предшественников и имеющих специфическую шпилечную структуру [13]. С момента открытия влияния микроРНК на биологические процессы предполагается, что мутации, поражающие микроРНК, могут играть патогенетическую роль в заболеваниях человека [10, 12].
Текущие доказательства указывают, что изменение экспрессии специфических микроРНК связано с широким диапазоном болезней человека, включая сахарный диабет, сердечно-сосудистые заболевания. Кроме того, микроРНК могут активировать или подавлять опухолевый рост в человеческом организме [12].
По механизму действия микроРНК могут быть разделены на проангиогенные микроРНК, запускающие ангиогенез, и антиангиогенные микроРНК, подавляющие его [14].
В настоящей статье изучены проангиогенные микроРНК на примере miR-126 и miR-155. Так, miR-126 специфически на высоком уровне экспрессируется в эндотелиальных клетках. В некоторых исследованиях было показано, что miR-126 регулирует экспрессию васкулоэндотелиального фактора роста (VEGF) и фактора роста фибробластов (FGF), которые являются индукторами ангиогенеза [1]. Как известно, экспрессия этих факторов играет определяющую роль в развитии коллатеральных сосудов при ишемии миокарда.
Другие исследования показывают, что 1 тип рецепторов к ангиотензину II (АТ1Р) и miR-155 совместно экспрессируются в эндотелиальных и гладкомышечных клетках, и что miR-155 подавляет экспрессию АТ1Р. Показано также, что, стимуляция фибробластов трансформирующим фактором роста-бета 1 уменьшает экспрессию микроРНК и повышает экспрессию человеческого АТ1Р, демонстрируя физиологическую регулирующую роль miR-155 [14].
Вместе с тем, следует указать, что данные об уровне проангиогенных miR-126 и miR-155 в условиях выраженного атерогенеза в литературе отсутствуют. В тоже время проведение подобного исследования представляется, безусловно, актуальным, особенно с учетом распространенности атеросклероза и его осложнений.
Цель исследования – изучение экспрессии miR-126 и miR-155 у больных с ГБ и ИБС постинфарктным кардиосклерозом (ИБС ПИКС).
Материалы и методы. Было обследовано 50 мужчин, находившихся на стационарном лечении в кардиологическом отделении Областной клинической больницы города Твери, и 15 здоровых мужчин.
Сформированы выборки из трех групп сравнения. В I группу включили 15 здоровых мужчин от 29 до 47 лет (средний возраст 33,93±1,14 лет), данная группа рассматривалась как контрольная. II группа состояла из 30 пациентов, страдающих ГБ в возрасте от 29 до 65 лет (средний возраст 47,73±1,97 лет). Критерии групповой принадлежности: мужской пол и наличие ГБ I-II стадии без систолической дисфункции миокарда левого желудочка [4] и отсутствие на момент обследования диагноза ИБС. В III группу были включены 20 мужчин, имеющих в анамнезе подтвержденный клинически и лабораторно инфаркт миокарда в возрасте от 46 до 84 лет (средний возраст 60,4±1,9 лет). Критерии включения в данную группу больных: наличие верифицированного диагноза ИБС ПИКС. Критерии исключения: лица, страдающие сахарным диабетом, сопутствующими заболеваниями почек, легких, желудочно-кишечного тракта, печени, заболеваниями крови и нарушениями обмена веществ, отягощенным аллергологическим анамнезом, аллергическими заболеваниями и профессиональными вредностями.
Общая РНК, включая микроРНК, была получена комбинированным методом из плазмы крови с помощью набора miRNeasy Mini Kit (Qiagen, Германия) и лизирующего реагента TRIzol® LS Reagent (Invitrogen, США), описанным в литературе [6]. Для образцов микроРНК с концентрациями от 25 нг/мкл проводили обратную транскрипцию на четырехканальном амплификаторе «Veriti» («Applied Biosystems», США) для получения комплементарной дезоксирибонукленовой кислоты (кДНК) с использованием набора TaqMan® MicroRNA Reverse Transcription Kit по стандартной схеме, представленной производителем. Реакционную смесь, содержащую тотальную микроРНК и смесь для проведения обратной транскрипции, подвергали нагреванию в несколько циклов:
- 30 минут при 16°С,
- 30 минут при 42°С,
- 5 минут при 85 °С,
- и далее нагревание при 4°С.
Экспрессию miR-126 и miR-155 оценивали с помощью показателя ∆Сt [11], который определяли трижды методом полимеразной цепной реакции (ПЦР) в режиме реального времени на приборе «ABI Prism 7500» с помощью набора Taq Man Small RNA Assays («Applied Biosystems», США) с применением полученной кДНК и праймеров miR-126, miR-155 с использованием стандартного протокола, предложенного производителем. В качестве эндогенного контроля использовали праймер RNU6B, показывающий относительно стабильную экспрессию, независимо от того в каких тканях и клеточных культурах определяется [7].
Методы статистической обработки данных. Накопление, корректировка, систематизация и визуализация полученных результатов проводилась в электронных таблицах «Excel». Для расчета количественного изменения микроРНК использовали метод 2 -∆∆Сt, предложенный K. J. Livak и T. D. Schmittgen [8], где Ct – это пороговое значение цикла, где флуоресценция впервые фиксируется достоверно выше порогового уровня.
Попарное сравнение показателей ΔCt контрольной группы с группами ГБ и ИБС ПИКС проводили с помощью U-критерия Манна-Уитни, который используется для оценки различий между двумя малыми выборками по уровню количественно измеряемого признака. Биометрический анализ осуществлялся с использованием пакета WINPEPI (PEPI-for-Windows).
За уровень статистической значимости принимали p < 0,05.
Результаты и обсуждение. Согласно данным литературы, нарушение функционирования определенных микроРНК может способствовать развитию сердечно-сосудистых заболеваний, в частности, ИБС, атеросклероза, постинфарктного ремоделирования миокарда, хронической сердечной недостаточности и сократительной дисфункции сердца [3]. При этом, как правило, при каждой патологии меняется экспрессия не одной, а множества микроРНК, а для ряда заболеваний спектр задействованных микроРНК перекрывается [2].
Считается, что повышением или понижением уровня экспрессии микроРНК в исследуемом образце крови или ткани является изменение значения уровня этой экспрессии в пять и более раз по отношению к контрольному образцу [5].
Полученные результаты изучения уровня экспрессии микроРНК у больных ГБ и ИБС ПИКС представлены в табл. 1 - 2.
В табл. 1 показано, что в настоящем исследовании уровень экспрессии miR-126 оказался в 256 раз выше у больных с ГБ и почти в 267 раз выше раз у больных ИБС ПИКС по сравнению с контрольной группой.
Таблица 1. Показатели уровня экспрессии miR-126 у больных ГБ и ИБС ПИКС
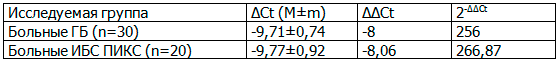
Примечания: здесь и далее: ΔCt – разность между значениями Ct исследуемой микроРНК и эндогенного контроля, M - среднее значение уровня экспрессии микроРНК, m – стандартная ошибка среднего, ΔΔCt - разность между значениями ΔCt исследуемого образца и контрольного, 2-∆∆Ct – формула для подсчета уровня экспрессии исследуемой микроРНК.
Прямых доказательств участия данной микроРНК в патогенезе сердечно-сосудистых заболеваний в литературе не описано, хотя по данным некоторых авторов miR-126 может играть важную роль в развитии сосудистой патологии и процессах внутрисосудистого ремоделирования [14]. Также проведенное в 2011 году исследование, показало существование обратной корреляции увеличения уровня miR-126 с улучшением ряда физиологических параметров у пациентов с сердечной недостаточностью [3].
Анализ табл. 2 показывает, что в данном исследовании уровень экспрессии miR-155 остается неизменном как у больных ГБ, так и у пациентов с ИБС ПИКС.
Таблица 2. Показатели уровня экспрессии miR-155 у больных ГБ и ИБС ПИКС

Правильность сделанных выводов была подтверждена проведением попарного сравнения показателей ΔCt контрольной группы с группами ГБ и ИБС ПИКС с помощью U-критерия Манна-Уитни. При этом были получены сходные результаты. Так, было показано, что группы больных ГБ и ИБС ПИКС достоверно отличаются от контрольной группы по уровню плазменной miR-126 (p<0,001), для miR-155 достоверных различий получено не было (табл. 3).
Таблица 3. Сравнение показателей ΔCt в контрольной группе, у больных ГБ и ИБС ПИКС с помощью U-критерия Манна-Уитни
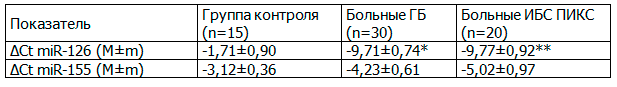
Примечания: * - статистическая значимость различий (р<0,05) между группой больных ГБ и контрольной, ** - статистическая значимость различий (р<0,05) между группой больных ИБС ПИКС и контрольной.
Выводы. Таким образом, в результате проведенных нами исследований обнаружено, что уровень экспрессии miR-126 у больных ГБ и ИБС ПИКС достоверно отличается от контрольной группы здоровых людей. С другой стороны, изменение уровня экспрессии miR-155 не удалось ассоциировать с изученными заболеваниями, что, возможно, указывает на отсутствие выраженной роли miR-155 в патогенезе сердечно-сосудистой патологии.
Полученные данные свидетельствуют о том, что miR-126 может использоваться в качестве специфической микроРНК для изучения патогенеза и разработки патогенетической терапии сердечно-сосудистых заболеваний.
