Европейским обществом гипертонии в 2013 г. был предложен дополнительный критерий для количественной оценки риска сердечно-сосудистых осложнений (ССО) – сердечный или сосудистый возраст [7]. Учитывая значительную заболеваемость гипертонической болезнью (ГБ) в Российской Федерации и ее роль в кардиальном континууме [1, 3, 4], определение сосудистого возраста (СВ), как фактора прогрессирования данного заболевания, является особенно актуальным на этапе первичной диагностики и дальнейшего диспансерно-динамического наблюдения [2].
Цель исследования: определить значение сосудистого возраста и оценить его связь с длительностью артериальной гипертензии у мужчин молодого и среднего возраста с инициальной гипертонической болезнью.
Материал и методы исследования. В клинике госпитальной терапии Военно-медицинской академии было обследовано 125 мужчин в возрасте 39,2±6,7 лет. В ходе осмотра у 98 мужчин в соответствии с критериями Всероссийского научного общества кардиологов (клинические, анамнестические, лабораторно-инструментальные данные) была диагностирована артериальная гипертензия (АГ) и первая стадия ГБ, остальные 27 человек составили группу контроля. СВ устанавливался расчетным способом [6]. Пациенты с наличием сахарного диабета (СД) 2 типа, ассоциированных клинических состояний и поражением органов-мишеней в исследование не включались.
Всем больным при поступлении в стационар натощак производили забор крови для определения уровня общего холестерина (ОХ), липопротеидов высокой (ЛПВП), низкой (ЛПНП), очень низкой (ЛПОНП) плотности, триглицеридов (ТГЛ), глюкозы, креатинина, калия, С-реактивного белка. Расчет скорости клубочковой фильтрации (СКФ, мл/мин/1,73м2) осуществляли по формуле MDRD-EPI. 10-летний риск по Фрамингемской шкале риска (ФШР) и сосудистый возраст (СВ) рассчитывались с применением логистической регрессии (калькулятор Excel).
СВ = 1-0,88431exp(ΣßX - 23.9388)
где ß – коэффициент регрессии, Х – уровень каждого фактора риска: возраст – 3,06, ОХ – 1,12, ЛПВП - - 0,93, уровень систолического артериального давления (при терапии) – 2, уровень систолического артериального давления (без терапии) – 1,93, курение – 0,65, СД 2 типа – 0,57.
Для морфофункциональной оценки сердца и крупных сосудов использовали стандартную методику эхокардиографии (ЭхоКГ) на приборе «Esaote MyLab 70» эхоимпульсным методом в одно- и двухмерном режиме. Определяли конечный диастолический и систолический размеры (КСР, КДР, мм) левого желудочка, толщину задней стенки левого желудочка (ТЗСЛЖ, мм) и межжелудочковой перегородки (ТМЖП, мм) в диастолу, фракцию выброса левого желудочка (ФВ ЛЖ, %), показатели диастолической функции левого желудочка (Vе/Vа – соотношение скоростей раннего диастолического наполнения и наполнения в систолу предсердий, см/с), рассчитывали индекс массы миокарда ЛЖ (ИММЛЖ, г/м²) по формуле Devereaux. При оценке толщины комплекса интима-медиа (ТИМ) также применяли стандартную методику исследования и ультразвуковой датчик 7 МГц. Ультразвуковое исследование (УЗИ) органов брюшной полости проводились с использованием тех же ультразвуковых систем с применением абдоминального режима. Сосудистый рисунок печени исследовался в В-режиме для выявления признаков его обеднения и деформации сосудов.
Помимо скрининговых методов у обследуемых анализировались дополнительные биохимические показатели: аполипопротеины А1 и В (АпоА1, АпоВ), цистатин С, выполнялся стандартный глюкозотолерантный тест (ГТТ), определялся уровень гликированного гемоглобина (HbAc), мочевой кислоты, скорость клубочковой фильтрации (СКФ); с помощью ультразвуковых методик оценивались толщина комплекса интима-медиа (ТИМ), морфофункциональное состояние сердца и печени.
Было сформировано 3 группы: I – 59 мужчин 39,2±5,7 лет с первично диагностированной ГБ I стадии с анамнезом (по данным жалоб и/или медицинской документации) АГ 6,9±4,0 лет, II – 39 мужчин 39,1±7,1 лет с ГБ без указания на длительную АГ; III группу (контроль) составили 27 мужчин 39,5±8,2 лет без кардиоваскулярных заболеваний.
Статистическая обработка результатов исследования проводилась с соблюдением принципов доказательной медицины с использованием пакета прикладных программ Statistica 10 for Windows. При сравнении распределений количественных показателей в группах использовались методы параметрического анализа (дисперсионный анализ для сравнения 3 групп и критерий Стьюдента t для сравнения 2 групп). Проверка гипотезы о происхождении групп, сформированных по качественному признаку, проводилась на основе построения таблиц сопряжённости наблюдаемых и ожидаемых частот; применялся критерий χ2 Пирсона, оценка силы, направления и значимости корреляционной связи между показателями выполнена с применением коэффициента корреляции ρ Спирмена.
Результаты исследования. При обследовании по классической методике анализировались жалобы, анамнез заболевания и жизни, данные объективного осмотра (табл. 1). У большинства пациентов с АГ отмечалась головная боль в различных областях головы (85%); головокружение, слабость, зрительные расстройства изолированно встречались гораздо реже (до 15%) без значимых внутригрупповых различий. Выявлена тенденция к увеличению частоты отягощенного анамнеза по сердечно-сосудистым заболеваниям (ССЗ) и СД 2 типа в группах от контроля к пациентам с длительно текущей АГ (p>0,05). Аналогичная тенденция отмечалась и с регулярным курением в группах. Качественные и количественные признаки алиментарного ожирения достоверно чаще по сравнению с контролем выявлялись в I и II группах (ИМТ – p=0,004; объем талии (ОТ) p=0,01; частота ожирения χ2=15,6, p=0,015). При офисной оценке артериального давления (АД) его систолический и диастолический компоненты (САД и ДАД) ожидаемо оказались значимо выше в группах с АГ (p<0,001) по сравнению с контролем.
Таблица 1. Клинические и анамнестические показатели в группах, М±σ
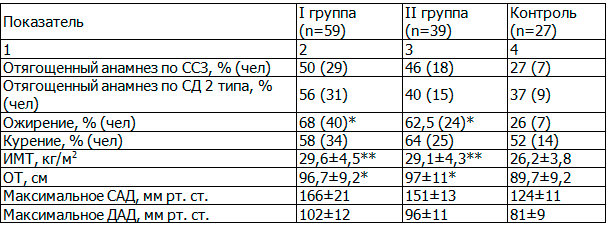
Примечание: в 2-м столбце различия между I и контролем; в 3-м – между II группой и контролем; здесь и далее * - уровень значимости p<0,05; ** - p<0,01.
При оценке липидного спектра получены следующие данные (табл. 2). Отмечались значимые межгрупповые различия уровня ТГЛ: у пациентов с ГБ и длительным анамнезом АГ по сравнению с аналогичной группой без длительной гипертензии (p=0,01) и контролем (p=0,027). По другим показателям стандартной липидограммы значимых различий выявлено не было (p>0,05). Исследование белков-переносчиков липопротеидов (АпоА1, АпоВ, АпоВ/АпоА1) также не продемонстрировало выраженных групповых изменений (p>0,05).
Таблица 2. Липидограмма в группах обследованных мужчин, М±σ
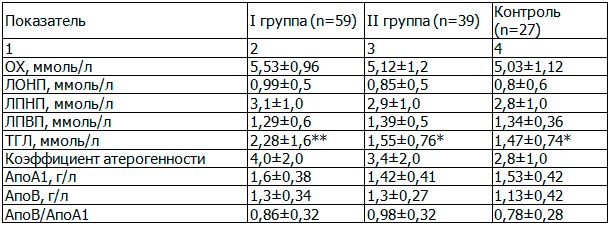
Примечание: в 3-м столбце различия между I и II группами; в 4-м – между I группой и контролем.
Исследование тощаковой гликемии показало более высокую встречаемость нарушенной гликемии натощак у пациентов с гипертензией по сравнению с контролем. При более детальном обследовании с применением ГТТ были получены достоверные различия по уровню глюкозы через 2 часа – нарушенная толерантность к глюкозе (НТГ) – после стандартной гликемической нагрузки (p=0,047 при проведении дисперсионного анализа) между пациентами с длительной гипертензией и контролем (p=0,01 при использовании t-критерия). По уровню гликированного гемоглобина и общей частоте преддиабета сравниваемые группы достоверно не различались (p>0,05).
Таблица 3. Гликемический профиль в группах, М±σ
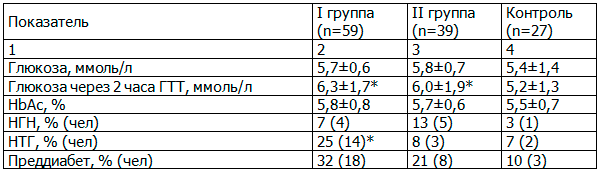
Примечание: в 2-м столбце различия между I группой и контролем; в 4-м – между II группой и контролем.
Стоит отметить, что частота выявления метаболического синдрома (как интегрального показателя нарушенного гликемического и липидного гомеостаза в сочетании с АГ) была значительно выше у пациентов с длительным течением ГБ (59%) по сравнению с пациентами без анамнеза АГ (46%) (χ2=20,3, p<0,001).
Анализируя другие полученные лабораторные показатели (табл. 4), можно констатировать нормальные показатели гемостаза и свертывающей функции в группах. При рутинной оценке функционирования мочевыделительной системы во всех группах выявлены нормальные показатели креатинина, СКФ и сывороточного калия, однако при более тщательном диагностическом поиске с определением уровня цистатина С была обнаружена тенденция к его повышению при длительном протекании ГБ. Исследование суточной потери белка с мочой продемонстрировало значимое межгрупповое различие (p=0,03 при дисперсионном анализе): между I и II группами (p=0,046) и между I группой и контролем (p=0,048). Ферменты печеночного цитолиза (трансаминазы – АЛТ, АСТ), щелочная фосфатаза (ЩФ) у обследованных находились в пределах референсных значений, однако у пациентов с длительной АГ по сравнению с контрольной группой отмечалось значимое повышение гаммаглутамилтранспептидазы (ГГТП), как возможное проявление холестатического синдрома (p=0,038).
Таблица 4. Другие лабораторные параметры в группах, М±σ
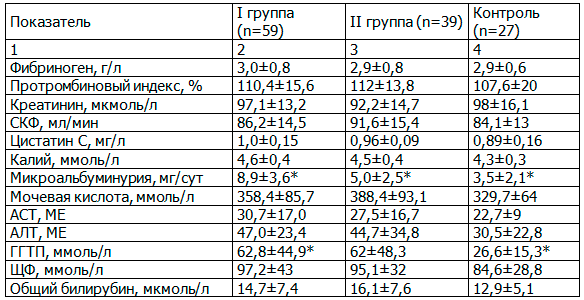
Примечание: в 2-м столбце различия между I группой и контролем; в 4-м – между II группой и контролем.
По основным показателям ЭхоКГ (табл. 5) достоверных различий не отмечалось (p>0,05), что доказывает равномерность распределения пациентов в группах и отсутствие гипертрофии и дилатации левых камер сердца. Систолическая и диастолическая функции левого желудочка во всех группах были в пределах нормы. У большинства обследованных толщина эндотелиальной выстилки крупных сосудов находилась на уровне референсных интервалов, в I группе данный параметр приближался к верхнему пограничному значению. Ультразвуковым методом качественно оценивались признаки атеросклероза клапанных структур сердца и стенки аорты: данные изменения были более характерны для мужчин с длительным анамнезом АГ по сравнению с контролем (χ2=5,3, p=0,05). Также более часто в этом контингенте выявлялись признаки жирового гепатоза: гиперэхогенность печени и гепатомегалия (χ2=9,1, p=0,01 и χ2=6,2, p=0,04 соответственно).
Таблица 5. Морфометрия сердца, крупных сосудов и печени, М±σ
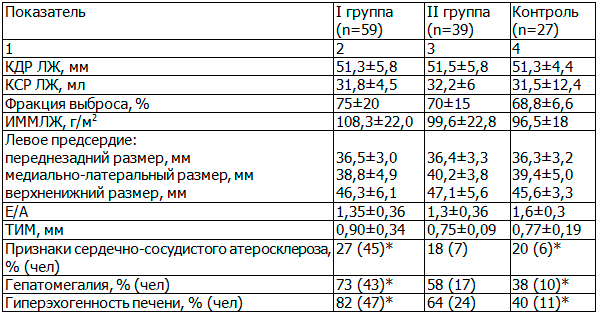
Примечание: в 2-м столбце различия между I группой и контролем.
При оценке расчетным методом СВ в исследуемых группах (рис. 1) составил: при наличии ГБ и длительной АГ – 65,4±17 лет (при биологическом возрасте 39,2±5,7 лет); у мужчин с ГБ без длительной АГ- 56,8±16,6 лет (39,1±7,1); в контроле – 47,5±17,5 (39,5±8,2) лет (p<0,001). Полученная разница между фактическим и рассчитанным возрастом составила: в I группе – 26,2±14,4 лет, во II – 17,7±12,5 лет, в контроле 8,3±6,2 года(p<0,001). В результате тех же вычислений во всех группах был определен риск ССО по ФШР: у пациентов I группы – 19,7±12,0% (средний риск), во II – 12,2±8,5% (низкий риск) и в контроле 8,2±6,1% (низкий риск) (p<0,001).
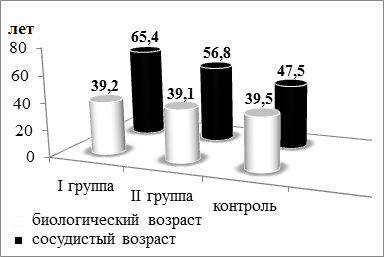
Рис. 1. Биологический и сосудистый возраст в группах.
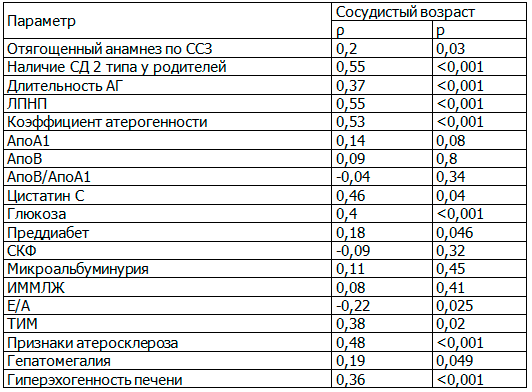
Для оценки взаимосвязи анамнестических, объективных и лабораторно-инструментальных показателей с СВ был проведен корреляционный анализ с применением рангового коэффициента корреляции ρ Спирмена (табл. 6). В анализ не включались признаки, входящие в математический калькулятор по расчету СВ (возраст, систолическое АД, курение, уровень общего холестерина и ЛПВП). Полученные результаты свидетельствуют о наличии прямой значимой взаимосвязи различной выраженности СВ с отягощенным анамнезом по ССЗ и СД 2 типа у родственников I линии, длительностью АГ, дислипидемией, нарушениями углеводного обмена, повышением уровня цистатина С, атеросклеротическими изменениями клапанов сердца и сосудов, признаками жировой дистрофии печени. Продемонстрирована обратная взаимосвязь СВ и наличием диастолической дисфункции. С другими показателями (АпоА1, АпоВ, АпоВ/АпоА1, СКФ, микроальбуминурия, ИММЛЖ достоверной связи не установлено.
Таблица 6. Оценка корреляционной связи анамнестических, биохимических и ультразвуковых показателей с сосудистым возрастом
Обсуждение полученных результатов. Особенностью дизайна нашего исследования было включение в него пациентов с начальными проявлениями ССЗ, до появления выраженных изменений в органах-мишенях. Обследуемые во всех группах были сопоставимы по возрасту, анамнестическим сведениям, курению. Результаты исследования выявили увеличение частоты ожирения у пациентов с длительно текущей АГ, что может быть обусловлено патогенетическими взаимосвязями 2 заболеваний (гиперволемия, повышение общего сосудистого сопротивления). Анализ липидного спектра не продемонстрировал существенных изменений, однако отмечалось достоверная гипертриглицеридемия у пациентов I группы, что могло быть связано с большей частотой трофологических расстройств (ожирения) и связанной с ним дислипидемии. Скрининговая оценка гликемического профиля также не выявила значимых межгрупповых различий и отклонений от нормы. Тем не менее, после проведенного нагрузочного теста с 75 г глюкозы частота выявленных расстройств (НТГ) была значительно выше у пациентов I группы, что свидетельствует о повышении риска СД 2 типа при длительной неконтролируемой гипертензии, что соответствует данным международных исследований [5]. Такие параметры, как креатинин, СКФ, калий, находились в пределах нормы, благодаря чему у всех обследованных исключалось поражение почек. Однако уровень цистатина С, хоть и не продемонстрировавший межгруппового различия, у пациентов с ГБ и длительной АГ приближался к верхнему пограничному значению. Также обращало на себя внимание статиститически значимое различие уровня микроальбуминурии, более высокое в том же контингенте. Все эти данные могут быть свидетельством скрытого поражения почек на фоне асимптомной АГ.
Отмечено, что у пациентов, отнесенных к группе ГБ и длительной АГ при сопоставимых величинах КДР, КСР, ИММЛЖ более часто выявлялись признаки атеросклеротического поражения клапанного аппарата и стенки аорты. Для этой же группы были более характерны признаки жировой дистрофии печени, что указывает на возможную взаимосвязь этих заболеваний.
Проведенный расчет СВ показал его превышение над биологическим во всех обследованных группах. Данный факт может быть обусловлен высокой распространенностью курения в данном контингенте. При длительном течении АГ отмечались более высокие значения СВ, что делает данный показатель одним из репрезентативных для оценки течения ГБ. Продемонстрированная взаимосвязь сердечного/сосудистого возраста с морфологическими изменениями в сонных артериях, что свидетельствует правомочности применения расчетного метода для прогнозирования структурных изменений. Связи СВ с анамнезом, показателями липидограммы, углеводным обменом, ультразвуковыми изменениями в сердце, сосудах и печени делают данный параметр практически универсальным и позволяют использовать его для оценки прогрессирования ССЗ, а также оценки функционального состояния организма в целом.
Выводы
- Длительное течение артериальной гипертензии даже на ранних стадиях гипертонической болезни сопряжено с нарушениями углеводного, липидного обменов, нарушением функции почек, что требует контроля данных показателей при первичном обследовании и в динамике.
- Высокие расчетные показатели сосудистого возраста имеют четкую связь с длительностью течения артериальной гипертензии у пациентов, следовательно, данный интегральный показатель является вполне применимым для оценки прогнозирования заболевания в повседневной клинической практике.
- Сосудистый возраст взаимосвязан с атеросклеротическими изменениями в сердечно-сосудистой системе, а также с жировой дистрофией печени, что свидетельствует о возможности применения данного показателя не только для изолированной оценки функционального состояния сердца и крупных сосудов, но и на уровне целостного организма.
