Актуальность. Развитие наиболее социально значимых сердечно-сосудистых заболеваний (ССЗ), в основе которых лежит прогрессирование структурно-функциональных изменений сердца и сосудов с дальнейшим возникновением их острых и хронических осложнений, в последние 15 лет рассматривается с позиций «сердечно-сосудистого континуума». Эта концепция, впервые высказанная V. Dzau и E. Braunwald [7], на сегодня не только стала общепризнанной, но по сути представляет собой краеугольный камень, на котором зиждется наше понимание процессов развития важнейших ССЗ [3]. На современном этапе развития кардиологии, наряду с «традиционными» факторами риска (ФР) (курение, артериальная гипертензия, избыточная масса тела и др.), большое значение придают так называемым «новым» ФР, к которым относят гипертрофию и геометрию левого желудочка, жесткость артерий, эндотелиальную дисфункцию, вариабельность сердечного ритма и ряд других [4, 5]. Начинаясь как многофакторный, многокомпонентный процесс, сердечно-сосудистый континуум пролонгируется через серию сосудистых и сердечных изменений: дисфункцию эндотелия, атеросклероз, артериосклероз, гипертрофию левого желудочка (ГЛЖ), низкую вариабельность, высокую частоту сердечных сокращений. Непрерывная цепь взаимосвязанных изменений структуры и функции сразу нескольких органов и систем организма в рамках континуума предполагает наличие общих патофизиологических процессов, механизмов развития и прогрессирования органных повреждений [1, 6]. Был предложен «гипертонический каскад» сердечно-сосудистого континуума, в котором центральную роль играет собственно артериальная гипертензия и гипертоническое поражение сердца, приводящее в финале к развитию необратимых терминальных изменений, минуя сразу несколько этапов классического континуума [2]. Ускоряет сердечно-сосудистый континуум и ухудшает прогноз пациентов присоединение сахарного диабета (СД) типа 2. Основной причиной высокой инвалидизации и смертности больных СД типа 2 являются кардиоваскулярные нарушения. При СД наряду с неспецифическими ФР развития ССЗ, свое патогенное влияние оказывают и специфические факторы (гипергликемия, гиперинсулинемия, инсулинорезистентность). Вероятно, к специфическим факторам формирования ССЗ при СД следует также отнести прогрессирующую денервацию сердца и сосудов в результате диабетической автономной нейропатии [8]. Сочетание СД и гипертонической болезни (ГБ) повышает риск развития микро- и макрососудистых нарушений и, соответственно, предопределяет высокую частоту ранних инвалидизации и смертности, в первую очередь от ССЗ.
Цель. Выявить особенности морфо-функционального состояния сердца и сосудистой стенки у пациентов, ассоциированные с сахарным диабетом 2 типа у пациентов с гипертонической болезнью I-II стадии.
Материал и методы. Проанализированы результаты инструментального обследования у пациентов с гипертонической болезнью I-II стадии в сочетании с сахарным диабетом 2 типа (ГБ+СД) и изолированной гипертонической болезнью I-II стадии (ГБ). Группу контроля (К) составили 50 практически здоровых человек.
Первую группу (ГБ+СД) составили 120 человек в возрасте 50-59 лет, 50 мужчин (40%), 70 женщин (60%) в возрасте 50-59 лет, средний возраст 54,3±4,1 год. Стаж артериальной гипертензии составил от 1 до 15 лет, в среднем 7,7±3,1 год, медикаментозная терапия была назначена у всех пациентов и включала от одного до трех препаратов. 70 пациентов (60%) регулярно принимали назначенные препараты. Целевой уровень АД был достигнут у 50 человек (40%). У 34 пациентов (28%) после проведения клинико-лабораторного исследования была установлена I стадия ГБ, у 86 (72%) – II стадия. С учетом наличия сахарного диабета риск сердечно-сосудистых осложнений стратифицировался как высокий добавочный. Стаж сахарного диабета составил 1-4 года, в среднем 2,8±1,5 лет, все пациенты регулярно получали пероральные сахароснижающие препараты. О компенсации диабета судили по уровню гликозилированного гемоглобина, компенсация выявлена у 66 пациентов (55%), субкомпенсация – у 54 (45%).
В качестве группы сравнения (ГБ) обследовано 50 пациентов с изолированной ГБ I-II стадии, 20 мужчин (40%) и 30 женщин (60%) в возрасте 50-59 лет, средний возраст 52,6±3,9 лет. Стаж артериальной гипертензии составил от 1 до 14 лет, в среднем 6,9±2,8 лет, медикаментозная терапия была назначена 23 пациентам (64%) и включала от одного до трех препаратов. 40 пациентов (80%) регулярно принимали назначенные препараты. Целевой уровень АД был достигнут у 28 человек (56%). У 14 пациентов (28%) после проведения клинико-лабораторного исследования была установлена I стадия ГБ, у 36 (72%) – II стадия. Риск сердечно-сосудистых осложнений стратифицировался как низкий у 6 пациентов (12%), средний у 14 (28%), у 30 (60%) как высокий добавочный.
Таким образом, группа сравнения соответствовала основной группе по полу, возрасту, характеру артериальной гипертензии и принимаемой антигипертензивной терапии. Эхокардиография проводилась на ультразвуковом сканере Logic-5 XP датчиком 3,5 мГц в положении больного на левом боку под углом 45° по стандартным методикам. Определялись основные показатели: толщина задней стенки левого желудочка в диастолу (ТЗС ЛЖ), толщина межжелудочковой перегородки в диастолу (ТМЖП), конечно-диастолический размер (КДР) и конечно-систолический (КСР) размеры левого желудочка, конечно-диастолический объем (КДО) и конечно-систолической (КСО) левого желудочка по алгоритму площадь-длина, диаметр аорты (Ао), максимальный размер левого предсердия (ЛП), объем левого предсердия (ОЛП) по алгоритму площадь-длина и его индексированный показатель (ИОЛП).
Рассчитывались следующие показатели:
1) Масса миокарда левого желудочка (ММЛЖ) и его индексированный показатель (ИММЛЖ). За признак ГЛЖ сердца взят стандартный критерий – индекс массы миокарда левого желудочка (ИММЛЖ) > 115 г/м2 для мужчин и > 95 г/м2 для женщин.
2) Относительная толщина стенок миокарда (ОТМС). Типы геометрии левого желудочка определялись на основании ОТМС как соотношения 2ТЗС ЛЖ/КДР ЛЖ.
Выделялись следующие модели геометрии левого желудочка:
- неизмененный;
- концентрическое ремоделирование (ГЛЖ нет, 2ТЗС ЛЖ/КДР ЛЖ ≥ 0,42);
- концентрический тип ГЛЖ (есть критерии ГЛЖ, 2ТЗС ЛЖ/КДР ЛЖ ≥ 0,42);
- эксцентрический тип ГЛЖ (есть критерии ГЛЖ, 2ТЗС ЛЖ/КДР ЛЖ < 0,42).
3) Фракция выброса (ФВ) по формуле (КДО-КСО)/КДО.
Для определения толщины сосудистой стенки общей сонной артерии. выполнялось ультразвуковое триплексное сканирование сонных артерий (общей, наружной и внутренней) на ультразвуковом сканере «LOGIQ 5-ХР» с линейным датчиком с частотой 10 МГц в М-, В-, CDW- и PW-режимах.
Измерение толщины комплекса интима-медиа (ТИМ) сонной артерии проводилось по методике A. Poli c соавторами [9] в общей сонной артерии, на ее дальней стенке, на 2 см проксимальнее бифуркации сонной артерии. Проводилось по 5 измерений с интервалом 2 мм с обеих сторон с вычислением среднего из полученных 10 показателей.
Проба с реактивной гиперемией плечевой артерии определялась на ультразвуковом сканнере «LOGIQ 5-ХР» с линейным датчиком с частотой 10 МГц в В-режиме. Визуализация просвета плечевой артерии проводилась на 2 см проксимальнее локтевого сгиба. Диаметр плечевой артерии (d) измерялся между наружной и внутренней стенками с включением слоя интима-медиа. Выполнялась серия из 5 измерений, за диаметр принимали наиболее часто повторяющуюся величину. Окклюзия плечевой артерии создавалась путем наложения манжетки на плечо и нагнетания давления в ней на 20 мм рт. ст. выше систолического давления в течение 5 минут. После быстрого снятия манжеты проводилась серия повторных измерений с вычислением Δd – прироста диаметра плечевой артерии в % на 1 минуте после пробы [4, 6]. Прирост диаметра артерии (Δ d, %) свыше 10% совпадал с общепринятой нормой и был принят за показатель нормального прироста диаметра. Дополнительно использовался показатель t – время восстановления просвета плечевой артерии, сек.
Обработка и анализ данных выполнялась на персональном компьютере с использованием пакета прикладных программ для статистического анализа SPSS 16.0. Вычисляли показатели описательной статистики: среднее арифметическое (М), стандартное отклонение (σ). Данные представлены в виде М ± σ.
Вариационные ряды обследовали на нормальность распределения с использованием критерия Колмогорова-Смирнова. Значимость различий средних определяли по критериям Ньюмена-Кейсла и Крускала-Уоллиса. Для оценки различий качественных критериев в сравниваемых группах применяли критерий χ2. Критический уровень значимости (р) был 0,05. Уровень значимости приводился только при значении < 0,05.
Результаты. Состояние миокарда оценивали по проведенной эхокардиографии в В- и М-режимах по стандартному протоколу. Данные показателей эхокардиографии изложены в табл. 1.
Таблица 1. Данные эхокардиографического исследования в сравниваемых группах, M ± σ
Примечания: здесь и далее * – p<0.05 между группами 1 и 2, # – p<0.05 между группами 1 и 3, & – p<0.05 между группами 2 и 3.
При анализе материала можно сделать следующие выводы:
- У пациентов с изолированной ГБ при сравнении с группой контроля имелись следующие изменения: увеличивалась толщина стенок левого желудочка при неизмененном размере его полости, увеличивалась масса миокарда левого желудочка (в том числе его индексированный показатель), объем левого предсердия и его индекс. Тип геометрической модели, таким образом, соответствует концентрической (увеличение толщины стенок при неизмененной полости) с увеличение относительной толщины стенок левого желудочка.
- Ассоциация с сахарным диабетом изменяет тип реакции сердца. При сопоставимой толщине стенок миокарда продолжают увеличиваться левое предсердие и масса миокарда левого желудочка, появляется дилатация полости левого желудочка, снижается фракция выброса, что соответствует эксцентрической геометрической модели с уменьшением ОТМС до нормальных (точнее, «псевдонормальных») цифр и снижением систолической функции.
На рис. 1 приведены структурные диаграммы распределения различных типов ремоделирования в сравниваемых группах: ГБ+СД и ГБ.
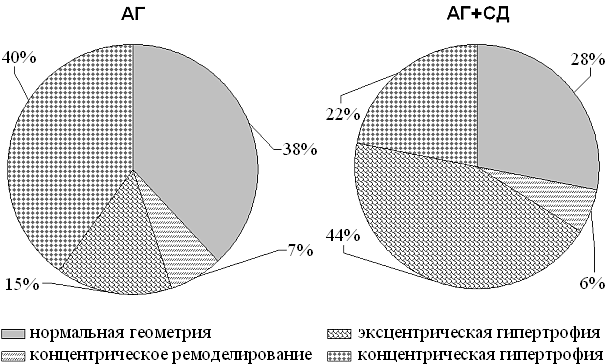
Рис. 1. Типы геометрии левого желудочка у пациентов с изолированной ГБ и в ассоциации с СД, %
Из рис. 1 видно, что в исследуемой группе ГБ частота гипертрофии левого желудочка была 55%, и основным типом ГЛЖ был концентрический. Наличие сахарного диабета увеличивает частоту ГЛЖ до 66% с увеличение доли эксцентрической ГЛЖ в три раза, с 15% до 44%. Причем этот тип геометрии у пациентов с сахарным диабетом сопровождается прогрессированием увеличения левого предсердия и снижением фракции выброса, что позволяет оценить эту трансформацию как безапелляционно неадаптивную.
Параметры толщины сосудистой стенки и эндотелийзависимой дилатации плечевой артерии представлены в табл. 2.
Таблица 2. Морфофункциональное состояние сосудистой стенки в исследуемых группах, M ± σ
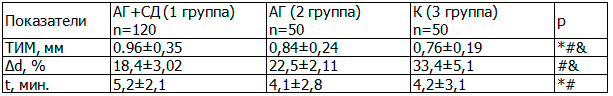
Из табл. 2 видно, что у пациентов с ГБ общей тенденцией является увеличение сосудистой стенки ТИМ и уменьшение прироста диаметра плечевой артерии при проведении пробы с реактивной гиперемией. Наличие сахарного диабета обусловливало прогрессирующее утолщение сосудистой стенки. Способность плечевой артерии к вазодилатации существенно не менялась, однако время восстановления диаметра артерии после пробы достоверно увеличивалось.
В табл. 3 представлена частота патологических сосудистых реакций в исследуемых группах. За нормативные показатели были взяты ТИМ 0,8 мм и меньше и Δd 10% и больше, что соответствует общепринятым нормам. При оценке достоверности использовался критерий χ2.
Таблица 3. Частота патологических реакций сосудистой стенки в исследуемых группах, M ± σ
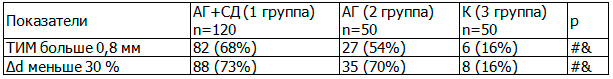
Наличие артериальной гипертензии является предикатом утолщения сосудистой стенки и нарушения ее функции, увеличивая частоту сосудистых нарушений в 3-4 раза по сравнению с группой контроля. Наличие сахарного диабета существенно не сказывается на частоте сосудистых поражений. При анализе данных, приведенных в таблицах 2 и 3 очевидно, что СД, не меняя частоты увеличения ТИМ – способствует ее большему прогрессированию, и, не меняя частоты сосудистой дисфункции – меняет ее характер, приводя к нарушению свойств артерии восстанавливать утраченный объем.
Выводы
- В случае ассоциации гипертонической болезни с сахарным диабетом 2 типа при сопоставимой толщине стенок миокарда продолжают увеличиваться левое предсердие и масса миокарда левого желудочка, появляется дилатация полости левого желудочка, снижается фракция выброса, что соответствует эксцентрической геометрической модели со снижением систолической функции.
- Сахарный диабет 2 типа, не меняя частоты увеличения ТИМ – способствует ее большему прогрессированию, и, не меняя частоты сосудистой дисфункции – меняет ее характер, способствуя прогрессирующему нарушению свойств артерии восстанавливать утраченный объем.
