Актуальность. Тромбоэмболия легочной артерии (ТЭЛА) - трудная задача для практикующих врачей на всех этапах оказания медицинской помощи, потому что характеризуется молниеносным развитием, тяжестью течения, трудностями своевременной диагностики, непоправимостью последствий, высокой летальностью и неблагоприятным прогнозом [8, 12]. При жизни диагноз ТЭЛА устанавливается в 30% случаев [2, 7]. Актуальность изучения ТЭЛА определяется рядом факторов. Во-первых, эта патология занимает третье место среди причин смерти от сердечно-сосудистых заболеваний [1, 11]. Во-вторых, отмечена высокая частота послеоперационных и посттравматических тромбоэмболий после длительных и обширных хирургических вмешательств, а также на фоне различных заболеваний, сопровождающихся ограничением двигательной активности [1, 4, 6, 9]. В-третьих, часто клиническая картина ТЭЛА ассоциируется с обострением хронического заболевания или является одним из осложнений онкопатологии, травмы, обширных хирургических вмешательств, а специфические методы диагностики осуществимы не во всех медицинских учреждениях [5, 7, 10]. Следующая задача после подозрения и диагностического поиска ТЭЛА - правильно выбрать алгоритм лечения. Максимально снизить риск смерти помогает только быстрое реагирование на ТЭЛА высокого риска, протекающее с шоком и гипотонией, и назначение тромболитической терапии (ТЛТ), часто даже еще до получения всех объективных данных, например компьютерной томографии или эхокардиографии (ЭхоКГ) [3, 14, 15,16]. Тромболизис при ТЭЛА - это единственное реальное средство значительно снизить смертность, с 70% до 8-10% [14, 15].
Целью работы явилось определение особенностей верификации ТЭЛА в условиях приемного отделения на госпитальном этапе и последующая оценка эффективности проведенного лечения у пациентов с подтвержденным диагнозом.
Материалы и методы. Ретроспективно проанализированы амбулаторные карты приемного отделения и истории болезни кардиологического отделения 122 пациентов, поступавших в Ивановскую областную клиническую больницу (ОКБ) за 2015 год с подозрением на ТЭЛА. Следует отметить, что в это лечебное учреждение направляются больные со всей области и районов города для исключения данной патологии. Были сформированы 2 группы сравнения: I группа - 52 (42,6%) пациента с верифицированным диагнозом ТЭЛА (средний возраст 59,6±2,38 лет, 30 мужчин и 22 женщины), II группа - 70 (57,4%) пациентов, у которых ТЭЛА не подтвердилась (средний возраст 63,4±1,62 лет, 33 мужчины и 37 женщин). Клиническая вероятность ТЭЛА рассчитывалась ретроспективно по шкале Geneva на основании записей в амбулаторных картах и анамнестических данных в историях болезни, оценка риска летального исхода производилась аналогично по шкале Pesi [5]. Оба теста стандартизованы и достаточно хорошо валидизированы [5, 13]. Пациентам с целью уточнения диагноза выполнялись электрокардиография (ЭКГ), ЭхоКГ, мультиспиральная компьютерная томография легких с контрастированием легочной артерии (МСКТ), определение Д-димера, ультразвуковое исследование сосудов нижних конечностей (УЗДГ), рентгенография органов грудной клетки (Rg легких).
Статистическая обработка полученных результатов проводилась в пакете прикладных программ «Statistica v.8.0 for Windows». При сравнении признаков с нормальным распределением использовался двусторонний t-критерий Стьюдента для зависимых и независимых групп. В противном случае для оценки различий между группами применяли непараметрический тест Манна-Уитни. Анализ статистической значимости различий между долями проводился с помощью критерия χ2. За уровень статистической значимости принимали р<0,05. При распределении близком к нормальному показатели представлены в виде средней арифметической вариационного ряда и её стандартного ошибки (M ± m). При необходимости сравнения показателей в подгруппах данные представляли в виде средней арифметической вариационного ряда и её стандартного отклонения (M±σ).
Результаты и обсуждение. На анализ было представлено 122 медицинских документа (52 истории болезни и 70 амбулаторных карт приемного отделения). Рисунок 1 демонстрирует, что пациенты из I группы поступали, в основном, по скорой медицинской помощи (СМП) - 53,8% (28 человек), из II группы - по направлению участкового терапевта - 63% (44 человека). Среднее время поступления в стационар от начала болезни составило 4,3±2,1 дня и 7,2±1,3 дней в I группе и II группе соответственно, р<0,05.
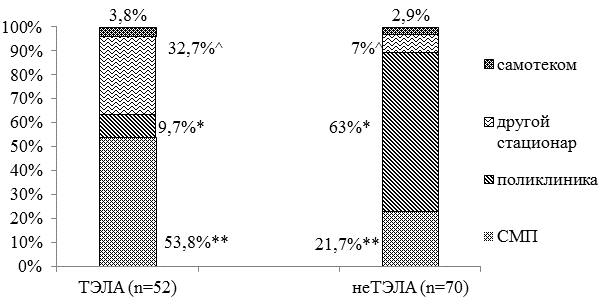
Рис. 1. Пути поступления пациентов в приемное отделение ОКБ: * - различия статистически значимы (р<0,01), ** - различия статистически значимы (р<0,03), ^ - различия статистически значимы (р<0,05), р - критерий χ2, СМП - скорая медицинская помощь.
Клиническая симптоматика больных I и II групп была чрезвычайно разнообразна, мало специфична, схожа между собой и достоверно не различалась в группах наблюдения. Основными жалобами у пациентов как в I, так и во II группе являлись одышка, тахикардия, слабость, боль в нижних конечностях, боль в области грудной клетки, отёки нижних конечностей, кровохарканье.
Оценив результаты проведенного обследования и сопоставив их с клиникой, можно было говорить о наличии у больных во II группе патологии, схожей по проявлениям и требующей дифференциальной диагностики с ТЭЛА (рис. 2). Лидирующую позицию занимали проявления декомпенсированной хронической сердечной недостаточности (ХСН), развивающейся на фоне постоянной формы фибрилляции предсердий, ишемической болезни сердца в виде постинфарктного кардиосклероза и хронической аневризмы левого желудочка, тяжелой гипертонической болезни. Второе место у патологии бронхо-легочной системы в виде обострений хронической обструктивной болезни легких (ХОБЛ), бронхиальной астмы и внебольничной пневмонии, протекающих с явлениями выраженной дыхательной недостаточности (ДН).
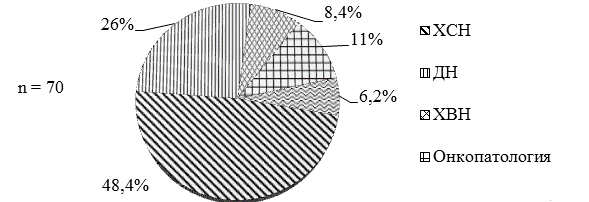
Рис. 2. Патология, требующая исключения ТЭЛА, во II группе пациентов (n=70): ХСН - хроническая сердечная недостаточность, ХВН - хроническая венозная недостаточность, ДН - дыхательная недостаточность.
У 5 пациентов, направленных в стационар, в анамнезе уже был эпизод ТЭЛА. Следует отметить, что основная масса больных в II группе страдала избыточной массой тела (23%) и ожирением различной степени выраженности (52%), что сказывалось на клинической картине заболевания, способствуя усугублению одышки, и осложняло дифференциальную диагностику врачу при первичном осмотре. В I группе ожирение выявлено у 40% больных.
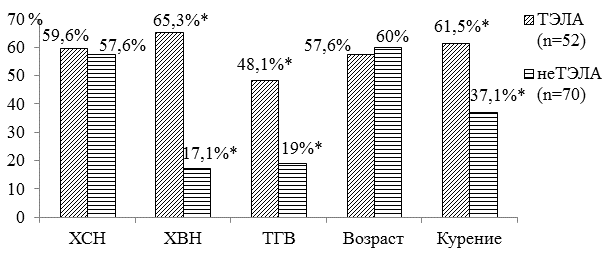
Рис. 3. Факторы риска ТЭЛА в группах наблюдения: * - различия статистически значимы в группах наблюдения по сравниваемым факторам риска (р<0,05), р - критерий χ2, ХСН - хроническая сердечная недостаточность, ХВН - хроническая венозная недостаточность, ТГВ - тромбоз глубоких вен.
Ведущими факторами риска ТЭЛА у пациентов I группы определены хроническая венозная недостаточность (ХВН) у 34 (65,3%) пациентов, ХСН - у 31 (59,6%), тромбоз глубоких вен в анамнезе (ТГВ) - у 25 (48,1%), пожилой и старческий возраст - у 30 (57,6%), курение - у 32 (61,5%) пациентов соответственно. Во II группе преобладали такие факторы риска ТЭЛА, как ХСН - у 40 (57,1%) пациентов, пожилой и старческий возраст - у 42 (60%), курение - у 26 (37,1%), ХВН - у 12 (17,1%) пациентов соответственно (рис. 3).
Хотя специфичность и чувствительность отдельных симптомов и данных физикального обследования при ТЭЛА не высоки, оценка их в совокупности позволяет ещё до выполнения анализов и инструментальных обследований разделить больных на категории клинической вероятности ТЭЛА. В ряде крупных исследований показано, что разделение больных с подозрением на ТЭЛА по уровням клинической вероятности диагноза оправдано соответствующей частотой подтверждения (при низкой клиничесокй вероятности - 9%, при промежуточной - 30%, при высокой вероятности - 68%) [5]. Определение клинической вероятности ТЭЛА наряду со стратификацией риска лежит в основе выбора диагностического алгоритма и комплексной оценки результатов диагностических процедур.
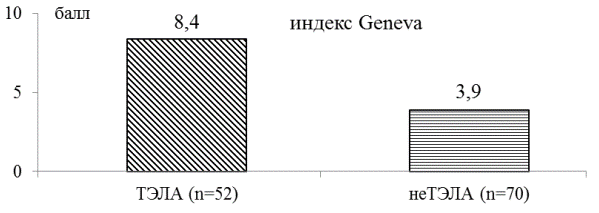
Рис. 4. Клиническая вероятность ТЭЛА по индексу Geneva в группах наблюдения: различия достоверны в группах наблюдения (р<0,05), р - t-критерий Стьюдента.
Как видно на рис. 4, вероятность наличия ТЭЛА по клиническим данным ретроспективно оценивалась по индексу Geneva, который в I группе составил 8,4±0,45 балла (ТЭЛА вероятна), во II группе - 3,9±0,29 балла (ТЭЛА маловероятна), р<0,05.
Достоверные различия по Женевскому тесту в группах сравнения позволили подтвердить целесообразность использования его в качестве способа оценки вероятности ТЭЛА на этапе клинической диагностики в реальной врачебной практике на догоспитальном этапе и ограничить круг пациентов для дальнейшего обследования.
Основная масса пациентов направлялась в приемное отделение ОКБ на основании клинического осмотра врача СМП, поликлиники или другого стационара. Следует отметить, что всем пациентам, поступавшим по СМП, была выполнена ЭКГ, позволившая в совокупности с клиническими симптомами врачу бригады предположить вероятность ТЭЛА. Менее 15% пациентов выполнялся ряд обследований на этапе другого стационара, который включал, как правило, Rg легких в 9 случаях, определение D-димера и ЭхоКГ в 16 случаях. Хотелось бы подчеркнуть, что тестирование на D-димер делают в области только 2 лечебно-профилактических учреждения (ЛПУ), хотя оно является основным скрининговым методом для исключения ТЭЛА на этапе первичной верификации диагноза, не является дорогостоящим, длительным и трудоемким. Отсутствие данного теста в арсенале всех ЛПУ при широкой распространенности ТЭЛА и необходимости ее исключать затрудняет работу врачей, вызывая повышенные затраты на расходы и производительность единичных стационаров области.
Всем 122 больным в приемном отделении проводилось исследование на D-димер: у 76 (62,3%) выявлен положительный результат, у 46 (37,7%) - отрицательный. Среди пациентов с положительным D-димером при дальнейшем обследовании на МСКТ диагноз ТЭЛА не подтвердился у 26, практически у каждого третьего. Это доказывает отсутствие строгой специфичности у данного теста, однако и не отрицает возможности его использования на этапе первичной диагностики.
Всем больным выполнялась регистрация ЭКГ, при которой у 34 пациентов (65,3%) I группы и у 15 пациентов (20,8%) II группы были выявлены ЭКГ-признаки, часто встречающиеся при ТЭЛА: впервые возникшая полная/неполная блокада правой ножки пучка Гиса, признаки перегрузки правых отделов сердца, S1Q3.
МСКТ выполнена 68 (55,7%) пациентам в первый час после поступления в ОКБ, что позволило подтвердить у 44 (36,1%) больных ТЭЛА, в 8 (6,5%) случаях осложненную инфаркт-пневмонией при нормальном заключении Rg легких. У 25 (20,5%) человек по результатам томографии выявлена двусторонняя картина поражения легочной артерии, с преимущественной локализацией тромба в главных и сегментарных ветвях, что лишний раз заставляет задуматься о серьезности риска и высокой вероятности летального исхода при данной патологии. За 2015г вентиляционно-перфузионная сцинтиграфия легких использовалась для подтверждения ТЭЛА в 2 случаях: в виду невозможности проведения МСКТ по техническим причинам. Как показал анализ историй болезни, ВПС при наличии томографии не проводилась пациентам в виду высокой информативности и доказательной базы МСКТ.
ЭхоКГ при поступлении выполнена у 64,7% больных, что позволило выявить легочную гипертензию различной степени выраженности у 48,2% обследованных. Показатели систолического давления в легочной артерии (СДЛА) достоверно не различались в группах наблюдения (48,8±1,8 мм рт ст vs 46,9±3,4 мм рт ст). По данным Rg легких в сравниваемых группах значимых для верификации диагноза признаков не выявлено. У 19 (36,5%) пациентов течение ТЭЛА осложнилось развитием инфаркт-пневмонии, в 8 (15,3%) случаях по данным МСКТ двусторонней локализацией. Средние значения сатурации кислорода у больных с ТЭЛА составили 88,2±3,2% при поступлении.
У 62,3% (76 человек) направленных с подозрением на ТЭЛА выполнено УЗДГ сосудов нижних конечностей, в том числе у 19,7% (24 человека) с неподтвержденным диагнозом. В 2 (2,7%) случаях у пациентов II группы выявлен острый тромбофлебит нижних конечностей, у 12 (16,7%) больных по данным исследования отмечены явления ХВН на фоне посттромботической болезни нижних конечностей. У 39 (75%) человек из 52 в I группе по УЗДГ выявлен острый тромбоз глубоких вен нижних конечностей, у 6 (11,5%) - илеофеморальный тромбоз, у 18 (34,6%) - с признаками флотации тромба в просвете вены. Все пациенты с ТЭЛА консультированы ангиохирургом.
Данные, получаемые в процессе клинического обследования, и результаты простых лабораторных анализов также могут использоваться для оценки прогноза. Многие из них связаны с фоновыми и сопутствующими заболеваниями. Так, согласно регистру ICOPER к неблагоприятным прогностическим факторам относятся онкологические заболевания, ХСН, ХОБЛ и возраст старше 70 лет [5, 10]. Имеющиеся до эмболии заболевания сердца и лёгких ассоциированы с 4-7 кратным увеличением смертности от ТЭЛА. Ретроспективное определение прогноза заболевания по основной шкале индекса Pesi, показало, что у больных ТЭЛА риск 30-дневного смертельного исхода был умеренным, а у пациентов II группы - низким (p<0,05).
Основные принципы лечения больных с верифицированной ТЭЛА соответствовали клиническим рекомендациям [5]. По тяжести состояния основная масса пациентов была госпитализирована в палату интенсивной терапии (ПИТ), где находилась под наблюдением до стабилизации гемодинамики и показателей сатурации кислорода. Средние сроки пребывания в ПИТ составили 2,3±1,2 дня. С первого дня в стационаре пациенты получали низкомолекулярные гепарины (эноксапарин, фраксипарин) в стандартных терапевтических дозировках. Параллельно проводился подбор дозы варфарина с учетом достижения целевого значения МНО. При поступлении уровень МНО пациентов I группы составил 1,3±0,08, при выписке - 2,3±0,1. Средние сроки достижения целевого уровня МНО составили 5-6 дней на дозе варфарина 7,5-10 мг в сутки. У 10 пациентов использовался ривароксабан в дозе 15 мг 2 раза в день в течение первых трех недель.
11 (21,2%) пациентам с массивной двусторонней ТЭЛА с явлениями гипотонии в 6 случаях проведён ТЛТ алтеплазой в дозе 100 мг в условиях ПИТ под мониторным контролем основных параметров гемодинамики и дыхания. Средние сроки от начала болезни до проведения ТЛТ составили 4,6±1,2 дня. У 81,8% (9 человек) через 12 часов от ТЛТ отмечена положительная клиническая динамика: регресс острой дыхательной недостаточности (снижение тахипноэ, улучшение оксигенации крови) и гемодинамических расстройств (стабилизация системного артериального давления, снижение тахикардии, купирование нарушений ритма и проводимости миокарда).
Для оценки показателей легочной гипертензии и размеров правых полостей сердца (таблица 1) пациентов с ТЭЛА разделили на 2 подгруппы: 1 подгруппа - 11 человек после ТЛТ, 2 подгруппа - 41 человек, получавших только стандартную антикоагулянтную терапию. Статистически значимых различий по полу, возрасту и причинам возникновения ТЭЛА в подгруппах не было. СДЛА при поступлении, по данным ЭхоКГ, было достоверно выше во 2 подгруппе (58,18±1,29 мм рт ст), чем в 1 подгруппе (46,83±1,41 мм рт ст). К моменту выписки из стационара этот показатель снизился у пациентов с ТЛТ в среднем на 18,4±2,19 мм рт ст, у больных без ТЛТ - на 8,3±1,74 мм рт ст (р<0,05). Нормальные значения СДЛА при выписке наблюдались у 66,7% больных ТЭЛА после ТЛТ и у 24,3% пациентов, получавших только гепаринотерапию (р<0,05).
Размеры правого желудочка (ПЖ) достоверно не различались в 1 и 2 подгруппах при поступлении и составили 46,1±6,8 мм и 43,6±4,9 мм соответственно. Однако после проведенного ТЛТ по данным ЭхоКГ в динамике в 1 подгруппе наблюдалось достоверное уменьшение дилатации ПЖ (46,13±1,81 мм vs 34,25±1,12 мм, р<0,05), тогда как данный показатель во 2 подгруппе значимо не изменился (43,64±1,92 мм vs 41,64±1,34 мм). Геморрагических осложнений среди пациентов с ТЛТ не отмечено. Проведение ТЛТ при ТЭЛА в 2,2 раза эффективнее снижало давление в легочной артерии и позволяло достичь его нормального значения у большего числа пациентов, способствовало уменьшению размеров полости ПЖ, а, следовательно, уменьшало вероятность формирования хронической постэмболической легочной гипертензии, чем терапия только антикоагулянтами.
На фоне проводимой антикоагулянтной терапии отмечено развитие осложнений только у 1 пациента в виде кровотечения из наложенной цистостомы, установленной по поводу задержки мочи при доброкачественной гиперплазии предстательной железы, что потребовало прекратить лечение антикоагулянтами.
Таблица 1. Динамика показателей легочной гипертензии и размеров правых полостей сердца у пациентов с ТЭЛА до и после лечения, M±m
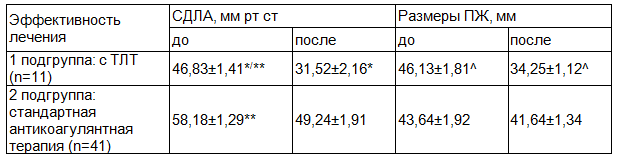
Примечание: * - разница достоверна между показателями размеров ПЖ до и после лечения в 1 подгруппе (р<0,01), ^ - разница достоверна между показателями размеров ПЖ до и после лечения в 1 подгруппе (р<0,01), ** - разница достоверна между показателями СДЛА до лечения в 1 и 2 подгруппах (р <0,05), р - U-критерий Манна-Уитни, СДЛА - систолическое давление в легочной артерии, ПЖ - правый желудочек.
Медикаментозная терапия больных I группы также включала венотоники, антибиотики, ингибиторы ангиотензинпревращающего фермента/блокаторы рецепторов к ангиотензину, диуретики, блокаторы кальциевых каналов. Пациентам с низкой сатурацией кислорода и явлениями дыхательной недостаточности оказывалась кислородная поддержка.
У всех пациентов на момент выписки отмечалась положительная динамика в виде отсутствия выраженной дыхательной и сердечной недостаточности, снижения степени легочной гипертензии и размеров правых полостей сердца по ЭхоКГ, реканализации флеботромбоза нижних конечностей по данным УЗДГ. За анализируемый период смертность от ТЭЛА составила 13,5% (7 человек), совпадение клинического и патологоанатомического диагнозов по основному заболеванию отмечено в 100% случаев (таблица 2).
Таблица 2. Летальность при ТЭЛА за 2015 г. в ОКБ
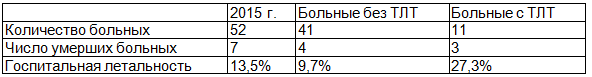
Примечание: ТЛТ - тромболитическая терапия.
Увеличение летальности пациентов с ТЭЛА в группе с ТЛТ не связана с развитием геморрагических осложнений и объясняется массивностью поражения, тяжелой сопутствующей патологией и протеканием с выраженными явлениями сердечно-легочной недостаточности. Средний срок летального исхода наступал на 6,0±1,9 сутки от пребывания в стационаре.
