Введение. Сердечно-сосудистые заболевания (ССЗ) являются основной причиной смертности среди населения трудоспособного возраста. Пациенты с ишемической болезнью сердца (ИБС) образуют группу высокого риска развития осложнений и смерти. Одним из перспективных методов лечения ИБС является проведение ЧКВ со стентированием КА, которое значительно улучшает кровоснабжение миокарда [2, 3, 5].
Проведение стентирования КА требует в дальнейшем назначения двойной антиагрегантной терапии, но, к сожалению, несмотря на её применение, примерно у 1,5 - 3,2% пациентов развивается тромбоз стента, который может привести к инфаркту миокарда (ИМ) и летальному исходу. Частота рецидива тромбоза стента составляет около 16-19%. [4, 6, 8, 9, 14].
Из многочисленных, преимущественно небольших исследований известно, что преждевременная отмена антиагрегантных препаратов, неполное раскрытие стента, множественное стентирование, использование стентов с лекарственным покрытием и некоторые другие факторы предрасполагают к тромбозу стента [5, 9, 14]. В последнее время большое внимание исследователей уделяется проблеме гиперкоагуляции [2, 6, 7].
Известно, что нарушения тромбообразования могут быть обусловлены наличием полиморфизмов генов гемостаза [7, 10, 12]. На сегодняшний день интенсивно изучаются генетические факторы риска развития тромбоза стента КА, включая выявление ассоциаций генов-кандидатов с риском развития заболевания [11, 13].
Всего известно более 500 генов-кандидатов, мутации в которых могут создавать предрасположенность к тромбозам [1, 2, 10, 11, 13]. Значительное влияние на гемостаз оказывают мутации в генах свертывающей системы крови FGB, PAI-1, ITGA2, GPIIIa, связанные с известными генетическими маркерами FGB G-455A, PAI-1 5G -675 4G, ITGA2 C807T, GPIIIa Т1565C.
Цель исследования: изучение генетических полиморфизмов G(-455)A (rs1800790) гена FGB, -675 5G/4G (rs1799768) гена PAI-1, C807T (rs1126643) гена ITGA2, T1565C (rs5918) гена GPIIIa, ассоциированных с повышенным риском тромбообразования, у пациентов, подвергшихся ЧКВ со стентированием КА.
Материалы и методы. Под нашим наблюдением в течение года находились 26 пациентов в возрасте от 39 до 70 лет, которым было проведено ЧКВ со стентированием КА. Все пациенты были стентированы в связи с клиникой стенокардии напряжения III-IV ФК, которая сохранялась, несмотря на оптимальную медикаментозную терапию (нитраты, бета-блокаторы, антагонисты кальция и препараты второй линии антиишемического действия).
Пациенты были разделены на 2 группы: I группа (6 пациентов, средний возраст 54±6,8) с развившимся тромбозом стента в течение года; II группа (20 пациентов, средний возраст 57±6,4) без развития тромбоза стента в период наблюдения. В контрольную группу включены 20 здоровых лиц. Пациентам были проведены клинические исследования (общий анализ крови и биохимическое исследование крови, ЭКГ, суточное мониторирование ЭКГ, ЭХО-КС, коронароангиография), а также проведено исследование полиморфизмов некоторых генов гемостаза (G(-455)A (rs1800790) гена FGB, -675 5G/4G (rs1799768) гена PAI-1, C807T (rs1126643) гена ITGA2, T1565C (rs5918) гена GPIIIa).
Выделение ДНК и изучение полиморфизмов генов проводили методом полимеразной цепной реакции в реальном времени с использованием тест-систем производства ЗАО «Синтол» (Россия) на приборе CFX96 Touch (США). Для каждого из изучаемых ДНК-маркеров проводили оценку соответствия распределения генотипов ожидаемым значениям при равновесии Харди-Вайнберга. Для сравнения распределений частот аллелей и генотипов в выборках больных и здоровых использовали критерий χ2 . Силу ассоциаций оценивали с помощью показателя отношения шансов Odds Ratio (OR) и указанием 95% доверительного интервала (ДИ).
Результаты и обсуждение
Полиморфизм G-455A в гене фибриногена находится в регуляторной области гена и приводит к повышению его экспрессии, что приводит к увеличению содержания фибриногена в крови и повышает вероятность образования тромбов, повышая риск тромбоза у носителей генотипов G/A и тем более генотипа A/A.
При анализе распределения частот аллелей и генотипов между пациентами I и контрольной групп выявлена ассоциация аллеля А, связанная с высоким риском развития тромбоза стента (OR=2,83, 95% CI=0,64-12,46). В группе с тромбозом стента аллель А встречается значительно чаще (0,333), чем в контрольной группе (0,150), однако эти различия не являются статистически значимыми (Х2 =2, p=0,16) (рис.1).
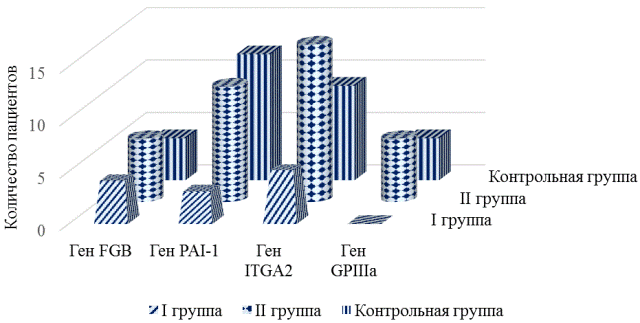
Рис. 1. Частота встречаемости генотипов исследуемых генов в гетерозиготном варианте в группах.
Уровень гетерозигот в выборке I в 3 раза превышает частоту встречаемости генотипа G/A в контрольной группе (0,667 против 0,200). При этом выявлен повышенный риск образования тромбоза стента у больных при наличии генотипа G/A гена FGB (OR=8,00, 95% CI=1,06-60,33). Частота встречаемости аллеля А, связанного с высоким риском развития тромбоза стента в группе без тромбоза стента составила - 0,200 против 0,150 в контрольной группе (OR=1,42, 95% CI=0,44-4,53). Частота встречаемости генотипа G/A, характеризующегося умеренно повышенной концентрацией фибриногена во II группе составила 0,300, в группе контроля - 0,200 (OR=1,71, 95% CI=0,40-7,34).
Полиморфизм 5G(-675)4G в гене SERPINE1(PAI-1). Маркёр связан с изменением эффективности активации плазминогена, подавлением процесса фибринолиза. Полиморфизм гена проявляется в изменении количества повторов гуанина (G) в промоторной (регуляторной) области гена.
При анализе распределения частот аллелей и генотипов между пациентами I и контрольной групп выявлена ассоциация аллеля 4G, связанного с высоким риском развития тромбоза стента (OR=2,45, 95% CI= 0,58-10,44). Частота аллеля 4G гена PAI-1 составила - 0,750 у пациентов с тромбозом стента; в контрольной группе - 0,550. При сравнении частот аллелей и генотипов пациентов без тромбоза стента и контрольной групп было выявлено, что частота встречаемости патологического аллеля 4G составила 0,625 против 0,550 (OR=1,36, 95% CI=0,56-3,33). Генотип 5G/4G встречался чаще в контрольной группе (0,600), во II группе-0,550 (OR=0,81, 95% CI=0,23-2,86). Частота встречаемости генотипа 4G/4G, связанного с высоким риском развития тромбоза стента, во II группе составила 0,350 против 0,250 в контрольной группе (OR=1,62, 95% CI=0,41-6,34).
Полиморфизм С807Т в гене ITGA2. Ген ITGA2 кодирует белок-альфа-2-мембранный гликопротеин, известный как GPIa, экспрессирующийся на мембранах различных клеток. Полиморфизм С807Т представляет собой нуклеотидную замену цитозина (С) на тимин (Т) в позиции 807. Генетический маркер С807Т, связан с изменением свойств коллагенсвязывающих рецепторов тромбоцитов. Наиболее высокая ассоциация аллеля Т, связанного с наибольшим риском развития тромбоза, выявлена среди пациентов I группы (OR=2,33, 95% CI=0,63-8,68). Частота аллеля Т составила 0,583 у пациентов I группы против 0,375 в группе контроля.
При анализе распределения частот генотипов между пациентами I и контрольной групп выявлено, что генотип С/С, отвечающий за нормальную скорость адгезии тромбоцитов, не был выявлен ни в одном случае у пациентов группы с тромбозами стентов, а в группе контроля его частота составила 0,400 (OR=0,11, 95% CI=0,01-2,28).
Частота генотипа С/Т, свидетельствующего о повышенной скорости адгезии тромбоцитов, среди пациентов I группы составила 0,833 против 0,450 группы контроля (OR=6,11, 95% CI=0,60-62,23), что свидетельствует о возможном неблагоприятном влиянии этого генотипа на скорость адгезии тромбоцитов (рис. 2).
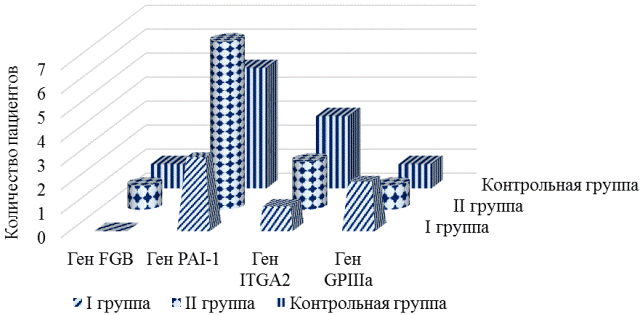
Рис.2. Частота встречаемости генотипов исследуемых генов в гомозиготном варианте в группах.
В ходе проведенных исследований выявлена ассоциация аллеля Т, связанного с риском развития тромбоза у пациентов II группы (OR=1,51, 95% CI=0,62-3,68). Кроме того, интересным представляется то обстоятельство, что частота распространения генотипа С/Т составила 0,750 во II группе против 0,450 в группе здоровых лиц (OR=3,67, 95% CI=0,96-14,03), что свидетельствует о наличии повышенного риска тромбообразования у пациентов II группы (несмотря на отсутствие клинических данных о тромбозе стента) по сравнению с лицами без ИБС.
Полиморфизм Т1565С в гене GPIIIa. Интегрин бета - 3 (бета - субъединица рецептора фибриногена тромбоцитов). Маркёр связан с изменением свойств рецептора фибриногена и изменением агрегации тромбоцитов. Генетический маркёр Т1565С: участок ДНК гена, где происходит замена тимина (Т) на цитозин (С) в позиции 1565. При анализе распределения частот аллелей и генотипов между пациентами с тромбозом стента и контрольной групп выявлена ассоциация аллеля C, повышающего риск развития тромбоза стента.
Частота аллеля С гена GPIIIa составила-0,333 у пациентов с тромбозом стента; против 0,150 в контрольной группе (OR=2,83 95% CI= 0,64-12,46). Неблагоприятная ассоциация генотипа С/С, увеличивающего риск развития тромбоза, была выявлена у пациентов I группы. Частота данного генотипа составила - 0,333, в группе контроля-0,050 (OR=9,50 95% CI= 0,68-132,00). При сравнении частот аллелей и генотипов пациентов II и контрольной групп показано, что статистически значимых различий не выявлено.
Следует отметить, что, несмотря на то, что у большинства обследуемых пациентов в течение года не развились тромбозы стентов КА, все они имели полиморфизмы генов гемостаза, повышающие вероятность тромбообразования. Более того, у 92% больных имелись неблагоприятные сочетания полиморфизмов нескольких генов гемостаза. Так у 9 пациентов (34,5%) имелись полиморфизмы двух генов (чаще ITGA2 и PAI-1; ITGA2 и FGB), у 14 пациентов (53,6%) встречались полиморфизмы трех генов (сочетания ITGA2, PAI-1 и FGB).
В нашем исследовании представлен клинический случай наличия у одного пациента полиморфизмов всех четырех исследуемых генов (FGB, PAI-1, ITGA2, GPIIIa), причем все генотипы полиморфных маркеров были ассоциированы с высоким и очень высоким риском тромбообразования (C807T (rs1126643) гена ITGA2 и -675 5G/4G (rs1799768) гена PAI-1-в гомозиготном варианте, T1565C (rs5918) гена GPIIIa, G(-455)A (rs1800790) гена FGB - в гетерозиготном варианте).
После ангиопластики передней межжелудочковой ветви левой КА, которая прошла без осложнений и полном открытии стента «XTRM blue» (TIMI III), на 10 сутки пациент пережил эпизод тромбоза стента несмотря на проводимую двойную антиагрегантную терапию (ацетилсалициловая кислота 100 мг/ сут и клопидогрель 75 мг /сут).
Таким образом, проведенные исследования свидетельствуют о том, что у всех обследуемых пациентов с критическими стенозами КА, которым применялось ЧКВ с установкой стентов, имелись полиморфизмы генов системы гемостаза, сопряженные с повышенным риском тромбообразования. Для уточнения характера взаимодействия данных полиморфизмов необходимо проведение дополнительных исследований, в том числе анализа межгенных взаимодействий, а также изучение влияния ассоциаций генов - кандидатов и других факторов на риск развития тромбозов коронарных стентов.
