Широкое распространение диагностических и лечебных процедур с использованием рентгеноконтрастных препаратов (РКП) в кардиологии привело к появлению нового осложнения, угрожающего жизни и здоровью пациентов [4]. Это осложнение, ассоциированное с введением в организм больших доз РКП, получило название контраст-индуцированной нефропатии (КИН) [8]. Клинически значимые повреждения определяются при фиксировании уровня креатинина сыворотки более чем на 25% или на 44 мкмоль/л (0,5 мг/дл) от базового уровня в течение 48 часов после проведения процедуры в отсутствии других альтернативных причин [5]. При проведении коронароангиографии (КАГ) у пациентов с факторами риска КИН регистрируется в 10-50% случаев [6]. Развитие КИН ведет к увеличению частоты почечной недостаточности с необходимостью в кратковременном или продолжительном курсе гемодиализа, увеличению сроков госпитализации, повышению госпитальной летальности, а также смертности в отдаленном периоде [9]. Актуальным является более строгое предварительное обследование больных стабильной ишемической болезнью сердца (ИБС) перед плановым чрескожным коронарным вмешательством (ЧКВ) с целью профилактики КИН. Такого преимущества у пациентов с ОКС, как правило, нет, что исходно делает их более уязвимыми для этого осложнения, поэтому требует более жесткого контроля за почечной функцией после оперативного вмешательства.
Целью работы явилось проведение ретроспективного сравнительного анализа факторов риска, частоты развития КИН и проводимых профилактических вмешательств при ЧКВ у больных стабильной ИБС и ОКС в клинике, использующей интервенционные методы реваскуляризации миокарда.
Материалы и методы. Проведен ретроспективный анализ 50 историй болезни пациентов с ИБС, проходивших стационарное лечение в кардиологическом отделении сосудистого центра Ивановской областной клинической больницы в 2018 г., с выделением 2 групп сравнения. В I группу вошли 25 больных, которым выполнялось ЧКВ в экстренном порядке по поводу ОКС (16 мужчин и 9 женщин, средний возраст 65,3±1,6 лет). II группу составили 25 пациентов со стабильной стенокардией, госпитализированных для планового ЧКВ (17 мужчин и 8 женщин, средний возраст 63,6±1,7 лет). Риск развития КИН в группах сравнения оценивали в соответствии со шкалой R. Mehran [7]. В качестве факторов риска согласно этой шкале учитываются гипотензия, использование внутриаортальной баллонной контрпульсации (ВАБК), хроническая сердечная недостаточность (ХСН), возраст старше 75 лет, наличие анемии, сахарного диабета (СД), объем вводимого РКП и уровень креатинина или скорость клубочковой фильтрации (СКФ). Подсчитывается суммарное количество баллов, которое определяет степень риска КИН. Уровень креатинина плазмы и СКФ по формуле CKD-EPI определяли до и через 48 часов после вмешательства. КИН диагностировали при повышении уровня креатинина сыворотки крови более чем на 25% или на 44 мкмоль/л от исходного уровня в течение 48 часов после введения РКП.
Статистическая обработка данных проводилась при помощи программы Statistica 7.0. Для оценки статистической значимости различия показателей, имеющих непрерывные значения, использовали параметрический t-критерий Стьюдента (различия считались статистически значимыми при p<0,05). Анализ статистической значимости различий между долями проводился с помощью критерия χ2. При распределении близком к нормальному показатели представлены в виде средней арифметической вариационного ряда и её стандартного ошибки (M±m). При необходимости сравнения показателей в подгруппах данные представляли в виде средней арифметической вариационного ряда и её стандартного отклонения (M±σ).
Результаты. В ходе анализа выявлено, что в обеих группах сравнения достоверно больше было мужчин, чем женщин (рис. 1). Значимых различий по полу между группами не получено.

Рис. 1. Распределение по полу в сравниваемых группах: * - различия статистически значимы между мужчинами и женщинами (р<0,05), р - критерий χ2.
Как видно из табл. 1, больные в возрасте старше 75 лет в I группе составили 24%, что было значимо больше, чем во II группе - 8% (р<0,05). СД наблюдался в 44% случаев среди пациентов с экстренным ЧКВ и в 28% - с плановым ЧКВ, хроническая болезнь почек (ХБП) второй и выше стадии установлена у 32% и 12% пациентов в группах соответственно (р<0,05). Примерно с одинаковой частотой у больных в сравниваемых группах встречались артериальная гипертензия (АГ) и ХСН, а вот перенесенный инфаркт миокарда в анамнезе имели большинство пациентов с экстренным ЧКВ. Исходный уровень креатинина был выше у больных I группы (116,6±11,1 vs 84,8±6,27 мкмоль/л соответственно, р<0,05).
Таблица 1. Сопоставление групп сравнения по основным демографическим и клиническим показателям
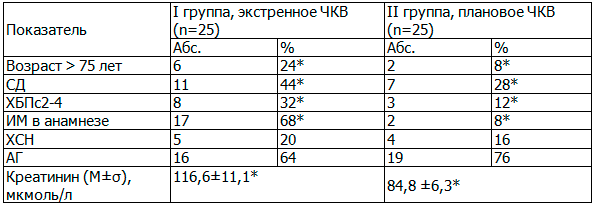
Примечание: ИМ - инфаркт миокарда, здесь и далее * - различия статистически значимы между группами (р<0,05), р - критерий χ2.
У 56% пациентов I группы течение ОКС осложнилось развитием острой левожелудочковой недостаточности, в том числе отеком легких и кардиогенным шоком в 8 (32%) и 6 (24%) случаях соответственно, 3 (12%) больным потребовалась установка ВАБК перед началом ЧКВ. У 4 (16%) пациентов II группы оперативное вмешательство сопровождалось нестабильной гемодинамикой, что требовало кардиотонической поддержки дофамином в послеоперационном периоде.
Таким образом, в соответствии со шкалой R. Mehran высокий риск развития КИН значимо чаще встречался у пациентов с экстренным ЧКВ, чем у плановых больных (28 и 12% соответственно, р<0,05). Умеренный риск отмечен в 32% случаев в I группе и 24% - во II группе, низкий риск - у 40 и 64% пациентов соответственно (рис. 2).
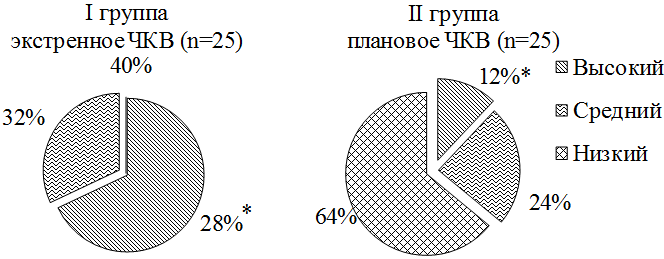
Рис. 2. Риск развития КИН по R. Mehran.
Хотелось бы акцентировать внимание, что на возникновение КИН влияет вид РКП. В настоящее время существует три поколения препаратов. В широкой клинической практике применяют РКП второго поколения, обладающие меньшим количеством побочных реакций и меньшей острой токсичностью, например, йогексол. Данные препараты в настоящее время рекомендуется использовать пациентам с низким и средним риском развития КИН. Для пациентов с высоким риском рекомендовано использовать РКП третьего поколения, типичным представителем которого является йодиксанол. Данный препарат вызывает меньший осмотический диурез, натрийурез и, соответственно, меньшее снижение эффективного внутрисосудистого объема. Его использование не вызывает падение гемодинамики, не провоцирует нарушения ритма сердца и редко сопровождается аллергическими реакциями. При сравнении йодиксанола с низкоосмолярными РКП у лиц с нормальной функцией почек отсутствовали различия в частоте нефропатии [1]. У пациентов из группы риска (почечная недостаточность в сочетании с СД и без СД) при введении йодиксанола вероятность развития нефропатии была в 11 раз ниже, а частота серьезных сердечно-сосудистых осложнений - на 45% меньше без дополнительных профилактических мер [2].
Риск развития КИН определяется также и объемом вводимого РКП, расчет которого производится по формуле: 5 мл×[вес тела (кг)/Сr сыворотки (mg/dl)], где Сr - креатинин сыворотки (mg/dl), mg/dl=мкмоль/л×0,0113. По данным некоторых исследований при использовании данной формулы КИН развивалась лишь в 2% случаев, а при бесконтрольном введении РКП у 26% больных [3].
В нашем исследовании (рис. 3) у пациентов в I группе использовался достоверно больший средний объем РКП, чем во II группе (238,5 ±11,9 vs 143,3±8,2 мл соответственно, р<0,05). Это можно объяснить тем, что при экстренном ЧКВ хирург одновременно делает КАГ всего коронарного русла, а затем оперативное вмешательство на симптом-связанной артерии, поэтому ему требуется несколько больше контрастного вещества. При плановом ЧКВ анатомия коронарного русла уже известна, так как КАГ проведена во время предшествующей госпитализации, поэтому выполняется только оперативное вмешательство и соответственно расход РКП меньше.

Рис. 3. Объем используемого РКП при ЧКВ в группах сравнения.
Хотелось бы подчеркнуть, что всем больным с высоким риском КИН при плановом ЧКВ использовался контраст третьего поколения «Визипак», тогда как экстренные вмешательства выполнены РКП второго поколения «Омнипак» или «Оптирей». Так же нами отмечено, что всем пациентам со стабильной стенокардией проводился комплекс мероприятий по профилактике КИН, который включал в себя пероральную или парентеральную регидратацию до и после ЧКВ в зависимости от исходного риска КИН, прием аторвастатина 80 мг за 12 часов до вмешательства и 40 мг после, а также отмену метформина у больных СД при СКФ менее 45 мл/мин/1,73м2. Пациентам с ОКС мероприятия по регидратации не проводились из-за дефицита времени, отведенного на скорейшее восстановление кровотока в симптом-ассоциированной артерии. После экстренного ЧКВ инфузионная терапия была ограничена у большинства больных в виду осложненного течения ОКС и включала только прием статинов в качестве профилактики КИН.
Через 48 часов, как видно из рис. 4, после проведенного ЧКВ в сравниваемых группах нами отмечен достоверно более высокий прирост креатинина в I группе по сравнению со II группой (28,52 против 8,58 мкмоль/л соответственно).
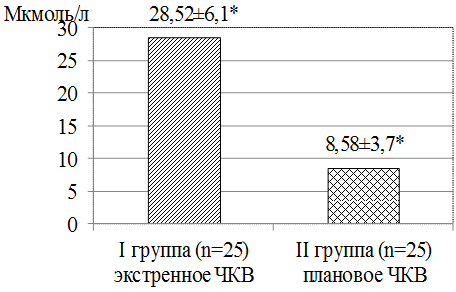
Рис. 4. Прирост уровня креатинина через 48 часов после введения РКП.
В ходе нашего исследования мы обнаружили, что КИН развилась после экстренного ЧКВ в 4 (16%) случаях. Всем этим больным было более 70 лет, РКП использован в объеме 216±7,2 мл. Уровень креатинина в крови до вмешательства у них составил 98,2±9,6 мкмоль/л, а через 48 часов после вмешательства — 135,3±6,7 мкмоль/л. При этом 1 (4%) больному с ОКС потребовалось проведение сеанса ультраплазмофильтрации с целью коррекции нарушений. У всех пациентов с нефропатией отмечен исходно высокий риск КИН, сопутствующий СД с ХБП 3 а-б стадии, осложненное течение ОКС в виде кардиогенного шока или отека легких, в том числе в 3 (12%) случаях был установлен ВАБК с целью поддержания гемодинамики. Один из больных инфарктом миокарда скончался на 6 сутки после успешного ЧКВ из-за нарастающей острой левожелудочковой недостаточности и острой почечной недостаточности, обусловленной, в том числе, КИН.
У пациентов после планового ЧКВ развитие КИН не отмечено, не смотря на то, что у 4 (16%) больных вмешательство потребовало кардиотонической поддержки дофамином в момент операции, но в итоге так и не повлияло на дальнейшее развитие почечной дисфункции.
Выводы:
- Проведенный ретроспективный анализ показал, что КИН развивается чаще после экстренного интракоронарного вмешательства у больных с СД и ХБП в условиях осложненного течения ОКС при исходно высоком риске.
- Отсутствие КИН после плановых ЧКВ указывает на квалифицированную подготовку больных к оперативному лечению, что позволяет минимизировать риск вмешательства, сохраняя здоровье и качество жизни пациентов. Рекомендуется строго следовать установленным мерам по профилактике КИН, регламентированным соответствующими документами.
- Следует рекомендовать к использованию РКП третьего поколения в минимально возможном объеме всем больным с СД, ХБП стадии 3а и выше, в случае острой левожелудочковой недостаточности при ОКС для проведения ургентного ЧКВ с целью минимизации риска КИН.
