Введение. Основной причиной смертности среди населения трудоспособного возраста являются сердечно-сосудистые заболевания (ССЗ) [1,7,9]. Пациенты с ишемической болезнью сердца (ИБС) составляют группу высокого риска развития осложнений и смерти.
В зависимости от симптоматики, функциональной значимости и анатомических особенностей поражения для лечения стабильной ИБС может применяться либо только оптимальная медикаментозная терапия (ОМТ), либо ОМТ в сочетании с реваскуляризацией путем чрескожного коронарного вмешательства (ЧКВ) или аорто-коронарного шунтирования (АКШ). Основными показаниями к реваскуляризации являются: сохранение симптомов, несмотря на ОМТ, и/или вероятность неблагоприятного прогноза при использовании только ОМТ [1,3,15].
Проведение ЧКВ со стентированием коронарных артерий (КА) значительно улучшает кровоснабжение миокарда, но не исключает развития осложнений [9, 10, 13, 14]. Если ЧКВ выполняется своевременно, то оно является рекомендуемой стратегией реваскуляризации для большинства пациентов с острым инфарктом миокарда с элевацией сегмента ST [3,5,6,11,12]. Стентирование КА требует в последующем назначение двойной антиагрегантной терапии (ДААТ), а в некоторых случаях тройной антитромбоцитарной терапии [4,5,16,18,20].
При стандартной ДААТ рекомендовано (Американской ассоциацией сердца (ААС), Американским колледжом кардиологов (АКК), Европейским обществом кардиологов (ЕОК), Всероссийским научным обществом кардиологов (ВНОК)) принимать клопидогрель в концентрации 75 мг ежедневно в течение 1 года после стентирования или тикагрелор 90 мг 2 раза в день в течение 1 года после стентирования в комбинации с ацетилсалициловой кислотой 100 мг, ежедневно.
Тройная антитромбоцитарная терапия включает в себя клопидогрель с ацетилсалициловой кислотой и варфарином (пациенты с фибрилляцией предсердий, поражениями сердечных клапанов, протезированными клапанами сердца (доза подбирается строго индивидуально под контролем международного нормализованного отношения (МНО)) [1,4,5,19,20].
Однако, стентирование КА связано с повышенным риском развития тромбоза стента. Общая частота тромбоза стента составляет около 1,5%, но частота рецидива тромбоза стента велика (около 16 %) и не зависит от типа стента и высокого комплайнса к применению ДААТ у больных, который может привести к летальному исходу [4, 5, 8, 14].
В последнее время особое внимание исследователей уделяется проблеме гиперкоагуляции [2, 6, 8]. Известно, что нарушения тромбообразования могут быть обусловлены наличием полиморфизмов генов гемостаза [6, 7, 10, 15]. Интенсивно изучаются генетические предикторы развития тромбоза стента КА, включая выявление ассоциаций генов-кандидатов, мутации в которых оказывают значительное влияние на гемостаз и при определенных условиях могут стать причиной развития тромбоза стента КА [2, 3, 8, 15]. Генетический полиморфизм в системе гемостаза не всегда имеет клинические проявления, в то же время продемонстрирована связь эпизодов тромбоза с носительством врожденных факторов тромбогенного риска. Известно, что значительное влияние на гемостаз оказывают мутации в генах свертывающей системы крови FGB, ITGA2, ITGB3, связанные с известными генетическими маркерами FGB G -455A, ITGA2 C807T, ITGB3 Т1565C [10, 15, 17].
Цель исследования: изучение прогностической значимости генетических факторов (выявление полиморфизмов G(-455)A (rs1800790) гена FGB, C807T (rs1126643) гена ITGA2, T1565C (rs5918) гена ITGB3), ассоциированных с повышенным риском тромбообразования) у пациентов, которым планируется плановое стентирование коронарных артерий (КА).
Материалы и методы. В ходе проведения исследования нами обследовано 100 пациентов (74 мужчины и 26 женщин) в возрасте от 37 до 70 лет со стабильной стенокардией напряжения III-IV ФК перед плановым стентированием КА. Все они относятся к категории пациентов высокого кардиоваскулярного риска (ВКР), так как имеют в анамнезе следующие факторы риска (ФР): курение, дислипидемия, артериальная гипертензия (АГ), сахарный диабет 2 типа, нарушение толерантности к глюкозе, ожирение, избыточная масса тела, отягощенный наследственный анамнез по раннему развитию ССЗ среди лиц первой линии родства.
В контрольную группу включены 100 здоровых лиц. Всем пациентам и здоровым лицам были проведены клинические исследования (общий анализ крови и биохимическое исследование крови, ЭКГ, суточное мониторирование ЭКГ, ЭХО-КС), а также проведено генетическое исследование с целью выявления полиморфизмов некоторых генов гемостаза (G(-455)A (rs1800790) гена FGB, C807T (rs1126643) гена ITGA2, T1565C (rs5918) гена ITGB3). Выделение ДНК и изучение полиморфизмов генов проводили методом полимеразной цепной реакции в реальном времени с использованием тест-систем производства ЗАО «Синтол» (Россия) на приборе CFX96 Touch (США). Для каждого из изучаемых ДНК-маркеров проводили оценку соответствия распределения генотипов ожидаемым значениям при равновесии Харди-Вайнберга. Для сравнения распределений частот аллелей и генотипов в выборках больных и здоровых использовали критерий χ2 . Силу ассоциаций оценивали с помощью показателя отношения шансов Odds Ratio (OR) и указанием 95% доверительного интервала (ДИ).
Результаты и обсуждение. У 73% пациентов наблюдалась артериальная гипертензия, средний уровень САД был 150±5 мм рт. ст, ДАД - 92±3 мм рт.ст, несмотря на проводимую гипотензивную терапию. Примерно у 2/3 пациентов также были выше целевых значений показатели ХС ЛПНП и составили в среднем 3,6±0,5 ммоль/л, что является неприемлемым для пациентов высокого риска. 27% исследуемых пациентов страдают СД 2 типа, у 30% выявлено нарушение толерантности к глюкозе (НТГ), 24% пациентов имеют ожирение I-II степени (ИМТ>30), 33% имеют избыточную массу телу (ИМТ) (ИМТ 25-29,9).
Такой значимый ФР, увеличивающий коагуляционный потенциал крови, как курение, присутствовал у 43% исследуемых мужчин. Число лиц с отягощенной наследственностью (ОН), в семье которых наблюдались случаи раннего развития ССЗ составило 37% (рис.1).
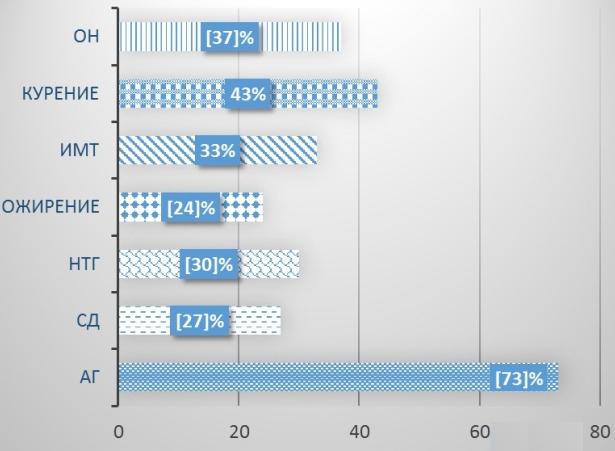
Рис. 1. «Классические» факторы риска пациентов высокого кардиоваскулярного риска в исследуемой группе.
Фибриноген, бета-полипептид (FGB). Выявление мутации G(-455)A (регуляторная область гена). Локализация гена на хромосоме – 4q31.3.
Ген FGB кодирует бета-полипептидную цепь белка фибриногена, растворимого белка плазмы крови, который относится к группе глобулинов (фактор I свертывания крови). Генетический маркер G(-455)A. Возможные генотипы: G/G- нормальная концентрация фибриногена, G/A- концентрация фибриногена умеренно повышена, А/А- концентрация фибриногена значительно повышена. Частота встречаемости минорного (А) аллеля в европейской популяции составляет примерно 20 %.
Полиморфизм G-455A в гене фибриногена. При анализе распределения частот аллелей и генотипов между пациентами, которым планируется проведение ЧКВ со стентированием КА и группой здоровых лиц выявлена ассоциация аллеля А, связанная с высоким риском развития тромбоза стента (OR=2,26, 95% CI=1,47-3,48). Аллель А встречается значительно чаще (0,410), чем у здоровых лиц (0,235), (Х2 =14,02, p=0,0002).
Согласно общей модели наследования: генотип А/А, носители которого в большей степени подвержены развитию тромбозов, чаще встречался у лиц высокого кардиоваскулярного риска (0,210 против 0,060), при этом (OR=4,16 95% CI=1,60-10,83), (Х2 =12,75, p=0,002).
Тест Харди-Вайнберга показал, что генотип G/A гена FGB, характеризующийся умеренно повышенной концентрацией фибриногена встречался несколько чаще среди здоровых лиц нежели среди пациентов высокого кардиоваскулярного риска (0,484 против 0,400), а генотип А/А составил (0,168 против 0,210), (Х2 =3,00, p=0,08).
Интегрин альфа-2 (гликопротеин Ia/IIa тромбоцитов) (ITGA2). Генетический маркер C807T. Маркер связан с изменением свойств коллагенсвязывающих рецепторов тромбоцитов. Исследуется для выявления генетической предрасположенности к ранним инфаркту миокарда, ишемическому инсульту, тромбоэмболии, для оценки риска развития тромбозов после ангиопластики, стентирования коронарных артерий. Участок последовательности ДНК гена ITGA2, в которой происходит замена нуклеотида цитозина (С) на тимин (Т) в позиции 807, обозначается как генетический маркер C807T. Возможные генотипы: С/С- нормальная скорость адгезии тромбоцитов, С/T- скорость адгезии тромбоцитов повышена, по сравнению с генотипом С/С, T/T- скорость адгезии тромбоцитов повышена, по сравнению с генотипами С/С и С/Т. Частота встречаемости аллеля T в европейской популяции составляет около 40 %.
Полиморфизм С807Т в гене ITGA2. Полиморфизм С807Т представляет собой нуклеотидную замену цитозина (С) на тимин (Т) в позиции 807. Наличие Т-аллеля ассоциируется с увеличением скорости адгезии тромбоцитов, что может являться фактором риска тромбофилии.
Результаты, проведенных нами исследований, показали наличие высокой ассоциации аллеля Т, связанного с риском развития тромбоза, среди пациентов высокого кардиоваскулярного риска. Частота аллеля Т составила (0,530) у данной категории больных против (0,220) у здоровых лиц. При анализе распределения частот генотипов между пациентами высокого риска и здоровыми людьми выявлено, что генотип С/С, отвечающий за нормальную скорость адгезии тромбоцитов, выявлен в большей степени у здоровых лиц (0,610) против (0,270) у пациентов, готовящихся к плановому стентированию КА.
В ходе проведенных исследований выявлено, что наличие генотипа Т/Т, связанного с риском развития тромбоза, чаще встречался у пациентов высокого риска (0,330) чем среди обследованных нами здоровых лиц (0,050), (Х2 =3,89, p=0,05).
Интегрин бета-3 (бета-субъединица рецептора фибриногена тромбоцитов) (ITGB3). Генетический маркер T1565C. Маркер связан с изменением: свойств рецептора фибриногена и агрегации тромбоцитов.
Участок ДНК гена ITGB3, где происходит замена тимина (T) на цитозин (С) в позиции 1565, обозначается как генетический маркер T1565C. В результате такой замены меняются биохимические свойства белка GPIIIa, в котором аминокислота лейцин замещается на пролин в позиции 59 (Leu59Pro).
Возможные генотипы: Т/Т-нормальная агрегационная способность тромбоцитов, Т/С- агрегационная способность тромбоцитов умеренно повышена, С/С- агрегационная способность тромбоцитов высокая. Частота встречаемости аллеля С в европейской популяции составляет 13 %.
Полиморфизм Т1565С в гене ITGB3. Тромбоциты носителей С аллеля имеют повышенную склонность к агрегации, что может являться увеличением риска тромбообразования.
Генетический маркер Т1565С: участок ДНК гена, где происходит замена тимина (Т) на цитозин (С) в позиции 1565. При анализе распределения частот аллелей и генотипов между пациентами и здоровыми лицами нами выявлена ассоциация аллеля C, повышающего риск развития тромбоза стента. Частота аллеля С гена ITGB3 составила-0,410 у пациентов, которым планируется проведение ЧКВ со стентированием КА; против 0,265- среди здоровых лиц (OR=1,93 95% CI=1,26-2,94), (Х2 =9,40, p=0,002).
Результаты общей модели наследования показали, что неблагоприятная ассоциация генотипа С/С, увеличивающего риск развития тромбоза, была выявлена у лиц, готовящихся к стентированию КА. Частота данного генотипа составила – 0,260 против-0,090 среди здоровых лиц (OR=3,55 95% CI= 1,57-8,05), (Х2 =14,43, p=0,0001).
Результаты проведенных нами исследований, свидетельствуют о том, что полиморфизмы генов гемостаза, повышающие вероятность тромбообразования имелись не только у пациентов ВКР, но и довольно распространены в группе здоровых лиц. 81% имели те или иные полиморфизмы. Причем, наличие полиморфизма 1 гена - в 48%, 2 генов- у 25% исследуемых, 8% обследованных нами здоровых лиц имеют сочетание полиморфизмов 3 генов.
Среди пациентов ВКР ситуация распределилась следующим образом: 64 % пациентов имели неблагоприятное сочетание всех 3 исследуемых генов, в 27% случаев выявлены полиморфизмы 2 генов, 9% имеют полиморфизм 1 гена (чаще FGB) (таблица 1).
Таблица 1. Сочетания полиморфизмов системы гемостаза у пациентов перед ЧКВ со стентированием КА и группой контроля

Таким образом, проведенные исследования свидетельствуют о том, что у всех обследуемых пациентов имелись полиморфизмы генов системы гемостаза, сопряженные с повышенным риском тромбообразования. Обнаружена высокая частота сочетанных форм мутаций и полиморфизмов в генах системы гемостаза, что повышает тромбогенный потенциал системы крови. Так же были выявлены полиморфизмы генов гемостаза в группе здоровых лиц. В связи с этим, важно выстраивать корреляционную зависимость полиморфизма генов гемостаза и ФР КВР, являющихся триггерами для активации некоторых генов, обуславливающих повышенную тромбогенность. Результаты генетического исследования должны интерпретироваться врачом в комплексе с другими анамнестическими, клиническими и лабораторными данными. Важно проводить именно раннюю диагностику ССЗ: выявлять пациентов высокого КВР, в том числе и по шкале SCORE. Использование высокотехнологичных методов лечения должно максимально помочь снизить риск постоперационных осложнений, улучшить прогноз и качество жизни пациента.
Уже на этапе диагностики пациента должны соблюдаться основные меры профилактики тромбоза стента – отбор пациентов на ЧКВ, заранее спланированное адекватное сопровождение антикоагулянтами интраоперационно и в послеоперационном периоде, соблюдение сроков приема двойной антиагрегантной терапии (поддерживающая доза аспирина 75-100 мг/сут, клопидогреля 75 мг в день или тикагрелора 90 мг 2 раза в сутки) в зависимости от риска как тромбоза стента, так и кровотечения.
