Актуальность проблемы. Ожоги – это часто встречающееся тяжелое повреждение кожи, слизистых оболочек и глубже лежащих тканей, вызванное чрезвычайным воздействием: высокой температурой, химическими веществами, электричеством и лучистой энергией [3]. Методы и средства лечения ожогов являются одной из актуальных проблем. Анализ результатов местного лечения ожоговых ран показывает, что ни одно из применяемых лекарственных средств не является универсальным. Для улучшения регенераторных процессов и быстрого заживления необходимо рекомендовать новые препараты. Совершенствование знаний о механизмах регенерации кожного покрова при термических ожогах позволяет находить более эффективные лекарственные препараты. В настоящее время при лечении ожогов применяются различные биологически активные вещества [1,2]. К таким средствам относится один из природных биостимуляторов – хитозан, который получен из тутового шелкопряда в Институте физики и химии полимеров АН РУз [4]. Необходимо отметить, что данных о влиянии хитозана на генетический аппарат клетки, на репликационную и транскрипционную активность ДНК практически нет. Исходя из вышеуказанного, представляет интерес изучить влияние хитозана на синтез ДНК и РНК при термических ожогах.
Цель исследования: изучение репликационной и транскрипционной активности ДНК при лечении термических ожогов хитозаном.
Материал и методы исследования. При выполнении данных исследований были использованы два вида хитозана: хитозан-1 (хитозан/уксуснокислый ангидрид/фурациллин); хитозан-2 (хитозан/уксуснокислый ангидрид) и левомиколь.
Модель термического ожога воспроизводили на белых беспородных крысах-самцах весом 140-160 г. В соответствии с требованием Хельсинской декларации по гуманному обращению с животными, нанесение ожогов проводили под легким эфирным наркозом. Моделирование ожоговой раны проводили погружением заранее депелированного участка нижней поверхности спины в кипящую воду. Время экспозиции – 10 секунд. При указанном режиме достигалось повреждение всех слоев кожи в зоне ожога, что соответствует ожогу III степени. Площадь ожоговой раны составляет 18-20 кв. см. Процент ожоговой поверхности рассчитывали как отношение площади ожога к общей поверхности тела животного, что составляло 18-20%. Использованная модель термического ожога у крыс являлась адекватной, т.к. обеспечивала ожог кожи. В качестве контроля использовали кожу необожженных крыс.
Высокомолекулярную ДНК выделяли из кожи крыс модифицированным методом фенольной экстракции [5]. Образцы кожи измельчали в ступке до тонкого порошка в жидком азоте. Полученный порошок клеток кожи гомогенизировали в лизирующем буфере (20мМ трис-HCI, рН 8,0; 10мМ ЭДТА, рН 8,0; 5% тритон Х100), инкубация в ледяной бане 30 мин. После инкубации гомогенат центрифугировали 30 мин. (13000g, 40С). После центрифугирования к супернатанту добавили РНКазу (110 мкг/мл), инкубировали 1 час при 370 С. Далее добавили протеиназу К (0,05 мг/мл), инкубация 4 часа при 370. ДНК осаждали 0,1 объемом 3М ацетата натрия и 2 объемами этанола. Концентрацию ДНК измеряли спектрофотометрически при 260 нм.
Фракционирование препаратов ДНК в агарозном геле проводили по методу Шарпа [7]. Агарозный гель готовили следующим образом: необходимое количество агарозы растворяли при нагревании на водяной бане в буфере, содержащем 0,04М трис-НС1 (рН 7,5), 0,005М ацетат натрия, 0,001М ЭДТА. Буфер такого же состава использовали в качестве электродного. Раствор агарозы охлаждали до 500С, заливали в прибор для электрофореза (толщина слоя геля составляла 3 мм). Пробы после рестрикции смешивали с сахарозой, ЭДТА и красителем бром феноловым синим (конечные концентрации составляли 5%, 0,01 М и 0,004%, соответственно) и наносили на поверхность геля. Электрофорез проводили в течение ночи при комнатной температуре при напряжении 1 В/см геля. Гель окрашивали в растворе бромистого этидия (0,5 мкг/мл) в течение 30-40 минут и просматривали под ультрафиолетовым светом. В качестве маркера для определения молекулярного веса фрагментов ДНК использовали ДНК бактериофага l.
Включение 3Н – тимидина и 14С – уридина в ДНК. К ДНК добавляли по 1 мкКи 3Н-тимидина, 14С уридина инкубировали 2 часа. Затем клетки лизировали водой, переносили на нитроцеллюлозные фильтры, высушивали и переносили во флаконы, содержащие сцинтилляционную жидкость. Измеряли количество импульсов в минуту на счетчике «Beckman».
Результаты исследования и обсуждение. Термические травмы имеют сложный и недостаточно изученный патогенез. При обширных и глубоких ожогах возникают глубокие сдвиги, как в функции, так и в морфологии почти всех основных органов и систем, причем причинная взаимосвязь нарушения находится на клеточном и субклеточном уровне, что значительно затрудняет распознавание этих тонких патологических процессов. Важное значение имеет воздействие высокой температуры на белки клетки, в результате чего белки денатурируют, нарушаются процессы репликации, транскрипции и трансляции.
Для того чтобы изучить изменение процессов репликации и транскрипции при ожогах были проведены исследования по включению 3H–тимидина и 14С–уридина (табл. 1). В таблице представлены данные по влиянию хитозана на синтез ДНК и РНК клеток кожи с ожогом III степени. Как видно из таблицы, под действием хитозана-1 на третьи сутки включение 3Н-тимидина в ДНК составляет 52%, на 7-е сутки - 72%, на 11-е сутки - 94%. Включение меченого предшественника в ДНК без применения хитозана-1 (нелеченные) на 3-и 7-е сутки составляет 48 и 27,8%, соответственно. На 11 сутки включение 3Н-тимидина в ДНК составляет 25,5%, т.е. наблюдается снижение синтеза ДНК на 74,5%.
Таблица 1. Влияние хитозана на синтез ДНК и РНК клеток кожи крыс с ожогом

При этом нарушается и синтез РНК. Под действием хитозана-1 на третьи сутки эксперимента включение 14С-уридина в РНК составляет 40%, на 7-е сутки – 67,2%, на 11-е сутки - 90%. Включение меченого предшественника в РНК без применения хитозана-1 (нелеченные) на 3-и 7-е сутки составляет 35 и 23,4%, соответственно. На 11 сутки включение 13С-уридина в РНК составляет 20%, т.е. наблюдается снижение синтеза РНК на 80%.
Для подтверждения полученных результатов был проведен электрофорез ДНК в 1,5% агарозном геле. На рисунке представлены результаты электрофореза ДНК и РНК клеток кожи с ожогом.
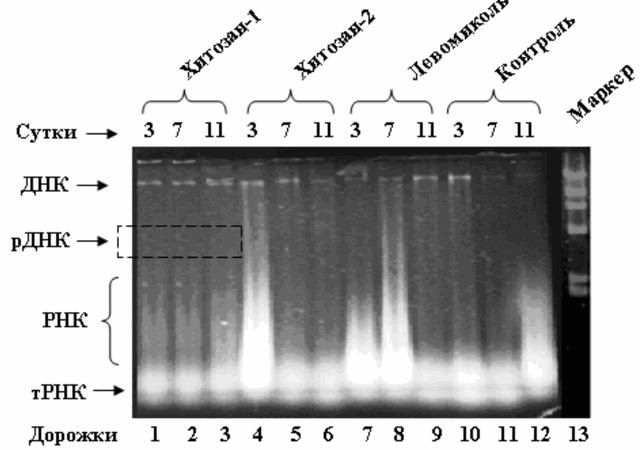
Рис. 1. Электрофореграмма ДНК и РНК клеток кожи с ожогом III степени. Маркер – ДНК фага λ, расщепленная Hind III.
На рис. 1 видно, что при применении хитозана-1 (дорожки 1, 2, 3), на 3-и, 7-е и 11-е сутки происходит восстановление нативности молекулы ДНК. Необходимо отметить, что наиболее полная репарация ДНК происходит на 11-е сутки (дорожка 3). При использовании хитозана-2 на 3-и сутки наблюдается сильное нарушение синтеза ДНК и РНК, что проявляется в виде шлейфа мелко фрагментированных фрагментов молекул ДНК и РНК (дорожка 4). На 7-е и 11-е сутки под влиянием хитозана-2 происходит слабое восстановление синтеза ДНК и РНК (дорожки 4, 5). Под влиянием левомиколя на 3-и, 7-е и 11-е сутки происходит постепенное восстановление синтеза ДНК и РНК в клетках кожи при ожогах (дорожки 7, 8, 9). Из приведенных данных можно прийти к выводу, что хитозан-1 является наиболее эффективным при лечении ожоговых ран.
Таким образом, применение хитозана-1 при лечении ожогов III степени, возможно, приводит к восстановлению процессов репарации ДНК, ускорению процессов транскрипции и, как следствие трансляции, видимо, обусловливая более раннее развитие репаративных процессов в неповрежденных клетках кожи. Исследованиями ряда авторов была показана способность хитозана к компактизации с ДНК клеток, что приводит к активации репаративных процессов, проходящих в ядерном аппарате клетки, и к регенерации необожженных клеток [8].
Исследованиями Антонова С.Ф. и др. (2008) было показано отсутствие гиперемии и отечности, раневой поверхности, полное заживление ран и полноценное восстановление волосяного покрова при шестикратной аппликации хитозановыми пленками [1]. По мнению авторов, природный полисахарид хитозан и его производные регулируют пролиферацию фибробластов и стимулируют нормальную регенерацию кожи. С другой стороны, производные хитина имеют структурные характеристики подобные глюкозаминам кожи и могут служить подложкой для роста кератиноцитов и фибробластов [6,8].
Выводы. Таким образом, хитозан, по сравнению с левомеколем, ускоряет включение 3H–тимидина и 14С–уридина в синтез ДНК и РНК клеток кожи при термической травме. Хитозан-1 ускоряет формирование нативной структуры ДНК и РНК на 3-7 сутки и полное его восстановление к 11-м суткам, тогда как действие хитозана-2 проявляется слабее.
