Согласно данным Международной Диабетической Ассоциации, в 2014 г. в мире насчитывалось 387 млн. человек, страдающих сахарным диабетом [1]. Показано, что основной причиной летальных исходов у 75% пациентов с сахарным диабетом 2 типа (СД2) являются фатальные сердечно-сосудистые осложнения. При этом в мире в период с 1990 по 2013 г. частота сердечно-сосудистой смертности повысилась на 40,8% [2]. Не случайно, что вследствие высокого риска развития сердечно-сосудистых осложнений СД2 рассматривается в качестве эквивалента ишемической болезни сердца (ИБС) [3].
Установлено, что одним из ключевых независимых факторов риска развития атеросклеротических изменений и процесса тромбообразования в артериальном русле и ассоциированными с ними сердечно-сосудистыми заболеваниями является гипергомоцистеинемия (ГГЦ) [4, 5].
При этом тяжелая ГГЦ обусловлена дефицитом фермента цистатион-β-синтазы, а у гомозигот TT по носительству мутантного аллеля С677С>T гена метилтетрагидрофолатредуктазы MTHFR (rs18011333) риск развития сердечно-сосудистых заболеваний оказывается повышенным [6].
Гомоцистеин является серосодержащей аминокислотой, производным незаменимой кислоты метионин, и образуется при ее деметилировании. Метаболизм метионина осуществляется путем реметилирования или трансульфурации, при нарушении нормально протекающего физиологического метаболизма которых развивается ГГЦ. Функцией фермента MTHFR является каталитическое восстановление 5,10-метилентетрагидрофодатредуктазы.
В эпидемиологических исследованиях установлено, что ГГЦ отмечается в 5% случаев в общей популяции и ассоциируется с повышением общепопуляционного риска развития сердечно-сосудистых, нейроденеративных, аутоиммунных, злокачественных заболеваний. При этом прослеживается корреляция между степенью выраженности ГГЦ и носительством генетического полиморфизма MTHFR 677C>T [7].
Ген фолатного цикла MTHFR, кодирующий экспрессию 5,10-метилентетрагидрофолата, картирован на хромосоме 1р36.3. В настоящее время сообщается о существовании нескольких однонуклеотидных полиморфизмов гена MTHFR. Исторически наиболее изученным из них является С677С>T, связанная с заменой в 677 положении аминокислоты цитозин на тимин в сайте связывания фолата. При этом синтезируется термолабильный белок MTHFR со сниженной активностью, уменьшается уровень фолата и нарушается метаболизм гомоцистеина [8].
Генетический полиморфизма гена MTHFR оказывает опосредованный эффект на метаболизм белка MTHFR. Кроме того, рассматриваемый нами генетический полиморфизм C677C>T, привносит вклад в развитие артериальной гипертензии вследствие участия MTHFR в регуляции функции эндотелия [9].
Цель исследования: изучить роль ГГЦ и полиморфизма гена MTHFR при сочетании СД2 и ИБС у пациентов в азербайджанской популяции.
Материалы и методы. В исследование включено 50 пациентов (30 женщин, 20 мужчин) азербайджанской национальности, страдающих СД2 в сочетании с ИБС, находящихся на стационарном лечении в эндокринологическом отделении Республиканской клинической больницы им. акад. М. Мир-Касимова. Средний возраст пациентов составил 50,4±8,62 года, длительность СД2 с момента установления диагноза - от 1 до 18 лет. Диагноз ИБС установлен на основании клинико-лабораторных данных и результатов электрокардиографического исследования. К критериям исключения были отнесены острые сердечно-сосудистые заболевания, инсульт, гнойно-некротические осложнения, гепатит, тяжелая печеночная и почечная недостаточность, анемия тяжелого течения, миокардит, перикардит, аневризма аорты, злокачественные новообразования. Концентрация гомоцистеина исследована иммуноферментным методом. Полиморфизм гена MTHFR исследован масс-спектрометрически (метод MALDI-TOF) с использованием масс-спектрометра Seguenon (США). Статистический анализ проведен с помощью программы “Statistica 6.0” для Windows. Различия рассматривались как достоверно значимые при р<0,05. Носительство генетических полиморфизмов гена MTHFR подчинялось закону Харди-Вайнберга, а для расчета генетических полиморфизмов по модели «случай-контроль» использованы общая и аддитивная модели наследования.
Результаты и их обсуждение. Установлено превышение референсного уровня гомоцистеина во всех возрастных группах, стратифицированных для пациентов с СД2 и ИБС (рис.1). При этом средний уровень гомоцистеина у пациентов менее 60 лет и 60+ в среднем составил 12,6±3,4 и 14,3±4,2 мкмоль/л соответственно (p=0,126). У пациентов с СД2 и ИБС выявлено возраст-ассоциированное повышение уровня гомоцистеина (рис.2). Зависимость уровня гомоцистеина от возраста пациента с СД2 и ИБС азербайджанской национальности оценивается как сильная положительная коррелятивная связь (r=0,641). Положительная коррелятивная связь отмечается также и при рассмотрении другой клинической ассоциации – между уровнем вчСРБ и гомоцистеином (r=0,462).
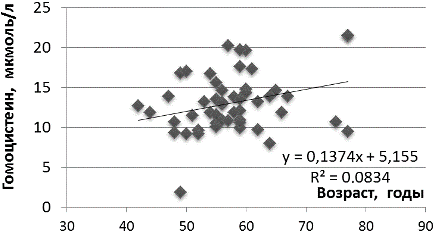
Рис.1. Средний уровень гомоцистеина в зависимости от возраста пациента азербайджанской национальности с сахарным диабетом 2 типа и ИБС.
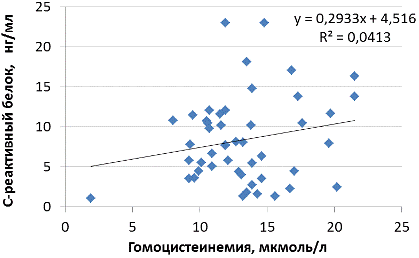
Рис. 2. Средний уровень высокочувствительного С-реактивного белка у пациентов с сахарным диабетом 2 типа и ИБС азербайджанской национальности в зависимости от возраста.
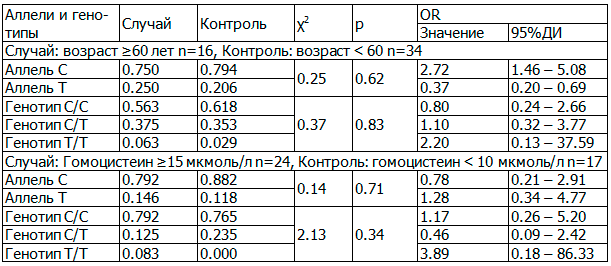
Установлено важность носительства генетических полиморфизмов гена MTHFR, кодирующего ключевой фермент фолатного цикла MTHFR. Распределение генетических полиморфизмов в зависимости от клинических и метаболических характеристик пациентов в исследуемой выборке с СД2 и ИБС представлено в табл.1. В случае оценки влияния носительства генетических полиморфизмов на уровень гомоцистеинемия оценены крайние варианты: >15 и <10 мкмоль/л. При этом в качестве контрольной группы была использована генетическая оценка пациентов с уровнем гомоцистеина <5 мкмоль/л, так как у большинства пациентов азербайджанской популяции при сочетании СД2 и ИБС уровень гомоцистеина превышал этой значение. Выявлена более высокая частота встречаемости носительства однонуклеотидного генетического полиморфизма гена MTHFR у пациентов старшей возрастной группы, а также в случае высокой ГГЦ, однако данные различия не имели достоверной статистической значимости. Это объясняется сложным взаимодействием генетических и негенетических факторов, оказывающих влияние на клиническую манифестацию носительства генетического полиморфизма гена фолатного цикла.
Таблица 1. Клинические аспекты носительства генетического полиморфизма гена метилтетрагидрофолатредуктазы MTHFR у пациентов с сахарным диабетом 2 типа и ИБС азербайджанской популяции
В выборке азербайджанских пациентов с СД2 и ИБС выявлено преобладание носительства нормального варианта генотипа СС в гомозиготной форме гена MTHFR. При этом уровень гомоцистеина был статистически достоверно значимо повышен у носителей гомозиготного генотипа по измененному аллелю ТТ и соответствовал области высокой ГГЦ (рис. 3). Данные согласуются с результатами исследования фолатного цикла у пациентов русской популяции с ИБС, у которых носительство аллеля С в гомо- и гетерозиготной форме не ассоциировалось с повышением риска развития сердечно-сосудистых заболеваний, в то время как у носителей гомозиготного генотипа по измененному аллелю отмечалось его повышение [10].
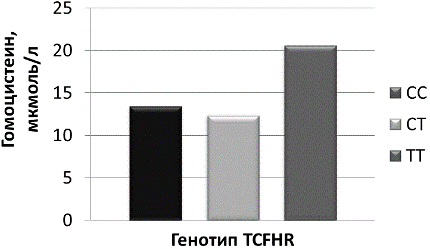
Рис. 3. Уровень гомоцистеина в зависимости от носительства генетического полиморфизма гена MTHFR у пациентов с сахарным диабетом 2 типа и ИБС азербайджанской популяции.
При этом дефицит фолатов, употребляемых в пищу, был ассоциирован с повышением уровня как гомоцистеина, так и вчСРБ и повышением риска развития макрососудистых осложнений СД2 в азербайджанской популяции (рис. 4). Сердечно-сосудистые осложнения СД2 требуют модификации образа жизни с целью снижения сердечно-сосудистого риска, профилактики развития артериальной гипертензии и снижении уровня гомоцистеина и вчСРБ [11]. Так, снижение активности белка MTHFR в условиях фолатного дефицита способствует повышению уровня гомоцистеина, развитию окислительного стресса в сосудистой стенке (характеризующимся, в том числе, и окислением гомоцистеина) и присоединению сердечно-сосудистых осложнений СД2 [12].
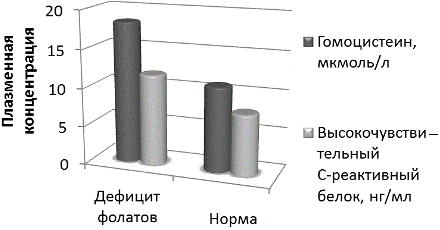
Рис. 4. Уровень гомоцистеина и высокочувствительного С-реактивного белка в условиях дефицита фолатов и при нормальном уровне их потребления у пациентов с сахарным диабетом 2 типа и ИБС азербайджанской популяции.
Результаты проведенного исследования подтверждают тот факт, что риск развития ИБС у пациентов с СД2 обусловлен как генетическими, так и внешними факторами. Установлено, что в азербайджанской популяции важным модифицируемым фактором, предотвращающим развитие ИБС у пациентов с СД2, является устранение ГГЦ. Одним из путей устранения ГГЦ является рациональное питание с адекватной квотой фолатов, что способствует снижению уровня маркеров сердечно-сосудистого риска – гомоцистеина и вчСРБ. Это предопределяет необходимость использования нутриогенетических мер, нивелирующих отрицательное последствие снижения активности гена MTHFR, так как поступление высокого количества пищевых фолатов способствует образованию адекватного количества фермента MTHFR и нормальному функционированию фолатного цикла.
Выводы
- У пациентов с СД2 и ИБС азербайджанской национальности с высокой частотой диагностируется гипергомоцистеинемия
- Уровень гомоцистеина повышен у носителей гомозиготного варианта TT гена MTHFR, кодирующего метаболически менее активную форму фермента метилтетрагидрофолатредуктазы, ответственного за перевод фолата в активную форму.
- Определение уровня гомоцистеина у пациентов с СД2 позволяет выявить группу риска развития ИБС и своевременно провести профилактические мероприятия по предотвращению развития макрососудистых осложнений СД2, основным из которых является контроль за адекватным содержанием пищевых фолатов.
