Заболеваемость НЯК в мире составляет 50 – 80 человек на 100000 населения, причем пик заболеваемости приходится на возрастной период от 20 до 40 лет (Ивашкин В.Т. и соавт., 2008; Sandler R.S. et al., 2000; Charles N. Bernstein et al., 2006). Частота ранних послеоперационных осложнений до настоящего времени составляет при плановых вмешательствах около 10%, экстренных до 60 -80%, а летальность, при появлении осложнений, достигает от 12% - 50% (Эмирасланов Ф.Л., 2007; Воробьев Г.И. и соавт., 2008).
Для выбора адекватной тактики лечения имеет очень важное значение объективная оценка активности НЯК в процессе лечения. С современных позиций диагноз НЯК считается достоверным только при его гистологическом подтверждении (Воробьев Г.И. и соавт., 2006). При этом, самое важное значение гистологических признаков заключается в том, что они являются определяющими в оценке активности, тяжести НЯК и, следовательно, имеют большую клиническую и прогностическую ценность (Рукшина О.А. и соавт., 2003; Воробьев Г.И. и соавт., 2006). Наиболее целесообразна оценка гистологической активности НЯК на основании «классического» описания гистологических изменений слизистой толстой кишки с учетом совокупной выраженности основных патоморфологических изменений (Комаров Ф.И. и соавт., 2008; Sartor R.B., 2004). Тем не менее, до сих пор недостаточно разработаны морфологические критерии, достоверные с позиций доказательной медицины (Асанин Ю.Ю., 2005), которые могли бы объективно оценить как динамику воспалительного процесса, так и результаты различных методов лечения.
Работа основана на анализе результатов обследования и лечения 95 больных с тяжелой и средне-тяжелой формами НЯК, находившихся в проктологическом отделении клиники госпитальной хирургии СамГМУ за период с 2004 по 2010 г. Все пациенты были разделены нами на две группы. В первую группу включены больные, которым комплексное лечение НЯК дополнялось эндолимфатической антибактериальной и иммунотерапией по разработанному (удостоверение на рацпредложение № 174 от 25.10.2011) в клинике алгоритму (n=50), а во второй – пациенты, получавшие общепринятое лечение (n=45). В обеих группах преобладали пациенты с тяжелой формой НЯК: в I группе их было 32 из 50 (64%), а во II – 27 из 45 (60%). Среди всех больных мужчин было 50 (52,6%), женщин 45 (47,3%). Возраст пациентов составил от 19 до 84 лет. В I группе при средне-тяжелой форме НЯК больше всего отмечено пациентов с дистальным и левосторонним колитом – 13 (72,2%), а при тяжелой форме среди всех форм преобладали больные с тотальным колитом – 13 (26%). В II группе выявлена подобная тенденция: при средне-тяжелой форме НЯК дистальный и левосторонний колит были у 14 из 18 больных (77,7%), при тяжелой форме пациентов с тотальным колитом было 13 из 27 (48,1%).
Терапия включала базисные препараты (5-АСК, стероидные гормоны – преднизолон, гидрокортизон, метипред; иммуномодуляторы, фолиевую кислоту, витамины группы В), а также симптоматические средства (спазмолитики – папаверин, но-шпа, платифиллин; имодиум, лопедиум; церукал; обезболивающие средства, гемостатические средства) и пробиотики (линекс, хилак-форте).
При среднетяжелой и тяжелой формах НЯК, появлении осложнений, считаем показанной антибактериальную терапию, так как при этом развивается дисбиоз и нарушается барьерная функция толстой кишки.
Больные I группы (ЭЛТ) получали: ципрофлоксацин (внутрь), метронидазол (внутрь) или метрогил (внутривенно), амикацин (внутримышечно в половинной суточной дозе), амоксиклав (внутривенно в половинной суточной дозе), а также эндолимфатическую антибактериальную и иммунотерапию согласно предложенному алгоритму.
Больные II группы (контроль) получали: ципрофлоксацин (внутрь), метронидазол (внутрь) или метрогил (внутривенно), амикацин (внутримышечно в суточной дозе), амоксиклав (внутривенно в суточной дозе).
Для проведения эндолимфатической терапии (у пациентов первой группы) мы катетеризировали лимфатический сосуд тыла стопы, так как в настоящее время рядом авторов доказано, что при этом способе введения создаются наиболее высокие концентрации препаратов в регионарных лимфоузлах и в стенках толстой и тонкой кишок. Оперативное вмешательство выполняли под местной анестезией 0,5% раствором новокаина после предварительного прокрашивания тканей 2 % раствором метиленовой сини, для визуализации лимфатических сосудов. После выделения лимфатического сосуда, вводили в него ПХВ-катетер на глубину 1-1,5 см. Всем нашим пациентам перед ЭЛТ в лимфатический сосуд вводили гепарин (500 ЕД) в 2,0 мл 0,25 % раствора новокаина. На основании проведенной нами работы по определению чувствительности микрофлоры, выделенной из биопсийного материала, мы для ЭЛТ применяли три антибактериальных препарата: амоксиклав, амикацин, метрогил. В катетер последовательно вводили: амикацин 1,0 в 5,0 мл 0,25 % раствора новокаина, амоксиклав 1,0 в 5,0 мл 0,25 % новокаина, полиоксидоний 6 мг (2,0 мл) и метрогил 30,0 мл (при тяжелой форме – 100,0). После введения препаратов катетер промывали 1,0 мл физиологического раствора хлорида натрия и вводили 0,1 мл (500 ЕД) гепарина в 2,0 мл 0,25 % раствора новокаина («гепариновый замок»). Указанные препараты вводили 1 раз в сутки.
При средне-тяжелой форме НЯК ЭЛТ проводили в течение 3 суток, при тяжелой – до 5-7.
Результаты лечения оценивали по клинико-эндоскопическим данным;
лейкоцитарному индексу интоксикации (ЛИИ) в модификации Химича, общему количеству лимфоцитов и лейкоцитов периферической крови, а также изучали индекс нейтрофилы/лимфоциты; составу микрофлоры, находящейся в слизистой оболочке толстой кишки в области язвенно-некротических образований и ее чувствительность к антибиотикам.
Основное внимание уделяли изучению гистологической активности НЯК (оценивали индекс гистологической активности (ИГА), а также результаты морфометрии крипт-абсцессов) у пациентов обеих групп.
При фиброколоноскопии осуществляли забор не менее четырех биоптатов из каждого анатомического отдела толстой кишки, вне зависимости от наличия или отсутствия видимых изменений слизистой оболочки.
В нашей работе мы рассчитывали модифицированный индекс гистологической активности (с балльной системой оценки основных гистологических характеристик слизистой оболочки толстой кишки) независимо от клинико-лабораторных и эндоскопических показателей. Это обусловлено тем, что снижение гистологических показателей активности НЯК формируется значительно позже снижения клинико-эндоскопической активности и поэтому более точно отражает наступление морфологической ремиссии заболевания (Асанин Ю.Ю., 2005).
Взяв за основу данные Ю.Ю. Асанина (2005) мы модифицировали предложенный им ИГА (удостоверение на рационализаторское предложение № 172 от 25.10.2011). Отличия заключаются в следующем:
- Ю.Ю. Асанин разработал ИГА только для пациентов со средне-тяжелым течением НЯК;
- Два из четырех гистологических признаков, составляющих ИГА, ха-рактеризуют стадию ремиссии НЯК и только 2 признака – обострение;
- Выраженность клеточной инфильтрации и крипт – абсцессы объединены в один гистологический признак.
Предложенный нами ИГА, во-первых включает в себя 6 гистологических характеристик слизистой толстой кишки, которые всегда присутствуют (в различной степени) при обострении НЯК; во-вторых он применим при любой степени обострения заболевания; и, кроме того, он адекватно отражает динамику воспалительного процесса и поэтому является одним из объективных критериев любого консервативного метода лечения. Индекс гистологической активности мы подсчитывали у каждого больного до и после лечения.
Для более объективной оценки воспалительного процесса, нами выполнена морфометрия наиболее важного гистологического признака НЯК – крипт-абсцессов – в динамике, как в контрольной, так и в основной (после проведения ЭЛТ) группах.
Данные о морфометрии крипт-абсцессов при обострении НЯК в литературе отсутствуют.
Анализ патоморфологических изменений показал у всех пациентов обеих групп, что имелись выраженные воспалительные изменения слизистой толстой кишки. В слизистой оболочке кишечника у всех больных выявлена дистрофия эпителия, у всех пациентов обеих групп выявлены криптальные кисты (рис. 1).
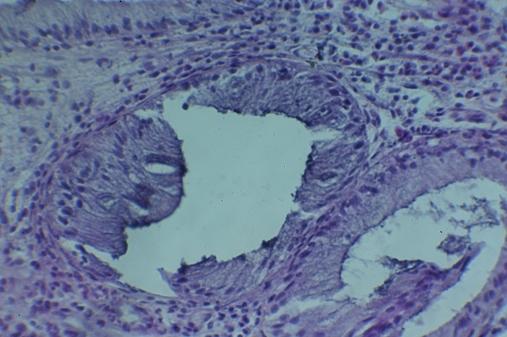
Рис. 1. Микрофотография. Кисты крипт слизистой оболочки толстой кишки. Об. 40., ок. 15. Окраска гематоксилин – эозин.
Наличие кист сопровождалось отеком собственного слоя слизистой оболочки, он был инфильтрирован лимфоцитами, макрофагами, плазмоцитами, а также полиморфноядерными лейкоцитами, которые при тяжелом течении НЯК выявлялись в большем количестве, чем при средне-тяжелом.
Так, при средне-тяжелом обострении НЯК лимфоциты в инфильтратах выявлены у 24 (66,6 %) пациентов, а мононуклеары и гранулоциты – у 12 (33,4 %). При тяжелом обострении НЯК во всех случаях в клеточном инфильтрате присутствовали как лимфоциты, так и полиморфноядерные лейкоциты (рис. 2).
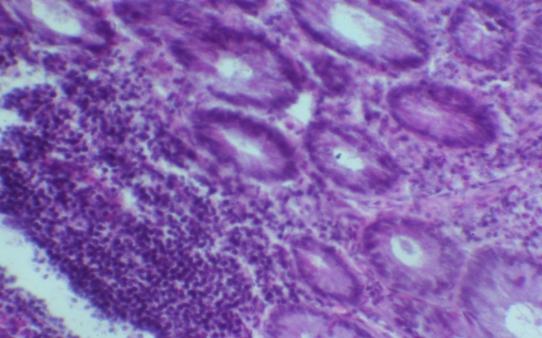
Рис. 2. Микрофотография. Лимфоидная инфильтрация собственной пластинки слизистой оболочки толстой кишки. Об. 20., ок. 15. Окраска гематоксилин – эозин.
При этом, если при средне-тяжелом течении НЯК плотность инфильтрата была средней и обнаруживается у 55,5% больных, то при тяжелом течении – у 71,1% - появляются клеточные инфильтраты высокой плотности. Расширение капилляров с явлениями стаза было у всех пациентов, причем при тяжелом течении НЯК оно было более выраженным, а стаз выявлен во всех случаях (рис. 3).
При средне-тяжелом обострении НЯК выявились эрозии слизистой оболочки, причем они чаще были множественными - 86,1%, реже – единичными 13,9%; при тяжелом обострении НЯК эрозии были множественными во всех случаях (рис. 4). Наиболее типичный гистологический признак НЯК – криптальные абсцессы, которые возникают из криптальных кист. Количество крипт-абсцессов соответствовало активности воспалительного процесса.
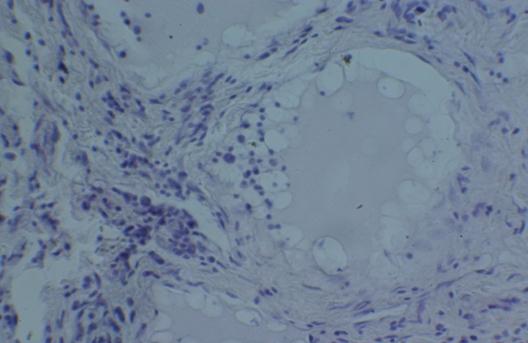
Рис. 3. Микрофотография. Расширенные вены, застой в сосудах подслизистой основы стенки толстой кишки. Об. 20., ок. 15. Окраска гематоксилин – эозин.
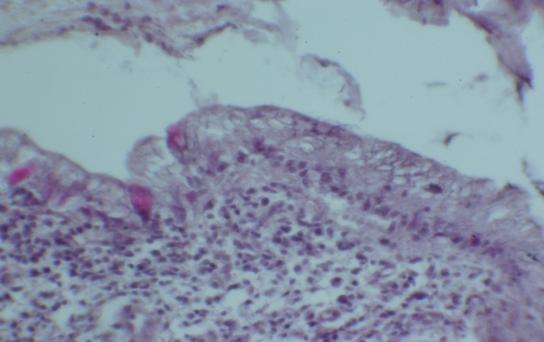
Рис. 4. Микрофотография. Повреждение структуры эпителия слизистой оболочки толстой кишки. Об. 20., ок. 15. Окраска гематоксилин – эозин.
Так, при средне-тяжелом течении НЯК единичные крипт-абсцессы встречались у 27 (75 %) больных, у 9 (25%) – множественные. При тяжелом течении заболевания множественные крипт-абсцессы зарегистрированы у 37 (62,7 %), а единичные – у 22 (37,3 %) (рис. 5).
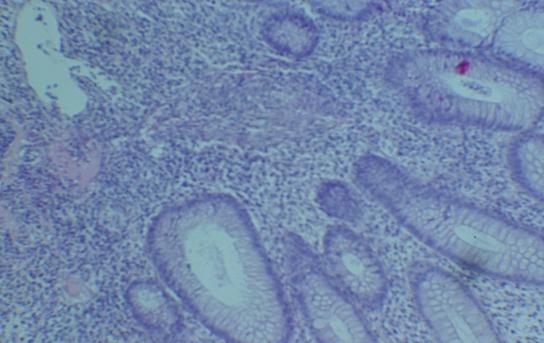
Рис. 5. Микрофотография. Множественные крипт-абсцессы слизистой оболочки толстой кишки. Об. 10., ок. 15. Окраска гематоксилин – эозин.
При высокой активности воспалительного процесса определялась гранулоцитарная инфильтрация поверхностного эпителия (микроабсцессы эпителия). При некрозе эпителия, выстилающего крипты, крипт-абсцессы вскрываются, при этом образуются язвы. При одновременном вскрытии нескольких крипт-абсцессов возникло большое изъязвление, определяемое эндоскопически. При этом воспаление нередко распространяется на более глубокие слои стенки кишки вплоть до мышечной оболочки (рис. 6).
При средне-тяжелом течении НЯК у большинства пациентов язвы были единичные, а при тяжелом течении у 43 (72,8%) больных выявлены множественные язвы.
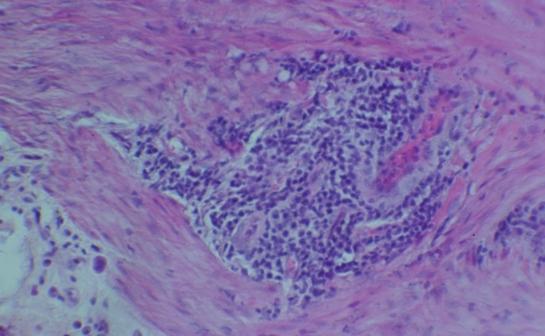
Рис. 6. Микрофотография. Участок инфильтрации мышечной оболочки слизистой оболочки толстой кишки. Об. 20., ок. 15. Окраска гематоксилин – эозин.
В основании язв были видны скопления некротической ткани. У всех больных с тяжелым течением НЯК выявляли псевдополипы, а при средней тяжести – у каждого второго пациента.
Итак, о тяжести воспалительного процесса в слизистой толстой кишки свидетельствовали: состояние эпителия, плотность инфильтративных изменений, клеточный состав инфильтрата, наличие крипт-абсцессов и их количество, а также глубина поражения.
Анализ всех основных гистологических признаков НЯК произведен в сравнительном аспекте – до и после лечения в обеих группах пациентов.
Оценка полученных данных результатов показала, что у пациентов, получавших ЭЛТ, наблюдалась более выраженная регрессия воспалительных изменений в слизистой толстой кишки (рис. 7, 8).
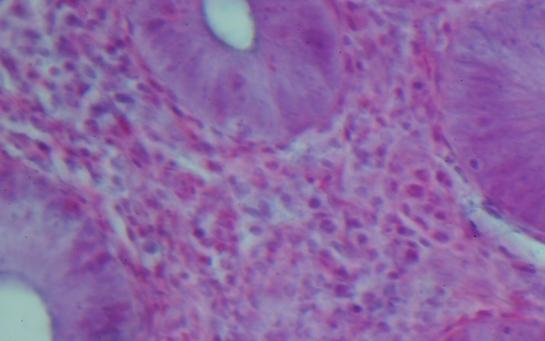
Рис. 7. Микрофотография. Инфильтрация эозинофилами собственной пластинки слизистой оболочки толстой кишки. Об. 40., ок. 15. Окраска гематоксилин – эозин.
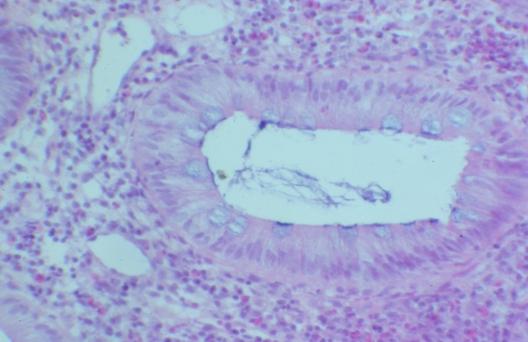
Рис. 8. Микрофотография. Бокаловидные клетки эпителия слизистой оболочки толстой кишки. Об. 20., ок. 15. Окраска гематоксилин – эозин.
Это проявилось при изучении всех основных гистологических характеристик НЯК, за исключением аналогичных показателей у больных, которые были оперированы из-за отсутствия эффекта от консервативного лечения: с тяжелой формой НЯК семь пациентов в первой и девять во второй группе, а также одного больного второй группы со средне-тяжелой формой.
Летальных исходов в обеих группах пациентов не было.
Морфометрическое исследование слизистой стенки кишечника и подсчет ИГА выполнен у пациентов обеих групп, которые лечились консервативно. Для более объективной оценки воспалительного процесса, нами выполнена морфометрия наиболее важного гистологического признака НЯК – крипт-абсцессов – в динамике, как в контрольной, так и в основной (после проведения ЭЛТ) группах.
Морфометрическое исследование проводилось с помощью окулярной сетки Автандилова при увеличении: объектив 10, окуляр 15 с подсчетом количества крипт-абсцессов и общего количества крипт в 10 полях зрения в каждом препарате. У каждого больного просматривали по 5 препаратов. Соотношение количества выявленных крипт-абсцессов (в 10 полях каждого из пяти препаратов) к количеству крипт выражали в % и называли индексом образования крипт-абсцессов (ИОКА).
У пациентов, получавших ЭЛТ, количество крипт-абсцессов в процессе лечения уменьшилось при тяжелом течении НЯК на 60 % (индекс составил 15 %), при средне-тяжелом течении НЯК – на 55 % (индекс составил 5,35 %).
В контрольной группе соответственно – на 51% при тяжелом течении НЯК (индекс составил 18,38 %) и на 48 % при НЯК средне-тяжелого течения (индекс составил 6,5 %). Эти данные подтверждают эффективность ЭЛТ при НЯК, особенно при тяжелой форме.
Динамику гистологических характеристик мы оценивали следующим образом. Учитывая, что ЭЛТ при тяжелом течении НЯК и появлении возможных осложнений заболевания обладает большим патогенетическим эффектом (антибактериальным, иммуностимулирующим) мы сравнили полученные результаты отдельно по подгруппам – при средне-тяжелом и тяжелом течении НЯК.
При этом установлено значительно большее снижение ИГА у пациентов первой группы по сравнению с контрольной. При НЯК средне-тяжелого течения ИГА снизился в первой группе на 22,75 балла (то есть на 31,7 %), а во второй – на 15,71 балла (на 22 %). У пациентов с тяжелым течением НЯК ИГА снизился: в первой группе – на 31,4 балла (31,4 %), во второй – на 22,43 балла (22,4%).
У всех оперированных пациентов обеих групп в связи с неэффективностью проводимой комплексной терапии ИГА на момент оперативного вмешательства достиг максимального значения – 101 балла.
Однако при анализе (у оперированных больных) динамики индекса образования крипт-абсцессов выявлено его увеличение на момент операции в I группе (7 пациентов) на 9 %, а во II группе (10 больных) – на18,75 %.
То есть, у пациентов, получавших ЭЛТ, несмотря на прогрессирование заболевания, количество крипт-абсцессов на момент оперативного вмешательства было меньше, чем у больных контрольной группы.
Выводы
- Использование методов общей морфологии и морфометрии позволяет дать объективную оценку тяжести НЯК и проследить динамику в гистологическом строении стенки кишечника в процессе лечения пациентов.
- Анализ морфологических исследований доказывает эффективность эндолимфатической терапии в комплексном лечении пациентов с обострением НЯК, особенно при тяжелой форме.
- Предложенный нами модифицированный индекс гистологической активности может применяться при любой степени обострения заболевания; адекватно отражает динамику воспалительного процесса и поэтому является одним из объективных критериев любого консервативного метода лечения больных с НЯК.
