Введение. Инфицирование очагов панкреатической деструкции в поджелудочной железе (ПЖ) и забрюшинной клетчатке происходит у 40–70 % больных панкреонекрозом (ПН) [1]. По мнению отечественных и зарубежных авторов [2, 3], вероятность и обширность инфицирования при ПН, а также создание благоприятных условий для этого зависит не только от нарушения микроциркуляции и нарушения проницаемости клеточных мембран, но и в большей степени от размера очагов некроза. Эти выводы сформулированы при сравнении интраоперационных находок или результатов контрастной компьютерной томографии с частотой положительных микробиологических исследований, полученных во время хирургического вмешательства или при транскутанной пункции очагов некроза под ультразвуковым или КТ – контролем [4].
Микрофлора желудочно-кишечного тракта, в частности толстой кишки, в условиях его пареза и нарушения барьерной функции, является одним из основных источников инфицирования девитализированной ткани ПЖ, забрюшинной клетчатки и брюшной полости при панкреонекрозе [5].
Существует несколько различных механизмов транслокации флоры в очаги деструкции. По данным отечественных авторов [2, 6], основными возбудителями инфекции при панкреонекрозе являются не только грамотрицательные микроорганизмы (E.Coli, энтеробактерии), но и различные представители анаэробной неклостридиальной инфекции (АНИ) – Bacteroides, Fusobacterium, Peptococcus, Actinomyces и др., частота выделения которых превышает 17%. Развитие АНИ значительно утяжеляет течение заболевания, ухудшает прогноз и требует специфического лечения.
В последние десятилетия для диагностики АНИ получил распространение метод газожидкостной хроматографии и масс-спектрометрии (ГХ–МС), позволяющий быстро идентифицировать летучие жирные кислоты (ЛЖК) – пропионовую, изомасляную, масляную, изовалериановую, валериановую и др., которые являются специфическими конечными продуктами метаболизма анаэробных бактерий, выявляемых как в среде роста, так и в патологически измененных тканях [8-10]. Аэробные бактерии эти кислоты не продуцируют.
Ряд преимуществ делают метод ГХ–МС перспективным в экспресс-диагностике АНИ [11, 12]. Данный метод является высокочувствительным и удобным: совпадение бактериологических и газохроматографических данных при АНИ мягких тканей превышает 70 %; для исследования подходит любой субстрат (кровь, экссудат, мышечная ткань); есть возможность динамического наблюдения и оценки течения различных биохимических процессов [13-15].
Метод ГХ-МС позволяет качественно и количественно оценить токсические метаболиты, накапливающиеся в процессе развития панкреонекроза и его инфекционных осложнений [16, 17] (рис. 1).
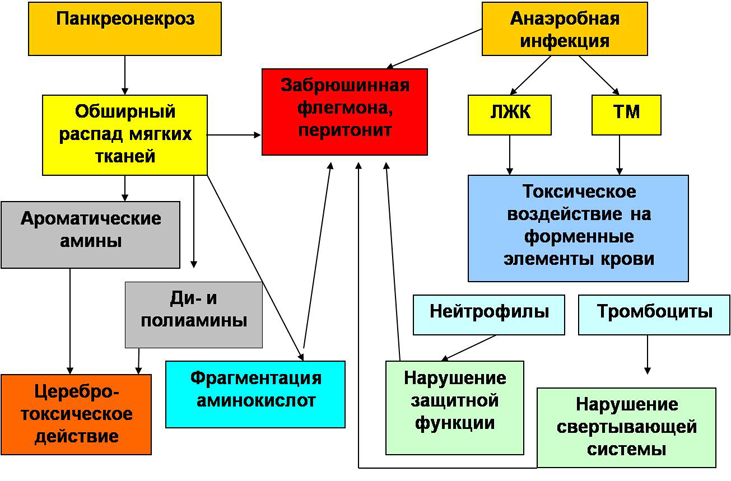
Рис. 1. Схема некоторых сторон патогенеза осложнений панкреонекроза на основе данных ГХ-МС – анализа.
Цель исследования: с помощью метода ГХ-МС оценить эффективность комплексной терапии деструктивного панкреатита с применением гипербарической оксигенации (ГБО) для профилактики инфицирования и нагноения очагов панкреонекроза.
Материал и методы. Проведено исследование 2-х групп больных: первая группа – 9 пациентов со стерильным панкреонекрозом (СПН), вторая группа – 5 пациентов с инфицированным панкреонекрозом (ИПН).
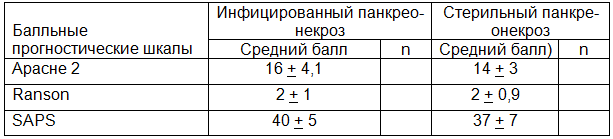
Оценка тяжести состояния больных при поступлении осуществлялась с помощью интегральных шкал Арасне 2, Ranson и SAPS (табл. 1).
Таблица 1. Средний балл оценки состояния пациентов с панкреонекрозом по разным прогностичнеским шкалам
Всем пациентам при поступлении выполняли ультразвуковое исследование брюшной полости. При наличии значительного количества свободной жидкости в брюшной полости, пациентам выполняли диагностическую лапароскопию.
В группе СПН трем пациентам (33,3%) под эндотрахеальным наркозом была выполнена видеолапароскопия, санация и дренирование брюшной полости, блокада круглой связки печени по поводу ферментативного перитонита. Проводили дальнейшее консервативное лечение, включающее в себя антибактериальные препараты (карбапенемы) в максимально разрешенных дозировках, блокаторы секреции ПЖ (октреотид), инфузионную терапию, сеансы ГБО.
Все пациенты в группе с ИПН оперированы. Объем операции включал в себя бисубкостальную лапаротомию с абдоминизацией ПЖ, ревизию, некрсеквестрэктомию, санацию, дренирование и тампонирование вовлеченных в деструктивный процесс клетчаточных пространств.
С помощью системы для хромато-масс-спектрометрического анализа HP-5985B с хроматографом HP-5840 провели идентификацию микробных метаболитов и других соединений – летучих жирных кислот (ЛЖК), и токсических метаболитов (ТМ) группы фенолов и крезолов, фенилкарбоновых и оксифенилкарбоновых кислот, ди– и полиаминов, ароматических аминов и фрагментов аминокислот у больных ПН.
Степень развития парапанкреатических осложнений оценивали с помощью инструментальных методов исследования (УЗИ, КТ брюшной полости), тяжесть состояния – с использованием прогностических шкал оценки и других лабораторных методов (прокальцитониновый тест, уровень средних молекул).
Результаты исследования. Методом газожидкостной хроматографии и масс-спектрометрии выделены основные летучие жирные кислоты (ЛЖК) и токсические метаболиты (ТМ), концентрация которых в плазме косвенно определяет тяжесть и обширность патологического процесса в области ПЖ.
Концентрация масляной кислоты (один из наиболее значимого микробного метаболита жизнедеятельности анаэробных бактерий) в первые сутки госпитализации у пациентов со СПН в среднем составляли 0,55 + 0,5 ммоль/л. На фоне проводимого консервативного лечения в сочетании с ГБО, мы отметили достоверное снижение (p<0,05) уровня масляной кислоты в среднем на 0,3 ммоль/л в первые 8 суток заболевания (рис. 2).
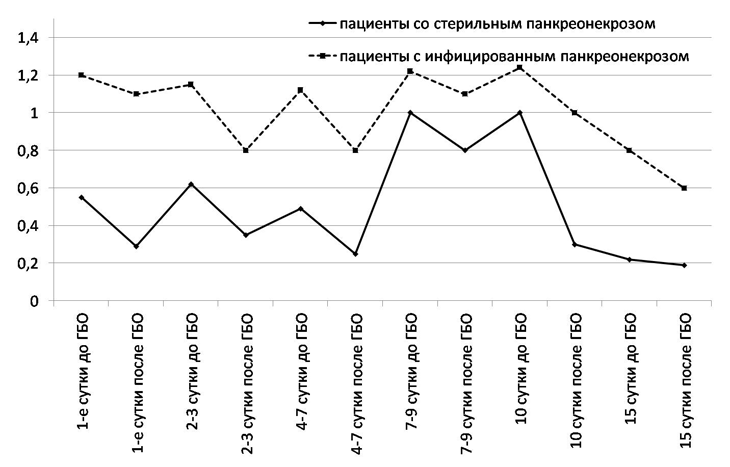
Рис. 2. Динамика колебаний содержания масляной кислоты в плазме пациентов со СПН и ИПН на фоне сеансов ГБО (ммоль/л).
Далее на 7–10 сутки отмечается некоторый подъем уровня данной кислоты до уровня значений, выявленных у пациентов с инфицированным панкреонекрозом. Данный подъем объясняется последовательным нарушением описанных ранее защитных барьеров макроорганизма, и повышение титра АНИ и уровня эндотоксинемии, системными изменениями, проявляющимися в процессе заболевания. И дальнейшее прогрессивное снижение на 10-е – 15-е сутки заболевания показателей до уровня практически нормальных значений, связанно с проведением дезинтоксикации и гипероксигенации, очевидно подавляющих жизнедеятельность АНИ.
Показатели фенилпропионовой и фенилуксусной кислот являются одними из наиболее значимых метаболитов анаэробных бактерий, оказывающих токсическое воздействие на печень, вызывающих тяжелую печеночную недостаточность. Динамика этих ЛЖК на фоне проведения лечения у больных с ИПН и СПН представлена на рис. 3.
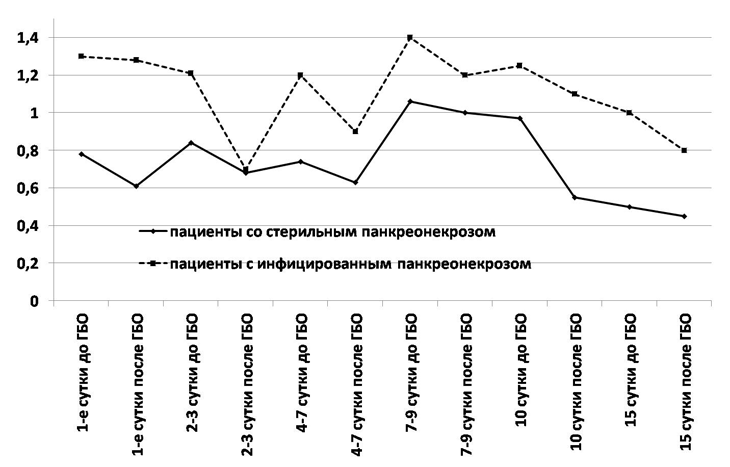
Рис. 3. Динамика концентрации фенилпропионовой и фенилуксусной кислот в плазме больных панкреонекрозом на фоне сеансов ГБО (ммоль/л).
Следует отметить исходно высокое значение данных метаболитов у пациентов с ИПН, и, следовательно, более тяжелое поражение печени, и ухудшающийся прогноз заболевания. Нами отмечена достоверная корреляция уровня данных метаболитов с обширностью поражения ПЖ при СПН на фоне сеансов ГБО (рис. 4).
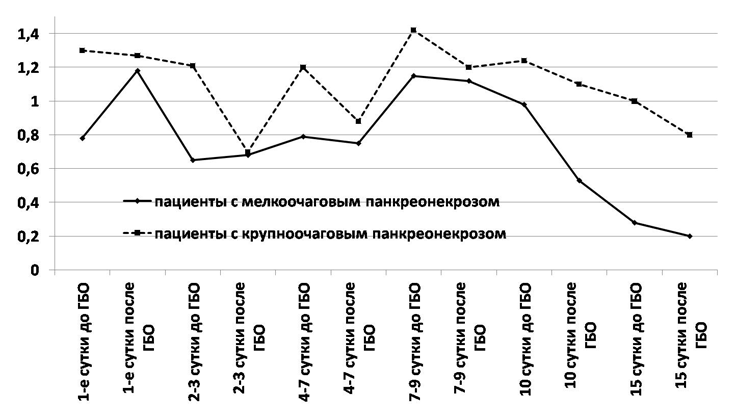
Рис. 4. Динамика концентрации фенилпропионовой и фенилуксусной кислот у пациентов с крупноочаговым и мелкоочаговым СПН (ммоль/л).
Ди– и полиароматические амины являются маркерами распада тканей (белковых структур), а значит и отражают распространенность и масштаб очагов некроза. Их уровень, по нашим данным, у пациентов со СПН составил суммарно – 1,3 + 0,22 ммоль/л (рис. 5).
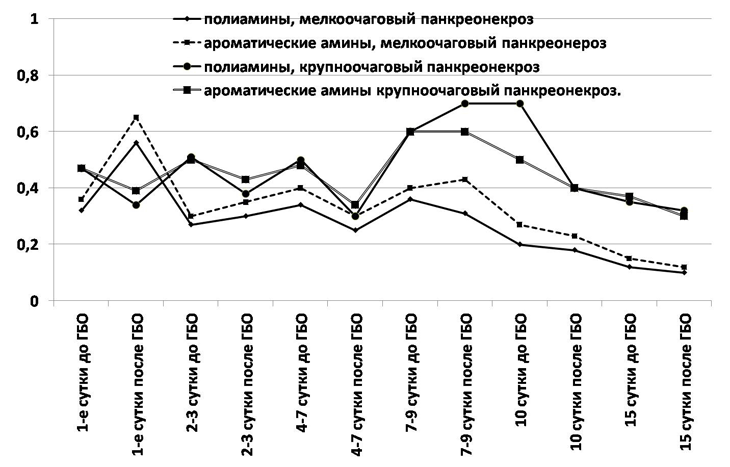
Рис. 5. Динамика концентрации поли– и ароматических аминов у пациентов мелкоочаговым и крупноочаговым стерильным панкреонекрозом (ммоль/л).
В группе пациентов с ИПН отмечен высокий уровень летальности (60 %), что связано с обширностью поражения ПЖ, забрюшинной клетчатки, часто молниеносным течением заболевания с развитием тяжелого панкреатогенного шока и полиорганной недостаточности. В частности, развитие тяжелой почечной недостаточности значительно ухудшало прогноз течения заболевания, несмотря на проводимые сеансы ультрагемофильтрации и гемодиализа. Объективно тяжесть полиорганной недостаточности и связанной с ней почечной недостаточности отражает динамика фенолов и крезолов (рис. 6).
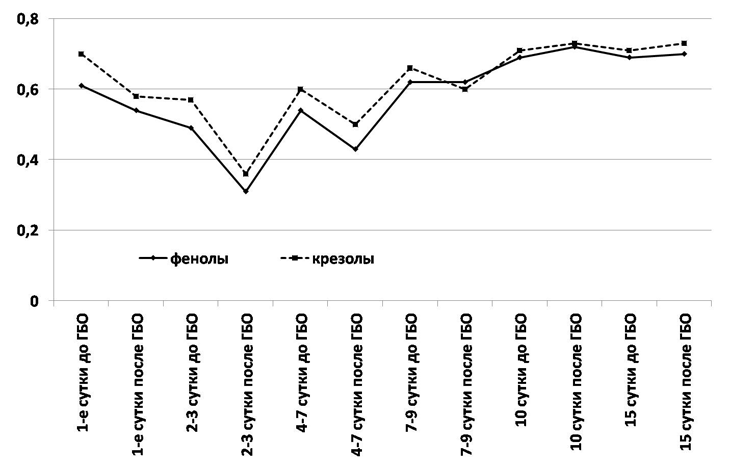
Рис. 6. Динамика концентрации фенолов и крезолов в плазме пациентов с инфицированным панкреонекрозом (ммоль/л).
Стоит отметить, что максимальный уровень данных жирных кислот отмечен на 7 – 9 сутки заболевания и у пациентов со СПН достигал 0,5 ммоль/л, а при ИПН – 0,7 ммоль/л (рис. 7).
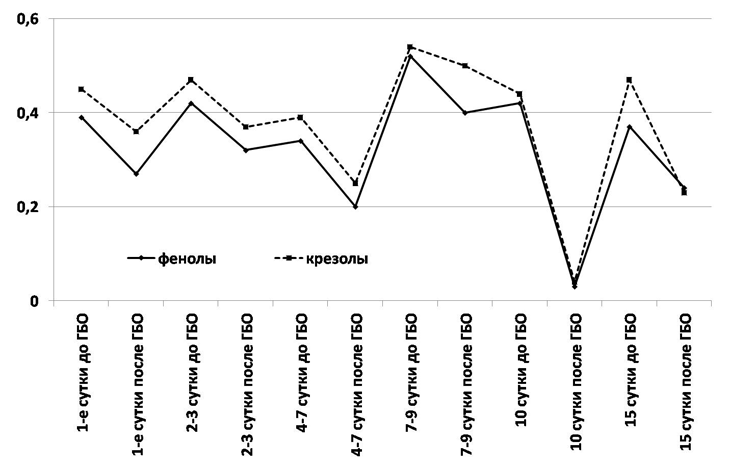
Рис. 7. Динамика концентрации фенолов и крезолов в плазме пациентов со стерильным панкреонекрозом (ммоль/л).
Данные различия явились статистически достоверными и прогностически неблагоприятными в исходе заболевания. На 15-е сутки от начала госпитализации у пациентов со СПН отмечено снижение уровня фенолов и крезолов на 39 и 49,9 % соответственно (рис. 8, 9).
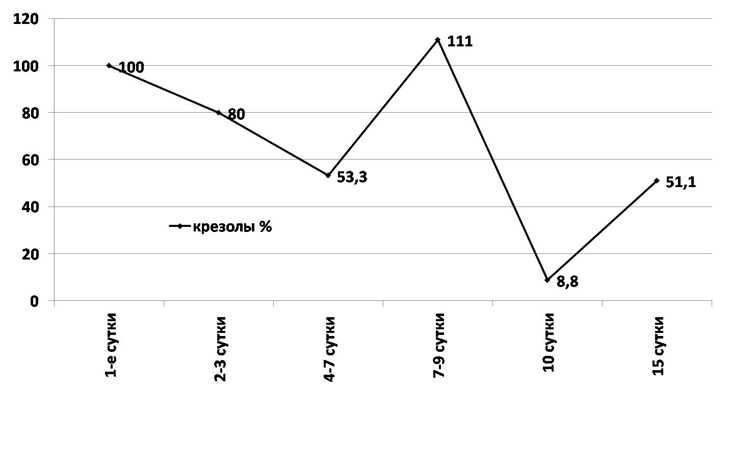
Рис. 8. Динамика относительных колебаний концентрации крезолов в плазме пациентов со стерильным панкреонекрозом (%).
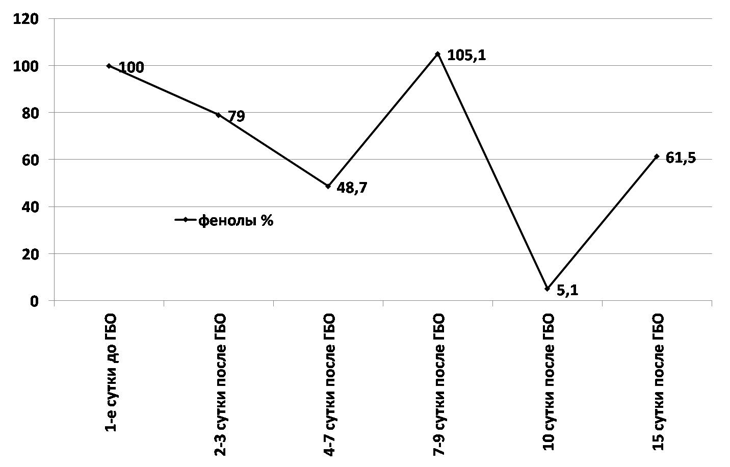
Рис. 9. Динамика относительных колебаний концентрации фенолов в плазме пациентов со стерильным панкреонекрозом (%).
В тоже время, при ИПН на 15-е сутки от начала госпитализации отмечается повышение уровня данных ЛЖК на 12,5 и 14 % соответственно от изначального уровня показателей (рис. 10, 11).
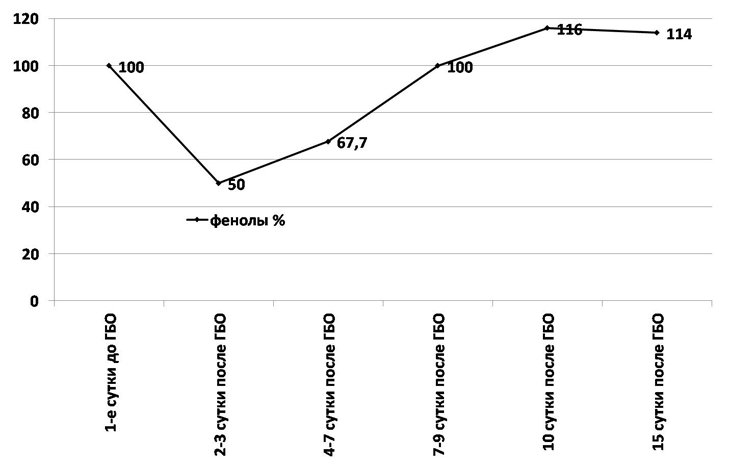
Рис. 10. Динамика относительных колебаний концентрации фенолов в плазме пациентов с инфицированным панкреонекрозом (%).
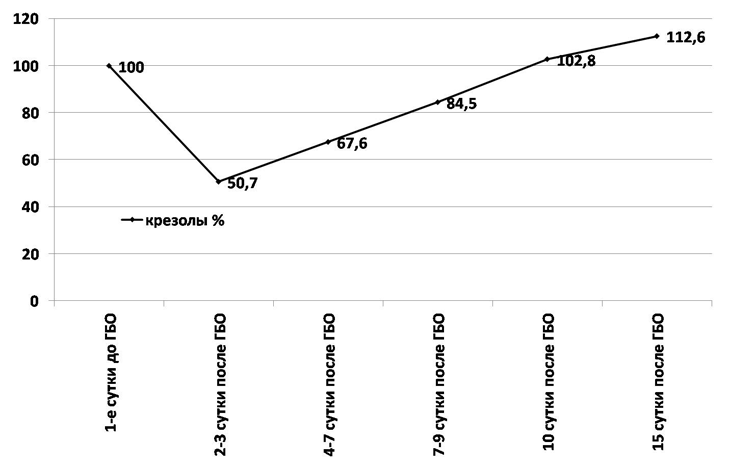
Рис. 11. Динамика относительных колебаний концентрации крезолов в плазме пациентов с инфицированным панкреонекрозом (%).
При оценке динамики концентрации данных метаболитов в плазме нами отмечено резкое поднятие уровня данных кислот на 7-е сутки, что может объяснить волнообразность течения заболевания, и возможное дальнейшее инфицирование некрозов ПЖ и парапанкреатической клетчатки у пациентов с массивной деструкцией ПЖ, которое происходит не всегда молниеносно. Именно на 7 – 9 сутки отмечается подъем и других ЛЖК. Полученные данные позволяют сделать выводы, что 7 – 9 сутки являются прогностически значимыми для пациентов с клинической картиной острого деструктивного панкреатита, и именно на этом этапе лечения целесообразна комплексная оценка клинических, лабораторных и клинических данных для определения дальнейшей тактики лечения пациентов. При положительной динамике развития и течения СПН, после 7 – 9 суток отмечается резкое снижение уровня практически всех ЛЖК (рис. 2, 3, 4, 6). Так же отмечается более низкие значения ЛЖК в первые сутки госпитализации у пациентов с мелкоочаговым стерильным панкреонекрозом, что еще раз объективно отражает более благоприятный исход течения заболевания.
Напротив, у пациентов с ИПН отмечено некоторое снижение уровня ЛЖК на 2 – 3 сутки от начала госпитализации и неуклонное возрастание в дальнейшем, несмотря на проводимое консервативное и даже оперативное лечение.
Повышенное значение фенолов и крезолов у пациентов с ИПН (фенолы и крезолы являются нефротоксичными) находит свое отражение в развивающейся острой почечной недостаточности, сопровождающейся повышением уровня мочевины (в среднем 18,3 + 2 ммоль/л) и креатинина (в среднем 274,2 + 5 ммоль/л).
У всех пациентов выполняли прокальцитониновый тест в разные сроки заболевания. Ряд авторов [7, 18] отмечают высокую диагностическую ценность этого показателя. По нашим данным, у 60% больных с ИПН и 100% со СПН с доказанным (по данным ХГ-МС) наличием АНИ прокальцитониновый тест был отрицательным.
Таким образом, можно сделать предварительный вывод, что прокальцитониновый тест не всегда отражает наличие смешанного инфицирования некрозов ткани ПЖ, а значит и не может являться универсальным маркером тяжелого инфицирования и предиктором развития синдрома системной воспалительной реакции у пациентов с инфицированным и стерильным ПН.
Тяжесть течения раневого процесса у больных обширным панкреонекрозом коррелирует с обширностью поражения парапанкреатической и забрюшинной клетчатки и степенью инфицированности очагов деструкции. Летальность в нашей группе ИПН достигла 60 %, в то время как летальность в группе СПН составила 0%.
Выводы: ЛЖК и динамика изменения их концентрации в плазме при различных формах ПН объективно отражают наличие АНИ при так называемом “стерильном” панкреонекрозе, что не позволяет поставить знак равенства между инфицированностью очагов деструкции и развитием нагнои тельного процесса.
У пациентов с мелкоочаговым и крупноочаговым ПН концентрация маркеров распада тканей (ди–, полиамины и ароматические амины) в плазме значительно отличаются, и эти различия статистически достоверны (p < 0,05). Таким образом, нами выявлена прямая корреляционная зависимость между уровнем маркеров распада тканей и КТ и УЗИ признаками масштаба поражения ПЖ.
На фоне консервативного лечения пациентов со СПН с применением гипербарической оксигенации, отмечается значительное снижение токсических и микробных метаболитов, что косвенно свидетельствует о снижении уровня инфицирования (вероятно посредством подавления вегетирующей АНИ) и сокращения темпов распада ткани ПЖ.
