В последние годы особое внимание привлечено к проблеме безопасного применения нестероидных противовоспалительных препаратов (НПВП), профилактики и лечения желудочно-кишечных побочных эффектов. Исходя из патогенеза НПВП-гастропатии до настоящего времени, для профилактики и лечения применяются препараты двух классов: антисекреторные и цитопротективные средства. Из антисекреторных средств блокаторы Н2 гистаминовых рецепторов не оправдали ожиданных надежд, и к тому же, они значительно уступают ингибиторам протонной помпы (ИПП) при лечении гастропатии [1]. ИПП занимают лидирующую позицию среди средств, используемых при лечении гастропатии, они удобны в применении, эффективны и относительно безопасны [2]. Как показывает анализ литературных сведений, до настоящего времени остаются нерешенными вопросы – какой из ИПП наиболее эффективен при лечении гастропатии и одинаково ли они влияют на механизмы цитопротекции?
При лечении гастропатии, наряду с ИПП применяются цитопротекторы мизопростол, де-нол и сукральфат. Синтетический аналог простагландина Е2 мизопростол был создан специально для профилактики и лечения НПВП-гастропатии. Однако, как показывает практика и литературные сведения, по эффективности мизопростол значительно уступает ИПП, и к тому же не лишен ряда отрицательных качеств, ограничивающих его применение [3].
Что же касается де-нола и сукральфата, то в исследованиях J.R. Malagela и соавт. [4], А.Е. Каратаева и соавт. [5] показана достаточная эффективность де-нола и сукральфата в лечении и профилактике НПВП- гастропатии.
К сожалению, неизученными остаются вопросы сравнительной эффективности этих цитопротекторов, вопросы их взаимодействия с ИПП при комбинированном лечении гастропатии. В этом плане особый интерес представляет изучение эффективности нового цитопротектора пепсана-Р.
Цель исследования: Сравнительное изучение влияние некоторых ИПП, цитопротекторов и их комбинаций на состояние слизистого барьера желудка при индометациновой гастропатии (ИГ).
Материалы и методы: Экспериментальные исследования проводили на белых крысах- самцах смешанной популяции массой 150-200 гр. НПВП гастропатию вызывали путем перорального введения индометацина в дозе 2,5 мг/кг в течение 5 дней [6]. Исследование проводили на 14 группах животных: 1 гр. - интактная; 2 гр.- животные с ИГ; 3 гр. - животные с ИГ без лечения; 4-8 гр. - животные с ИГ получавшие омепразол, рабепразол, де-нол, сукральфат, пепсан- Р. 9-14 гр.составили животные с ИГ получивщие комбинации ИПП и цитопротекторов- омепразол с де-нолом; омепразол с сукральфатом; омепразол с пепсаном- Р; рабепразол с сукральфатом; рабепразол с де-нолом; рабепразол с пепсаном- Р соответственно.
Каждая группа состояла из 6 животных. Препараты вводили per os в виде водной суспензии в течение 10 дней в следующих дозировках: омепразол 50 мг/кг [7], рабепразол 5 мг/кг [8], де-нол 10 мг/кг [9], сукральфат 400 мг/кг [10], пепсан-Р 1500 мг/кг [11]. Состояние слизистого барьера изучали путем определения содержания фракций нерастворимых гликопротеинов (НГП) в суспензии слизистой. Содержание сиаловых кислот определяли по методу Л.И. Линевик [12], фукозы по методу П.Д. Рабиновича и соавт. [13]. Содержание общего белка определяли методом O.H. Lowry и соавт. [14].
Результаты исследования и их обсуждение: Результаты изучения влияния некоторых ингибиторов протонной помпы и цитопротекторов на содержание фракций нерастворимых гликопротеинов в слизистой ткани желудка при индометациновой гастропатии представлены в табл.1.
Как видно из приведенных данных, при ИГ индометацин значительно снижает синтез слизистого барьера и его компонента НГП. У животных этой группы в суспензии слизистой желудка наблюдали снижение содержание сиаловых кислот и фукозы почти в 3 раза, а общего белка более чем в 1,5 раза. При применении омепразола нами установлено, что препарат подавляет синтез НГП. В этой группе наблюдалось снижение содержания сиаловых кислот на 40,6%, фукозы на 39,0% и общего белка на 27,4% от показателей группы без лечения (ИГ+ Н2О). Несколько иного характера действия наблюдали при применении рабепразола. В этой группе препарат оказывал стимулирующий эффект на синтез НГП. Наблюдали увеличение содержания сиаловых кислот на 62,2%, фукозы на 106,9% и общего белка на 35,7%.
Почти такие же результаты получены при лечении ИГ де-нолом. В этой группе в результате проводимой терапии, сиаловые кислоты увеличивались на 87,8%, фукоза на 94,9%, а общий белок на 40,7% от показателей нелеченной группы.
Таблица 1. Влияние некоторых ингибиторов протонной помпы и цитопротекторов на содержание фракций нерастворимых гликопротеинов в слизистой ткани желудка при индометациновой гастропатии
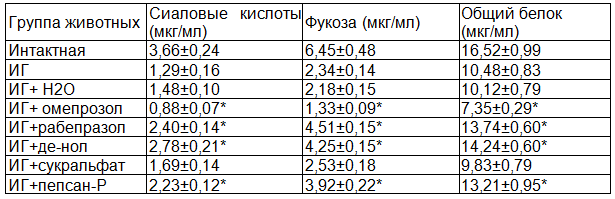
Примечание: * - P<0,05 от показателя группы без лечения (ИГ+ Н2О).
В группе животных леченных сукральфатом наблюдали некоторое увеличение содержание сиаловых кислот, фукозы, снижение общего белка, однако эти результаты недостоверно отличались от результатов группы без лечения.
При лечении пепсаном-Р наблюдали стимулирующий эффект препарата. В этой группе содержание сиаловых кислот увеличивалось на 50,6%, фукозы на 79,8% и общего белка на 30,5%.
Учитывая полученные результаты при проведении монотерапии, особый интерес представлял изучение эффективности комбинированной терапии ИПП с цитопротекторами.
Результаты изучения влияния комбинированного применения омепразола и рабепразола с цитопротекторами на содержание фракций НГП в слизистой ткани желудка при ИГ представлены в табл. 2.
Как видно из представленных данных, при комбинированном применении омепразола и де-нола стимулирующий эффект де-нола практически не проявляется. Поученные результаты почти не отличаются от показателей группы монотерапии с омепразолом. Фармакодинамический эффект омепразола не менялось и при комбинированном применении его с сукральфатом.
Таблица 2. Влияние комбинированного применения омепразола и рабепразола с некоторыми цитопротекторами на содержание фракций нерастворимых гликопротеинов в слизистой ткани желудка при индометациновой гастропатии
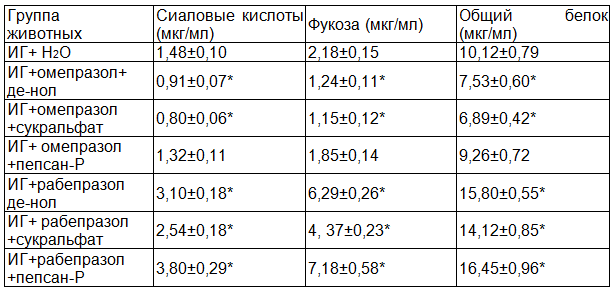
Примечание: * - P<0,05 от показателя группы без лечения.
В группе омепразол с пепсаном-Р содержание сиаловых кислот увеличивалось на 58,0%, фукозы на 39% и общего белка на 26,0% от показателя группы монотерапии с омепразолом. При этом достоверно было только увеличение сиаловых кислот и фукозы. По представленным данным в таблице можно отметить, что в плане стимуляции защитного барьера наилучшим является комбинации цитопротекторов с рабепразолом.
При лечении ИГ комбинацией рабепразола с де-нолом наблюдали синергизм фармакодинамического взаимодействия. В этой группе содержание сиаловых кислот увеличивалось на 109,4%, фукозы на 188,5%, общего белка на 56,0% от показателя группы без лечения. При лечении только рабепразолом увеличение фракций НГП составляло 62,2%, 106,9 и 35,7% соответственно (P<0,05).
При комбинированном применении рабепразола с сукральфатом стимулирующий эффект рабепразола почти не менялся (P>0,05).
Эффективным оказалось комбинированное применение рабепразола с пепсаном-Р . В этой группе фармакодинамический синергизм препаратов было более значительным, чем в группе рабепразола с де-нолом. Содержание сиаловых кислот увеличивалось на 156,7%, фукозы- на 229,3%, общего белка на 62,5% от показателя группы без лечения. Эти результаты были значительно высокими, чем показатели полученные при монотерапии рабепразолом.
Как свидетельствуют полученные нами результаты, ингибиторы протонной помпы омепразол и рабепразол разнонаправленно действуют на синтез НГП. Индуктивный эффект рабепразола аргументированно указывает о превосходстве действия препарата на механизмы синтеза и выработки слизистого барьера, что касается стимулирующего эффекта де-нола на НГП, то необходимо предполагать, что это обусловлено его двумя основными фармакодинамическими эффектами. Во-первых, де-нол образует своеобразный защитный барьер, препятствующий обратной диффузии H+ и способствующий быстрейшему заживлению слизистых повреждений. Во-вторых, он увеличивает локальный синтез простогландина Е2, что способствует стимуляции синтеза слизистого барьера [15]. В литературе существуют разногласия по вопросу влияния сукральфата на синтез НГП. Полученные нами результаты согласуются с данными K. Stiener и соавт. [16], F. Halter [17] и J.C. Soule [18], которые утверждают, что цитопротективные свойства сукральфата обусловлены исключительно его местным «защитным» механизмом. B.L. Slomiany и соавт. [19] в эксперименте установили, что под действием сукральфата содержание НГП в слизистой желудка увеличивается на 19,0%. Однако, другие авторы ставят под сомнение такую точку зрения [20].
В наших исследованиях установлен стимулирующий эффект пепсана-Р на синтез НГП. Вероятно, этот эффект препарата при лечении ИГ обусловлено другими его примечательными свойствами. Как известно, пепсан-Р обладает выраженным антацидным, противовоспалительным и антиоксидантным эффектом [21]. Он ингибирует высвобождение гистамина из тучных клеток в слизистой пищевода и желудка, уменьшая образование тромбоксана А2 и активных форм кислорода и в результате снижается местная воспалительная реакция, несколько угнетается выработка соляной кислоты, улучшается трофика.
Можно предполагать, что фармакодинамический синергизм рабепразола с цитопротекторами обусловлено их однонаправленным действием на нарушенные механизмы синтеза слизистого барьера, а при комбинированном применении омепразола с цитопротекторами разнонаправленным, превалированием фармакодинамического эффекта омепразола и отсутствием синергизма.
Выводы:
- При лечении индометациновой гастропатии ингибиторы протонной помпы и цитопротекторы оказывают на процессы цитозащиты разнонаправленное действие.
- Омепразол снижает, рабепразол, де-нол и пепсан-Р стимулируют, а сукральфат не влияет на синтез слизистого барьера. При совместном применении омепразола с цитопротекторами ингибирующий эффект омепразола не меняется.
- При комбинированном применении рабепразола с де-нолом и пепсаном-Р фармакодинамическое взаимодействие препаратов проявляется аддитивным синергизмом, а при комбинации рабепразола с сукральфатом фармакодинамический эффект не меняется.
