Одной из важных задач, стоящих перед современной медицинской наукой, является оптимизация фармакотерапии.
Концентрация лекарственного средства (ЛС) в плазме крови в основном зависит от активности ферментов (МОС), которые непосредственно участвуют в метаболизме ксенобиотиков [2, 5]. На сегодняшний день хорошо известно, что эффективность и безопасность ЛС зависит от его концентрации в плазме крови. Важное значение при этом имеет поддержание равновесной концентрации ЛС в плазме крови в пределах терапевтического диапазона, что определяет эффективность проводимой терапии.
Печень является основным органом, ответственным для поддержания физико-химического гомеостаза, детоксикации эндогенно-образовавшихся и экзогенно-поступивших в организм ксенобиотиков. Вместе с тем, существует и внепеченочный метаболизм чужеродных соединений. Важное место в этом процессе занимает кишечник [7]. Ключевым ферментом МОС является цитохром Р-450. От функциональной активности проферментов системы цитохрома Р-450 слизистой оболочки кишечника определяется фармакотерапевтический эффект большинства поступивших через желудочно-кишечный тракт лекарственных препаратов [3, 5, 11]. В настоящее время у человека идентифицировано 58 форм цитохрома Р-450, в метаболизме ксенобиотиков участвуют 12 из них, причем за биотрансформацию более 75% ЛС ответственны формы CYPs3A4, 2D6, 2E1 и 2C9/10/19 [12]. Изофермент CYP3A4 принимает участие в биотрансформации более 45% всех применяемых в настоящее время ЛС, катализируя I фазу биотрансформации. Около 60% CYP3A4 локализовано в эндоплазматическом ретикулуме гепатоцитов, а более 30% - в энтероцитах тонкой кишки. Следует отметить, что именно CYP3A 4 занимает первое место среди других изоферментов цитохрома Р-450 по содержанию как в гепатоцитах, так и в энтероцитах [7].
Активность CYP3A4 в организме человека можно определить по концентрации метаболита в крови, который образуется из введенного ранее ЛС. Эти ЛС называются маркерными субстратами.
В настоящее время остается невыясненным роль монооксигеназ в слизистой оболочке кишечника в патогенезе неспецифического язвенного колита (НЯК) и назначении на этом фоне ЛС.
Цель исследования: целью наших исследований явилось оценить состояние активности ферментов МОС, а имменно системы цитохрома Р-450 в слизистой оболочке кишечника при хроническом язвенном поражении толстой кишки (ХЯПТК).
Материалы и методы. Опыты проводили на 40 белых крысах-самцах смешанной популяции, массой 180–220 г (виварий Ташкентской Медицинской Академии). Животные получали полноценный общевиварийный рацион и воду ab libitum. Согласно условиям опыта животных разделили на 5 групп: 1 группа - животные с ХЯПТК – контрольная группа; 2 группа – внутрижелудочное введение суспензии салофалька в дозе 1 мг/100г массы животных с ХЯПТК; 3 группа – внутрижелудочное введение суспензии салофалька и преднизолона в дозе по 1 мг/100г массы животных с ХЯПТК; 4 группа - внутрижелудочное введение суспензии салофалька и преднизолона в указанных дозах, как в 1 и 2 группах и, с последующим, через 1 ч введением суспензии лакто-G, из расчета1 мг/100г массы животных с ХЯПТК; 5 группу составили интактные (здоровые) животные.
Препараты салофальк, преднизолон и лакто-G вводили в течение 10 суток подряд, после воспроизведения у животных ХЯПТК.
ХЯПТК воспроизводили по методу Н.Х.Абдуллаева [1]: перорально зондом с оливкой вводили 1% водный раствор фенола в дозе 3 мг/100г массы животного в течение 90 дней по схеме: 30 дней – ежедневно, 20 дней – через день, 20 дней – 2 раза в неделю, 20 дней – 1 раз в неделю. На 90 день процесс переходит в хронический.
Количество животных в группах составляло по 8 особей. Все болезненные процедуры выполняли согласно Хельсинской декларации о гуманном отношении к животным.
Для оценки в кишечнике активности изофермента цитохрома Р-450 CYP3A4 использовали как маркерный субстрат препарат фталазол (фталилсульфатиазол), который является пролекарством. Как известно, фталазол медленно всасывается из желудочно-кишечного тракта. Основная масса препарата при введении внутрь задерживается в кишечнике, где постепенно происходит отщепление активной (сульфаниламидной) части молекулы и в результате образуется активный метаболит сульфатиазол (норсульфазол) [5]. Каждой группе животных внутрижелудочно однократно вводили 1% суспензии фталазола в дозе 5 мг/100г массы животного. Через час брали кровь для получения сыворотки и определения в ней свободного норсульфазола.
Концентрацию норсульфазола в сыворотке крови определяли на жидкостном хроматографе модель: «HPLC», Китай, методом В.Д. Шатц и О.В. Сахартова [9]. По уровню концентрации норсульфазола в крови мы определяли активность CYP3A4 в кишечнике.
Кроме того, мы исследовали количественный уровень микросомальных цитохромов слизистой кишечника и, следовательно, активность МОС кишечника при ХЯПТК. В микросомах, выделенных из слизистой оболочки кишечника (СОК), определяли: общее содержание цитохрома Р-450 и В5 по методу T. Omura и R. Sato [15], активность никотинамиддинуклеотидфосфат -цитохром-С-редуктазы (НАДФН-цит.-С-ред) – по W. Williams, H. Kamin [17], микросомальных ферментов –N-диметилазы амидопирина (N-АП) – по S. Bast [10], анилингидроксилазы (АГ) - по А.И. Арчакову и соавт. [3], глюкозо -6-фосфатазы (Г-6-фазы) – по Chosh N.C., N.C. Kar [16], микросомального белка (м/б) – по O.H. Lowry и соавт. [13].
В последние годы для базисного лечения больных с хроническим неспецифическим язвенным колитом (ХНЯК) широко применяют cульфасалазин или препараты 5-АСК. В качестве вспомогательной терапии назначают иммуносупрессоры, топические глюкокортикостероиды, иммуномодуляторы различных классов [4, 8]. Среди множества этих препаратов особое место занимают препараты поддерживающие нормальное функционирование кишечной микрофлоры. Рациональность использования про-, пре- и синбиотиков основано на фактах вовлечения кишечных бактерий в патогенез этого заболевания [6].
Вместе с тем, в литературе практически отсутствуют данные о механизмах их влияния на процессы биотрансформации ксенобиотиков и активность микросомальных ферментов (МФ) в кишечнике при язвенном поражении толстой кишки. Все это послужило основанием для проведения настоящего исследования.
Результаты и обсуждение. В группе животных с ХЯПТК отмечается существенно сниженное содержание в сыворотке крови концентрации норсульфазола на 41,7% (Р<0,01) по сравнению с данными в контроле (рис. 1). Следовательно, среди важных причин в механизме формирования ХЯПТК у экспериментальных животных является угнетение активности ферментов микросомальной системы СОК. Снижение их активности ведет к процессам торможения биопревращения фталазола в норсульфазол, его всасывания и транспорт в общий кровоток. В наших исследованиях это проявляется уменьшением концентрации норсульфазола в сыворотке крови.
Анализ полученных результатов показал, что активность цитохрома Р-450 и В5 в выделенной из слизистой оболочки толстого кишечника была ниже, чем в контроле на 44,3 и 48,1% (Р<0,001), а активность микросомальных ферментов N-АП и АГ на 42,1 и 55,0% (Р<0,001). Среди причин, в механизме снижения экспрессии Р-450, В5, активности N-АП и АГ можно рассматривать угнетение активности ферментов: НАДФН-цит.-С.-ред. на 51,1% (Р<0,001), главного лимитирующего фактора НАДФН - зависимой электронтранспортной цепи в системе цитохрома Р-450 и Г-6-Фазы – на 50,1% (Р < 0,001), основного фермента гликолиза и обеспечения микросом энергией связи (табл. 1).
Животным 2-группы в качестве базисного препарата давали салофальк. Салофальк относится к препаратам 5-аминосалициловой кислоты (5-АСК). Действующее вещество данного препарата является месалазин.
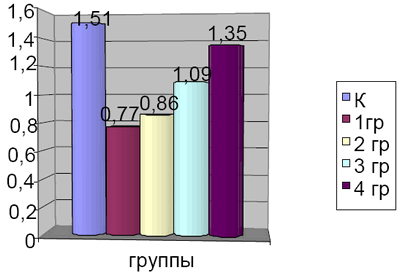
Рис. 1. Содержание норсульфазола в сыворотке крови животных в исследуемых группах (٭ - Р<0,05 по отношению к контролю).
Анализ результатов исследований показал, что десятидневное введение салофалька животным с патогенетической моделью ХЯПТК, количественное содержание норсульфазола в сыворотке крови практически оставалось в пределах тех значений, которые выявлены в группе животных ХЯПТК (рис. 1). Также не изменились по сравнению с 1 группой и показатели системы микросомального окисления в СОК– цитохром Р-450, В5, НАДФН-цит.-С.-ред., N-АП, АГ, Г-6-Фазы и содержание микросомального белка (табл. 1). При дополнительном к салофальку введении преднизолона в дозе 1мг/кг в течение 10 суток, существенно увеличилась концентрация норсульфазола по сравнению с 1 и 2 группой на 35,8 и 27,8% (Р<0,001 и 0,01), а также содержания цитохромов Р-450 – на 23,8 и 18,0% (Р<0,001 и 0,01), В5 на 28,6 и 20,0% (Р<0,001 и 0,01), активность ферментов НАДФН-цит.-С-ред. – на 25,3 и 21,4% (Р<0,001 и 0,01), N-АП – на 17,9 и 13,1% (Р<0,001 и 0,01), АГ – на 44,4 и 30,0% (Р<0,001 и 0,01), Г-6-Фазы – на 21,9 и 15,9% (Р<0,001 и 0,01), микросомального белка – на 11,9 и 11,1 (Р<0,001 и 0,01). В то же время несмотря на существенный позитивный эффект по сравнению с 1 и 2 группой животных, сочетанное применение салофалька с преднизолоном не восстанавливали до контрольных значении содержание норсульфазола в крови. Отсутствие ожидаемого эффекта восстановления до контрольных значений было обусловлено, возможно, как недостаточной дозой препарата, в кратности его введения, так и особенностью состояния развивающегося у животных ХЯПТК. Об этом свидетельствуют данные, что у 2 (25%) животных уровень норсульфазола и активность МФ, как к концу опыта, были в пределах контроля, у 3(37,5%) животных содержание норсульфазола было ниже контроля на 16,3%, а МФ – на 18,1%. У оставшихся 3 (37,5%) животных уровень норсульфазола и активность ферментов микросомального окисления было ниже контроля на 29,4 и 31,1%. Анализируя полученные данные, можно придти к заключению, что среди возможных причин неудовлетворительных результатов лечения больных с воспалительными заболеваниями толстой кишки при назначении базисной терапии, в том числе при назначении кортикостероидных препаратов, лежат процессы, связанные с недостаточным их действием на активность ферментов системы цитохрома Р-450 СОК. Все это обусловливает поиска новых подходов к решению проблемы, разработке тактики лечения больных с хроническими язвенными колитами. В этом плане представляет интерес сочетанное назначение салофалька, преднизолона и синбиотика лакто-G. С действием про-, пре- и синбиотиков связано улучшение функционирования кишечника и стимуляция иммунной системы [5, 6]. Особенностью применения синбиотика лакто-G, явилось содержание большого комплекса пробиотиков-живых микроорганизмов и селективной основы пребиотика- фруктоолигосахаридов.
Анализ полученных данных показал, что комбинация лакто-G с салофальком и преднизолоном существенно увеличивает концентрацию норсульфазола в крови у животных с ХЯПТК, по сравнению со 2 и 3 группами животных – на 51,5 и 18,6% (Р<0,001 и 0,05), содержание в микросомах слизистой оболочки толстого кишечника цитохромов Р-450 на 39,1 и 17,9% (Р<0,002 и 0,05), В5 – на 40 и 16,7% (Р<0,001 и 0,05), активности ферментов НАДФН-цит.-С-ред. – на 46,8 и 20,9% (Р<0,001 и 0,05), N-АП – на 36,4 и 20,5% (Р<0,01 и 0,05), АГ – на 55 и 19,2% (Р<0,001 и 0,05), Г-6-Фазы – на 48,5 и 28,2% (Р<0,001 и 0,01), микросомального белка – на 19,7 и 7,1 (Р<0,05 и 0,05). Следовательно, полученные данные указывают, что лакто-G обладает синергическим эффектом – направленным на усиление фармакологического действия преднизолона способствующим повышению функциональной метаболической активности МОС в слизистой оболочке толстого кишечника при его язвенном поражении. Вместе с тем, как видно из рисунка и таблицы даже комбинация лакто-G с преднизолоном и салофальком к концу определенного нами 10 суток срока опыта исследуемые показатели – содержания норсульфазола и активности микросомальных ферментов не достигали таковых значении контроля. Только у 4 (50%) животных из этой группы отмечен эффект восстановления уровня норсульфазола в сыворотке крови и активность ферментов микросом в слизистой оболочке толстой кишки. В остальных случаях эти показатели были еще существенно ниже, чем в контроле.
Таблица 1. Динамика влияния МФ в толстом кишечнике в исследуемых группах животных с ХЯПТК на фармакологическое действие лекарственных препаратов по сравнению с контролем, М±m
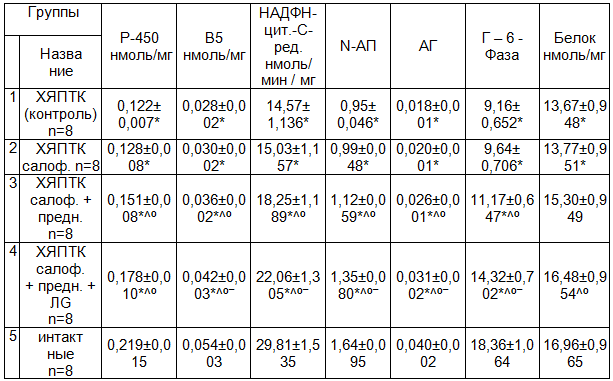
Примечания: * - P<0,05 по сравнению с контролем; º - P<0,05 по сравнению со 2-гр; ^ - P<0,05 по сравнению с 1-гр; ‾ - P<0,05 по сравнению с 3-гр.
Таким образом, проведенные исследования показали, что язвенные поражения слизистой оболочки толстого кишечника сопровождаются глубокими нарушениями в ней активности МФ, что может быть одной из причин формирования патологического очага в этом органе. Угнетение активности МФ создает условия дисметаболическим процессам в тканях слизистой оболочки толстой кишки, снижению его барьерной и антитоксической функции, как следствие воспаления и создания условии для усиления проницаемости в системный кровоток токсических веществ, оказывающих патогенное влияние на формирующее полиорганную дисфункцию и поддерживающих патологический процесс в пораженном кишечнике. Комбинация введения лакто-G с салофальком, и преднизолоном оказывают выраженный эффект повышения функциональной метаболической активности ферментов МОС слизистой оболочки толстого кишечника при его язвенном поражении. Вместе с тем, выявленная связь активности ферментов МОС с уровнем норсульфазола в сыворотке крови еще раз подтверждает о высокой прогностической и диагностической значимости теста, его определения для оценки антитоксической функции кишечника, а следовательно разработке новых подходов лечения больных с ХНЯК.
Выводы
- ХЯПТК сопровождается угнетением активности ферментов микросомального окисления в слизистой оболочке толстого кишечника, что также подтверждается и данными статистически значимого определения в сыворотке крови норсульфазола при внутрижелудочном введении животным фталазола.
- Различный уровень норсульфазола в сыворотке крови у животных с ХЯПТК и активности ферментов МОС в тканях слизистой оболочки толстой кишки при введении лакто-G с салофальком и преднизолоном подтверждает, что тест фталазолом может служить дополнительным критерием оценки эффективности проводимой терапии и антитоксической функции толстого кишечника при его язвенном поражении.
