Введение. В ХХ веке в экспериментах на собаках был разработан способ успешного удаления печени. Выяснилось, что первые 3-8 ч после экстирпации печени животные чувствуют себя удовлетворительно, но затем развивается гипогликемия, и собаки быстро погибают. Если им вводить парентерально раствор глюкозы из расчета 0,25-0,5 г/кг, а также раствор фруктозы, то гипогликемия устраняется. Через 20-40 ч, несмотря на продолжающееся введение глюкозы, животное впадает в кому и погибает в течение 1-2 ч, на фоне тахикардии, артериальной гипотонии и дыхания Чейн-Стокса. При биохимическом исследовании в период комы содержание мочевины в сыворотке крови и в моче, а также альбумина, фибриногена и протромбина в сыворотке крови снижается, а содержание азота в сыворотке крови и в моче, неконъюгированного билирубина и мочевой кислоты в сыворотке крови повышается [1, 4].
Одно из направлений учения о печеночной недостаточности начало формироваться во второй половине XIX в., когда в Военно-медицинском журнале появилось сообщение о новой операции, технику порто-кавального анасмоза в эксперименте была выполнена на собаках. Публикация осталась незамеченной, возможно потому, что автор не попытался обосновать ее физиологического значения [2, 6].
Истинный смысл этого эксперимента оценили лишь в конце 80-х годов прошлого столетия. У собак с подкожной фистулой наблюдалась картина мясного отравления. После мясного завтрака они вели себя необычно, некоторые из них впадали в кому. Повторное поедание мяса приводило к их гибели [3].
Таким образом, впервые было правильно оценено значение шунтирования печени: при непосредственном поступлении портальной крови в общий кровоток, минуя печень. Эта работа также не была по достоинству оценена современниками [1, 5].
Лишь 20 лет спустя в эксперименте были получены аналогичные результаты. В дальнейшем они послужили основанием для выделения специальной разновидности печеночной комы, позднее названной портально-печеночной комой, или порто-системной энцефалопатией [1, 2].
В последней четверти ХIХ века было установлено, что, наряду с аммиаком, токсическое влияние на головной мозг оказывают и другие вещества энтерогенного происхождения - фенолы, аминокислоты (фенилаланин, триптофан, тирозин, метионин), жирные кислоты с короткой цепью, меркаптаны и эндотоксины [3, 4].
Роль печени очень важна в обмене лактата. Хотя значительное количество лактата синтезируется в печени, другая часть молочной кислоты поступает из органов брюшной полости. К молочно-кислому ацидозу может привести кислородная задолженность тканей, возникающая при нарушенной микроциркуляции. Выраженная гиперлактатемия (свыше 7,2 ммоль/л) существенно ухудшает прогноз печеночной недостаточности [1, 6].
В середине 60-х годов ученые предположили, что в основе собственно печеночно-клеточной недостаточности лежит активация побочной реакции превращения пировиноградной кислоты в ацетоин и бутиленгликоль, связанная с падением производства кофермента А [5, 6].
В 70 годах ХХ века была выдвинута гипотеза о том, что в основе большой печеночной недостаточности лежит нарушение цикла Кребса - жизненно важной функции печени. По-видимому, печень может превращать три- и дикарбоновые кислоты в аминокислоты, жирные кислоты и глюкозу, поддерживая необходимый организму уровень каждого из них [4].
В 60-70-х годах в изучении проблемы печеночной недостаточности наметилось два направления. Одни исследователи считали, что в основе большой печеночной недостаточности (гепатогенная энцефалопатия) лежит потеря способности печени нейтрализовать токсичные вещества, поступающие из кишечника.
Основная токсическая роль отводится аммиаку, накоплению в организме ложных нейротрансмиттеров, синергической интоксикации жирными кислотами с короткой цепью [2].
Механизмы нарушения клеточного гомеостаза печени при механической желтухе имеют сложный характер, несводимый к действию одного или нескольких факторов. Современные представления о механизмах повреждения гепатоцитов при механической желтухе связаны с двумя основными факторами: развитием желчной гипертензии и повышением концентрации желчных ингредиентов внутри протоковой системы. Первое приводит к нарушениям органного кровотока и расстройствам микроциркуляции, второе, за счет детергентного действия желчных кислот, в частности - к запуску процессов свободнорадикального окисления липидов биомембран. Процесс носит «лавинообразный» характер. Повышение внутриорганного гидростатического давления при холестазе постепенно распространяется на печеночную ткань и сосуды различного калибра. По мнению некоторых авторов, при холестазе возникает резкий перепад давления в желчной системе, а наличие высокого градиента с внутриклеточным давлением гепатоцита вызывает повреждение мембран лизосом и выход гидролитических ферментов в цитоплазму. Это в конечном итоге приводит к распаду клеточных структур, некрозу гепатоцитов и расширению зон желчестаза [3, 6].
До последнего времени особенности патогенеза печеночной недостаточности оставались неясными. В настоящее время возникает предположение, что важное значение имеет прекращение поступления желчных кислот и, возможно, желчных пигментов в кишечник. Это сопровождается нарушением всасывания жирорастворимых веществ и резкой активизацией бактериальной флоры. В результате этого быстрее всасывается эндотоксин — липополисахарид, продукт грамотрицательных микробов и погибших бактерий. Эндотоксины в высокой концентрации повреждают в первую очередь синусоидальные клетки печени. Повреждение этих клеток резко повышает чувствительность гепатоцитов к эндотоксину. В эксперименте на животных при молниеносном гепатите сначала гибнут синусоидальные клетки, а позднее — гепатоциты [1, 3, 5.].
Материал и методы. Клинические исследования основаны на анализе результатов обследования и хирургического лечения 76 больных с патологией билиопанкреатодуоденальной зоны (БПДЗ), осложненной внепеченочным холестазом (ВХ).
Для оценки эффективности дооперационной подготовки проведен анализ данных в основной группе (ОГ) и группе клинического сравнения (ГКС). Структура патологии БПДЗ в ОГ и ГКС представлена в табл. 1.
Таблица 1. Структура заболеваний БПДЗ в группах сравнения
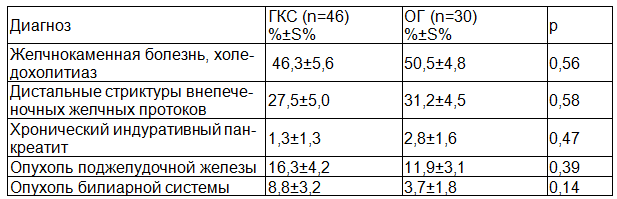
Установлено, что сравниваемые группы больных сопоставимы по характеру разных заболеваний и новообразований БПДЗ (р>0,05).
Математическая обработка результатов исследований проводили с помощью пакета прикладных программ «Statistiсa 6.0» на персональном компьютере. Значимость различий качественных показателей определяли с помощью критерия c2 и двухстороннего точного метода Фишера для четырехпольной таблицы. Относительные величины, выраженные в процентах, приводили в тексте с ошибкой процента. Степень отличий считали значимой при р<0,05.
Результаты и обсуждение. Для оценки эффективности дооперационной подготовки больных сформированы две клинические группы больных. Группу клинического сравнения (ГКС) составили 46 больных и основную группу (ОГ) составили 30 больных, обе группы больных были сопоставимы по характеру патологии БПДЗ, полу, возрасту, степени выраженности желтухи (уровню средних значений показателей общего билирубина, АЛТ, АСТ) (р>0,05).
У большинства больных до операции выявлены нарушения тех или иных функций печени. Высокий уровень трансаминаз АлАТ и АсАТ, свидетельствующий о нарушении структуры гепатоцитов вследствие желчной гипертензии. Имело место также нарастание непрямой фракции билирубина у больных, что, по мнению А.И. Хазанова, является прогностически неблагоприятным признаком. Клинические проявления печеночной недостаточности определены у 19,7% пациентов. Они были разнообразными: адинамия, нарушения сна, памяти, потеря в весе, отсутствие аппетита, диспепсические расстройства, слабость. У некоторых больных нарушения моционально-психической сферы выражались в эйфории, отсутствии критической оценки своего состояния, психозах. При объективном осмотре обращало на себя внимание наличие множественных кровоизлияний в местах инъекций, у многих больных отмечались носовые, маточные кровотечения. Изучение показателей крови, прежде всего индикаторов гепатодепрессии, о которых уже шла речь выше, выявило у больных с клиникой печеночной недостаточности по сравнению с теми, у кого она отсутствовала, более грубые изменения, причем различия оказались статистически значимыми (р<0,05).
Применяли управляемую гемодилюцию с форсированным диурезом, в тяжелых случаях — гемосорбцию, лимфосорбцию. При сохраняющейся желчной гипертензии эффект, естественно, был ниже, но отмечалось снижение уровня билирубина, мочевины, значительно уменьшался кожный зуд. Проводилась так называемая печеночная терапия. Гормоны до операции назначали в исключительных случаях, при тяжелой печеночной недостаточности, так как, по мнению многих авторов, применение их более целесообразно и оправдано в послеоперационном периоде. Интенсивная предоперационная подготовка привела к купированию клинических проявлений печеночной недостаточности, улучшению биохимических показателей.
Оперативное вмешательство, кровопотеря, быстрая разгрузка желчных путей приводят к временной депрессии функций печени, а у больных с уже имеющейся печеночной недостаточностью — к ее углублению [2, 4].
В связи с этим решающая роль в послеоперационном периоде отводилась мероприятиям, направленным на профилактику и лечение печеночной недостаточности. Была продолжена гемодилюция с форсированным диурезом, в особо тяжелых случаях прибегали к гемосорбции. В условиях декомпрессии желчных путей ее действие было значительно эффективнее, чем в дооперационном периоде, что было видно по динамике биохимических и иммунологических показателей, контролю которых придавали большое значение.
Послеоперационная печеночная недостаточность, как прогрессирующая дооперационная, так и развившаяся после вмешательства, наблюдалась у 15,4% больных. Она возникала в первые 3-5 сут после операции, чаще у больных с длительным и интенсивным холестазом. Решающим фактором в этиологии ее следует считать предоперационные нарушения функций печени, операция лишь ускоряет развитие осложнения. Спровоцированные операционной травмой, кровопотерей, наркозом, декомпрессией желчного дерева они прогрессировали. Одной из главных предпосылок было наличие гнойного холангита. Наши данные совпадают с литературными: печеночная недостаточность возникла в большинстве случаев у больных с длительной желтухой. Развитию острой печеночной недостаточности у больных способствовали гнойно-септические осложнения. Клиническую картину послеоперационной недостаточности печени определяли симптомы интоксикации: резкая заторможенность, нередко психоз, тахикардия, коллапс, гипертермия. С развитием гепатодепрессии или прогрессированием ее усиливались желтуха, геморрагический синдром, снижался диурез, у некоторых больных появлялся асцит, уменьшалось или прекращалось желчеотделение по дренажам, желчь становилась белой. Ухудшались по сравнению с дооперационными показатели общего белка, альбуминов, протромбинового индекса, трансаминаз, повышался уровень непрямого билирубина, мочевины.
Высокий процент нарушений различных функций печени у больных с механической желтухой диктует необходимость профилактики послеоперационной печеночной недостаточности. Особая роль здесь отводится внутрипортальным инфузиям, позволяющим снизить вероятность развития этого грозного осложнения. В состав инфузата входили 5%-й раствор глюкозы, витамины, белковые препараты, гепатопротекторы.
Летальный исход от печеночной недостаточности наступил у 3,8±2,2% больных ГКС. В ОГ летальных исходов не было.
Заключение. Таким образом, печеночная недостаточность осложняет механические желтухи в 11,7% до операции и в 15,4% — в послеоперационном периоде. В профилактике и лечении этого осложнения чрезвычайно важную роль играет наряду со своевременностью и оптимальностью оперативного вмешательства активная дооперационная подготовка с применением всех доступных методов детоксикации и активная инфузионная терапия в послеоперационном периоде.
