Введение. Со времен Гиппократа до наших дней оптимальным доказательством правильности разработанных теоретических положений о патогенезе заболевания, методах ее диагностики и стратегии лечения является эффективность последнего (принцип «ex juvantibus»). С этих позиций, лучшим обоснованием участия Helicobacter pylori в развитии и/или прогрессировании сердечно-сосудистых заболеваний является результативность эрадикационной терапии, обеспечивающей полноценную деконтаминацию слизистой оболочки желудка по изучаемому микроорганизму [1-3].
Поэтому логично, что мысль о возможности применения подобного подхода для уточнения наличия связи хеликобактерной инфекции и кардиоваскулярной патологии была высказана почти сразу после постановки M.A. Mendall et al. (1994) данной проблемы [цит. по 10].
Так, уже в работе B.C. Delaney et al. (1996) была показана одна из первых попыток реализации этой идеи, не подтвердившая ценность проведения эрадикационной терапии в снижении кардиоваскулярного риска [4]. В дальнейшем актуальность этих сведений была подчеркнута в проблемной статье R. Pellicano et al. (2003), который трактовал подобный аспект как наиболее перспективный в решении центрального вопроса проблемы [3].
В конце XX – начале XXI века в зарубежной литературе появился ряд обзоров, обобщающих результаты применения эрадикационной терапии у больных кардиологического профиля [5-7], причем их авторы пришли к противоположным заключениям. В частности, Z. Grabczewska и E. Nartowicz (1999), анализируя сведения двух польских работ, посвященных применению антибиотиков (азитромицин, рокситромицин) как фактора вторичной профилактики острых коронарных синдромов у пациентов, перенесших инфаркт миокарда либо эпизод нестабильной стенокардии, показали значительное снижение частоты рецидивных инцидентов [8]. M. Kowalski et al. (2001) в плацебо-контролируемом исследовании подтвердили значимость удаления микроорганизма из слизистой оболочки желудка в предупреждении повторного развития коронарной недостаточности после выполнения перкутанной коронаропластики (риск его возникновения 22% vs 41%) [9]. Механизмом подобного эффекта авторы считают устранение системного хронического воспаления, а также торможение синтеза и высвобождения провоспалительных цитокинов.
В то же время затруднительным является и вопрос неинвазивного контроля эффективности эрадикации Helicobacter pylori, т. к. наиболее часто для этой цели в клинической практике применяется определение уровня антихеликобактерных антител, в то время как арсенал иных диагностических технологий включает лишь быстрый уреазный тест и некоторые др. [1, 10]. Ранее нами показано, что кристаллогенные свойства биологических жидкостей при язвенной болезни существенно трансформируются [11, 12], причем эти изменения касаются не только сыворотки крови, но и слюны пациентов, исследование которой служит базисом инновационной диагностической технологии – саливадиагностики [13, 14]. Физико-химическая сущность кристаллосаливадиагностики представляет собой определение характера влияния изменений качественного и количественного состава слюны рассматриваемого контингента пациентов при сочетанной патологии и ее коррекции путем различных схем лечения на один из новых параметров гомеостаза данной биологической жидкости – ее кристаллостаз (кристаллогенную стабильность) [14, 15].
В наших предыдущих публикациях было показано, что верификацию эффекта эрадикационной терапии при сочетании ишемической болезни сердца и язвенной болезни можно осуществлять на основании динамики симптомов основного заболевания [16], однако значительно более надежной является оценка метаболических параметров, к числу которых и относится исследование кристаллогенных свойств слюны.
В связи с этим целью работы служило исследование преобразования характера дегидратационной структуризации слюны пациентов с ишемической болезнью сердца (ИБС) в сочетании с язвенной болезни (ЯБ) в динамике эрадикационной терапии.
Материалы и методы. Под наблюдением находились 112 больных ИБС с сочетанием ЯБ (89 мужчин и 23 женщины; средний возраст – 57,2±3,1лет). Пациенты первой основной группы (n=81) получали стандартную антихеликобактерную терапию первой линии в соответствии с Маастрихтским консенсусом-3 (2005) в течение 14 дней [1, 5]. Пациенты второй основной группы (n=31) получали только антисекреторную терапию (омез 20 мг 2 раза в день). Группу сравнения составили 20 практически здоровых людей, у которых было верифицировано отсутствие гастродуоденальной патологии.
Изучение кристаллогенной и инициирующей активности слюны осуществляли по методу тезиокристаллоскопии, для описания кристаллограмм и тезиграмм использовали собственную систему полуколичественных параметров [17, 18].
Статистическую обработку проводили с помощью пакета программ Statistica 6.0.
Результаты и обсуждение. Установлено, что до начала эрадикационной терапии фации слюны пациентов обеих основных групп характеризовались низким кристаллогенным потенциалом (кристаллизуемость 0,48±0,24 усл. ед., в норме – 2,16±0,18 2,31±0,24 усл.ед.; p<0,05), преобладанием одиночно-кристалических элементов (индекс структурности 1,13±0,22 усл.ед., в норме – 2,31±0,24 усл.ед.; p<0,05), высокой степенью их деструкции и снижением четкости краевой белковой зоны (рис. 1) по сравнению с практически здоровыми людьми.
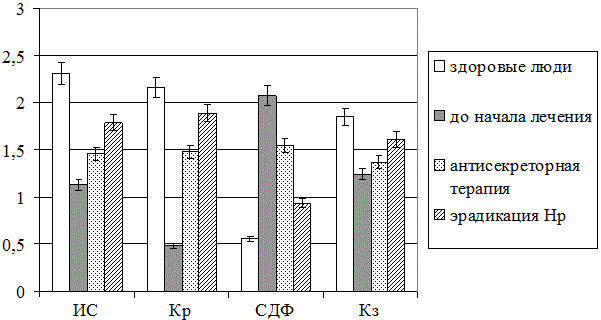
Рис. 1. Результаты визуаметрического анализа смешанной слюны в норме и в динамике лечения ИБС в сочетании с язвенной болезнью
Это косвенно указывает на значительные вариации компонентного состава и, следовательно, физико-химических свойств изучаемой биожидкости при рассматриваемой сочетанной патологии сердечно-сосудистой патологии и желудочно-кишечного тракта.
На основании проведенных изысканий также выявлено, что проведение полноценной эрадикации способствовало нормализации кристаллогенной активности биожидкости, что нашло отражение в соответствующих преобразованиях ее свободного кристаллогенеза, сопровождаясь нарастанием количества дендритных элементов и снижением степени деструкции структур слюны (p<0,05 по всем основным показателям). Использование только антисекреторной терапии демонстрирует аналогичные, по менее выраженные тенденции, что косвенно подтверждает наличие лишь частичного восстановления качественного и количественного состава биосубстрата при этом варианте лечения.
Аналогичные тенденции были выявлены и при исследовании инициированного 0,9% раствором хлорида натрия кристаллогенеза ротовой жидкости пациентов (рис. 2). Так, проведение только антисекреторной терапии способствовало лишь частичной нормализации инициаторного потенциала изучаемого биологического субстрата, тогда как осуществление полноценной эрадикационной терапии приводило к максимальной оптимизации тезиграмм слюны. Это наиболее четко просматривается в отношении тезиграфического индекса, кристалличности фации биосреды и степени деструкции формирующих ее структурных элементов.
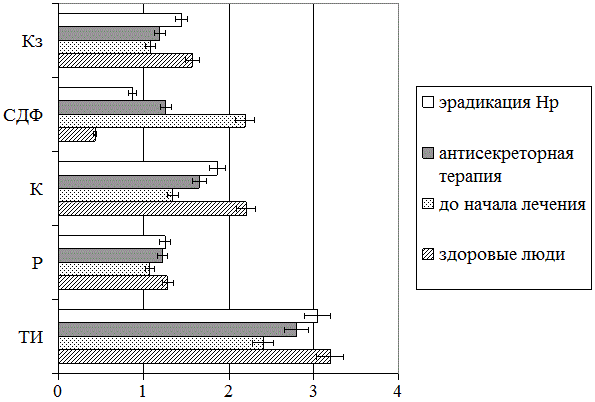
Рис. 2. Анализ инициированного кристаллообразования ротовой жидкости больных ИБС с сочетанием ЯБ (I и II групп) и практически здоровых людей (группа сравнения)
Заключение. Таким образом, на основании проведенных исследований показана информативность кристаллосаливамониторинга при оценке эффективности медикаментозного лечения сочетанной патологии. Эта технология позволяет оптимизировать полноценность эрадикационной терапии, дополнительно обладая экспрессностью, простотой исполнения, экономичностью. Несомненным достоинством предлагаемого метода также служит его неинвазивность.
В целом, проблема участия Helicobacter pylori в патогенезе кардиоваскулярной патологии далека от своего решения [1, 6, 10]. Данные сероэпидемиологических исследований, а также попытка эмпирического ответа на рассматриваемый вопрос не дают возможности составить однозначное мнение, однако изучение биологических свойств бактерии и характера взаимодействия в системе «микроорганизм — макроорганизм» позволяют сформировать единую гипотетическую схему комплексного патогенеза Нр-ассоциированной дисфункции сердца и сосудов, которая нуждается в дальнейшей проверке, обосновании и уточнении [10].
