Актуальность. Портальная гастропатия (ПГ) - это термин, используемый для описания характерных изменений слизистой оболочки желудка (СОЖ) при портальной гипертензии. Характерными для ПГ являются мелкие красные точки на СОЖ диаметром менее 1 мм либо отдельные, либо сливающиеся; вишнёво-красные пятна диаметром более 2 мм и чёрно-коричневые пятна, являющиеся следствием внутрислизистых геморрагий [9].
При наличии цирроза печени (ЦП) у 50% пациентов в течение 3,85 лет развивается ПГ, тогда как у 26% пациентов с уже имеющейся ПГ развивается более тяжелая стадия поражения СОЖ [12].
Для определения степени тяжести ПГ предложена классификация, выделяющая легкую и тяжелую степень поражения. Для ПГ легкой степени были характерны: мелкие розовые пятна или скарлатиноподобная сыпь; покраснение слизистой оболочки преимущественно на поверхности складок в виде полос; зоны возвышающейся отёчной слизистой оболочки красного цвета, разделённые тонкой белой сетью. При ПГ тяжелой степени отмечались как находки в виде отдельных красных пятен (похожих на вишнёво-красные пятна при эзофагите), так и диффузные изменения с геморрагическим компонентом [18]. Тяжелое течение ПГ ассоциируется с более высокой смертностью, при этом средняя продолжительность жизни пациента с тяжелой ПГ составляет 77,6±9,6 месяцев [14].
Следует отметить, что диагностика ПГ и связанных с ее развитием субклинических кровотечений сложна из-за малосимптомного течения, противоречивы данные о патогенетических факторах данного состояния. При этом ранняя диагностика и прогнозирование развития тяжелой степени ПГ являются определяющими для своевременного назначения рациональной терапии и увеличения продолжительности жизни пациента с хроническим заболеванием печени (ХЗП).
Цель исследования. Оценить прогностическое значение факторов, влияющих на степень тяжести ПГ у пациентов с ХЗП.
Материалы и методы. В работе обобщены результаты обследования 64 пациентов с ХЗП – 36 мужчин (56,25%) и 28 женщин (43,75%) в возрасте от 21 до 89 лет (средний возраст 52,38±1,71 года), из них 61 пациент с ЦП и 3 пациента с хроническим гепатитом (ХГ). Пациентам выполнялись общеклинические исследования, иммунологические исследования, фиброгастродуоденоскопия (ФГДС), ультразвуковое исследование (УЗИ) органов брюшной полости с допплерографией, мультиспиральная компьютерная томография органов брюшной полости по показаниям.
По результатам эндоскопического исследования у всех пациентов выявлены признаки ПГ.
Биометрический анализ осуществлялся с использованием пакетов STATISTICA-6, Microsoft Excel. Средние выборочные значения количественных признаков приведены в тексте в виде M±SE, где M – среднее выборочное, SE – стандартная ошибка среднего. Для оценки связи изучаемых факторов и результативных признаков рассчитывались значения информационной статистики Кульбака (2I –статистика), которая рассматривается как непараметрический дисперсионный анализ. Для сравнения числовых данных двух независимых групп использовался U-критерий Манна-Уитни.
Результаты и обсуждение. Для определения характерных клинических, морфологических и функциональных особенностей при эрозивно-язвенном поражении верхних отделов желудочно-кишечного тракта на фоне ХЗП по результатам эндоскопического обследования были выделены группы пациентов с ПГ легкой и тяжелой степени. Первую группу составили 42 пациента (65,63%) с ПГ легкой степени, вторую группу - 22 пациента (34,37%) с ПГ тяжелой степени. Частота выявления ПГ тяжелой степени согласно литературным данным варьирует от 20 до 67% [1, 6]. Такой широкий диапазон исследователи объясняют неоднозначностью субъективной трактовки классификационных признаков. Так, при определении степени тяжести ПГ по принятой классификации опытными специалистами оценка эндоскопической картины совпадала лишь в 64,1±9,1% случаев [19].
В группу с ПГ легкой степени вошли пациенты с ЦП и ХГ – 92,9% (n=39) и 7,1% (n=3) соответственно. Тяжелое течение ПГ наблюдалось исключительно у пациентов с ЦП (n=22). В литературе существуют указания на выявление признаков формирования ПГ уже на стадии ХГ, однако тяжелая степень ПГ также описана лишь у пациентов с ЦП [1].
Распределение пациентов по полу и возрасту выявило преобладание тяжелой степени ПГ у больных с ЦП женского пола (p<0,001). Средний возраст пациентов в группах с ПГ легкой и тяжелой степени составил 52,29±0,82 года и 52,86±3,73 года соответственно (p=0,5766). Согласно литературным данным ПГ тяжелой степени чаще развивается у пациентов в возрасте от 41 до 60 лет, что согласуется с полученными нами результатами [2].
При анализе влияния этиологических факторов на развитие тяжелой степени ПГ установлено, что при тяжелой форме ПГ у пациентов достоверно чаще определялся ЦП в исходе хронического вирусного гепатита В и алкогольного стеатогепатита, а также сочетание этих этиологических факторов (p<0,05). Группа пациентов с легкой формой ПГ была представлена больными с ЦП преимущественно вирусной этиологии, при этом легкая степень ПГ чаще выявлялась у пациентов с ЦП в исходе вирусного гепатита С (p<0,05) и неалкогольного стеатогепатита (p<0,001). Следует отметить большую распространенность ПГ тяжелой степени среди пациентов с первичным билиарным циррозом (p<0,001).
В многочисленных исследованиях представлены противоречивые данные о влиянии этиологии ЦП на степень тяжести ПГ – некоторые авторы указывают на отсутствие корреляции между этиологией ЦП и степенью тяжести ПГ [4], тогда как существуют публикации о развитии тяжелой формы ПГ преимущественно у пациентов с ЦП вирусной этиологии [5], а также с первичным билиарным циррозом [2].
При изучении анамнестических данных в группе пациентов с тяжелой формой ПГ чаще выявлялись указания на злоупотребление алкоголем (p<0,01). Авторы связывают влияние злоупотребления алкоголем на степень тяжести ПГ с развитием быстро прогрессирующего ЦП алкогольного генеза с портальной гипертензией, причем ПГ регистрируется в 88% случаев, что выше среднепопуляционной заболеваемости. При этом ПГ тяжелой степени, т.е. состояние, которое очень часто осложняется кровотечением и ведет к развитию энцефалопатии выявлено у 35% обследованных больных [3]. Указания на перенесенные кровотечения из различных отделов ЖКТ в анамнезе более часто встречались у пациентов в группе с легким течением ПГ (p<0,001). Кроме того, у пациентов обоих групп ПГ сочеталась с заболеваниями верхних отделов ЖКТ и панкреатодуоденальной зоны. При этом при легком течении ПГ чаще выявлялись указания на ЯБ в анамнезе, вне обострения на момент обследования, и сочетание с хроническим холециститом разной степени активности (p<0,001). Тяжелое течение ПГ у пациентов с ЦП более часто комбинировалось с хроническим панкреатитом в фазе обострения – у 64,3±7,4% и 68,2±9,9% пациентов с ПГ легкой и тяжелой степени соответственно, а также с хроническим холангитом (p<0,001) - у 11,9±5,0% и 27,3±9,5% пациентов соответственно. Более часто развитие хронического панкреатита у пациентов с тяжелой ПГ, вероятно, связано со значительной долей алкогольной этиологии ЦП среди больных этой группы.
При изучении распределения больных двух групп по степени тяжести ЦП легкая степень ПГ определялась у 57,1±7,6% пациентов с ЦП класса В по Чайлду-Пью, при тяжелом течении ПГ у 54,5±10,6 % пациентов выявлен ЦП класса С по Чайлду-Пью (p<0,001). При этом прогрессирование ЦП, сочетающееся с тяжелым течением ПГ, проявлялось признаками декомпенсации портальной гипертензии – развитием некоррегируемого медикаментозно асцита, варикозного расширения вен пищевода (ВРВП) 2-3-4 степени, спленомегалии с явлениями гиперспленизма, портосистемных коллатералей, развитием печеночной энцефалопатии 3-4 степени (p<0,001), а также требовало активной лечебной тактики – пациентам данной группы достоверно чаще требовалось проведение лапароцентеза (p<0,01).
Большинство авторов не отмечает корреляции между стадией компенсации ЦП по Чайлду-Пью и степенью тяжести ПГ [8, 10, 15, 17]. Кроме того, опубликованы данные о большей распространенности ПГ тяжелой степени у пациентов с ЦП класса А по Чайлду-Пью, а ПГ легкой степени – у пациентов с ЦП класса В по Чайлду-Пью [2]. Существуют отдельные публикации рассматривающие ЦП класса В и С по Чайлду-Пью как неблагоприятный прогностический фактор прогрессирования ПГ легкой степени в тяжелую ПГ [16].
При сравнительном анализе клинической картины у пациентов при легкой степени ПГ на первый план выступали проявления со стороны верхних отделов желудочно-кишечного тракта в виде болевого (p<0,01) и диспепсического (p<0,05) синдромов, а также неспецифические астенические жалобы (p<0,01). При этом тяжелое течение ПГ более часто сочеталось с признаками печеночной декомпенсации – проявлениями отечно-асцитического синдрома (p<0,01), развитием синдрома желтухи (p<0,05), печеночной энцефалопатии (p<0,01), появлением малых печеночных знаков (p<0,001) при физикальном обследовании. Клиническая симптоматика соотносится с распределением пациентов с легкой и тяжелой степенью ПГ по стадии компенсации ЦП. Немногочисленные публикации, оценивающие клиническую симптоматику у пациентов с ПГ, свидетельствуют о более частом выявлении диспепсии у пациентов с ПГ тяжёлой степени [1, 3], либо указывают на отсутствие особенностей клинической картины при ПГ различной степени тяжести [2].
При анализе лабораторных показателей у пациентов сохранялись общие изменения, характерные для пациентов c ПГ при ХЗП – снижение уровня гемоглобина, эритроцитов, наклонность к тромбоцитопении, иммунологические сдвиги за счет гипергаммаглобулинемии. Однако выявленные изменения показателей имели более выраженный характер в группе с тяжелой степенью ПГ (p<0,05). Так, средний уровень гемоглобина составил 115,99±4,19 г/л и 99,45±4,58 г/л в первой и второй группах соответственно и сопровождался снижением общего количества эритроцитов до 3,89±0,13х1012/л и 3,42±0,18х1012/л у пациентов при легкой и тяжелой степени ПГ. Следует отметить, что у наблюдаемых больных в обеих группах сохранялся достаточный уровень сывороточного железа, что свидетельствует о смешанном характере анемии и снижает вероятность исключительно постгеморрагического генеза снижения уровня гемоглобина. Кроме того, тяжелая степень ПГ сопровождалась значительной тромбоцитопенией со снижением общего количества тромбоцитов до 134,55±16,83х109/л при показателях, близких к нижней границе нормы в группе с легкой степенью ПГ – 190,38±14,44х109/л (p<0,05). Вышеописанные изменения гематологических показателей связаны с развитием гиперспленизма на фоне декомпенсации ЦП [3, 4, 5, 17], а также с развитием субклинических и манифестных кровотечений из измененной СОЖ при ПГ [11].
В литературе не описано взаимосвязи активности ХЗП у пациентов со степенью тяжести ПГ. Согласно полученным нами результатам статистически значимых различий по лабораторным показателям синдрома цитолиза и холестаза выявлено не было – в обеих группах наблюдалось повышение трансаминаз и уровня общего билирубина в среднем в пределах 2 норм.
Учитывая прогрессирование ПГ с развитием декомпенсации ЦП, изучались показатели синтетической функции печени у пациентов с легкой и тяжелой степенью ПГ. При этом в группе с легкой степенью ПГ определялась тенденция к снижению уровня альбумина до нижней границы нормы 36,93±1,25 г/л, тогда как при тяжелой степени ПГ средний уровень альбумина у наблюдаемых пациентов составил 32,72±1,37 г/л (p<0,05). В литературе снижение уровня альбумина рассматривается не только в сочетании с тяжелой степенью ПГ, но и как фактор прогрессирования при ПГ легкой степени [12].
У пациентов обеих групп выявлялись изменения показателей ЦИК и сывороточных иммуноглобулинов, однако при тяжелой степени ПГ определялось более выраженное повышение уровня IgG (p<0,05). Выраженность иммунологических изменений при ПГ тяжелой степени рассматривается нами как проявление ХЗП в стадии декомпенсации, которое ассоциируется с данным состоянием.
По результатам УЗИ у пациентов с ПГ легкой и тяжелой степени определялись изменения эхоструктуры и эхоплотности печени различной степени выраженности. При легком течении ПГ выявлялись более выраженные изменения эхоструктуры печени, тогда как при тяжелом течении ПГ преобладали пациенты с умеренным и значительным повышением эхоплотности печеночной ткани (p<0,001). Данные изменения гистоархитектоники печени не сопровождались значительным увеличением размеров печени и селезенки, а также изменением диаметра воротной и селезеночной вен. При этом в группе с тяжелым течением ПГ продольный размер селезенки составил 137,43±5,17 мм, а в группе с легким течением – 121,47±4,8 мм, что дает возможность рассматривать данный показатель как ассоциированный с эрозивной формой ПГ (p=0,0493), что соответствует литературным данным [5]. Изменения эхоструктуры и эхоплотности оцениваются субъективно и являются «оператор-зависимыми», тогда как количественный показатель размера селезенки может рассматриваться как фактор прогнозирования тяжелой степени ПГ.
При допплерографии различий в количественных изменениях по линейной и объемной скорости кровотока, а также расчетным гемодинамическим индексам (индекс застоя, спленопортальный индекс) нами зафиксировано не было. Аналогичные данные опубликованы по результатам исследования влияния ультразвуковых (УЗ) параметров портальной гемодинамики на степень тяжести ПГ [2, 8, 10]. Однако при тяжелом течении гастропатии определялось изменение направления кровотока в воротной вене – преобладали пациенты с гепатофугальным и смешанным направлением, тогда как в группе с легким течением у большинства пациентов регистрировался гепатопетальный кровоток (p<0,001). Следует отметить, что тяжелое течение ПГ ассоциировано с прогрессированием портальной гипертензии: более часто у пациентов данной группы выявлялись асцит, портосистемные колатерали, реканализация пупочной вены (p<0,001). При этом в группе с легким течением ПГ у наблюдаемых пациентов преобладает УЗ картина портальной гипертензии в стадии субкомпенсации. При тяжелом течении ПГ УЗ признаков компенсированной портальной гипертензии не регистрировалась, а показатели, соответствующие стадии декомпенсации, отмечались у 54,5% пациентов (p<0,001). Многие авторы также описывают более выраженное увеличение давления в системе воротной вены при ПГ тяжелой степени в исследованиях с определением портопеченочного градиента давления [14, 15].
При эндоскопическом исследовании наряду с признаками ПГ и определением степени тяжести поражения СОЖ в том числе оценивалось состояние слизистой оболочки пищевода. У пациентов с ПГ легкой степени чаще выявлялся эрозивный эзофагит, тогда как при ПГ тяжелой степени у большинства пациентов определялись лишь гиперемия слизистой (p<0,001). Степень выраженности ВРВП отчетливо не ассоциировалась со степенью тяжести ПГ. При ПГ тяжелой степени наблюдалось равномерное распределение пациентов с ВРВП 1-3 степени, кроме того, при ПГ легкой степени у 2,5±2,5% пациентов определялась максимальная 4 степень ВРВП. Согласно литературным данным прогрессирование ПГ ассоциировано со степенью ВРВП, что объясняется общими патогенетическими механизмами развития [4, 12, 17]. Вместе с тем опубликованы данные, указывающие на отсутствие влияния ВРВП на формирование и прогрессирование ПГ [2, 3, 9]. Противоречивые данные отражают существующую неопределенность в трактовке влияния выраженности портальной гипертензии на степень тяжести ПГ, что требует дальнейшего изучения.
Диагностика и определение степени тяжести ПГ проводились по наличию изменений СОЖ в виде гиперемии, мозаичности, наличия скарлатиноподобных пятен и эрозивно-геморрагических дефектов СОЖ [9]. При этом при легкой степени ПГ преобладали изменения в виде гиперемии и мозаичности СОЖ, а при тяжелой степени ПГ вышеуказанные признаки встречались реже, но выявлялись скарлатиноподобные пятна, эрозии, подслизистые геморрагии СОЖ (p<0,01). В литературе мозаичность является наиболее часто выявляемым изменением СОЖ при ПГ, тогда как «красные пятна» и эрозивно-геморрагические изменения рассматриваются не только как проявления тяжелой ПГ, но и в качестве независимых предикторов кровотечения из верхних отделов ЖКТ [9, 18].
В настоящее время обсуждается вопрос о формировании дуоденопатии при портальной гипертензии на фоне ХЗП. Согласно полученным нами данным статистически значимых различий по состоянию слизистой двенадцатиперстной кишки (ДПК) между группами зарегистрировано не было, однако ПГ тяжелой степени чаще сочеталась с деформацией луковицы ДПК (p<0,001). Согласно литературным данным дуоденопатия значительно чаще ассоциируется с ПГ тяжелой степени и является причиной кровотечений у 9,5% пациентов с данной патологией [7].
При изучении морфологической картины СОЖ при ПГ легкой степени более часто отмечалась картина пангастрита с отсутствием или слабой выраженностью активности воспаления, а при тяжелой ПГ – антрум-гастрита с воспалением легкой, умеренной или выраженной степени, ассоциированного с Helicobacter pylori (H.p.) (p<0,01). При этом кишечная метаплазия слабой степени при ПГ легкого и тяжелого течения выявлялась у 12,5±6,8% и 10,0±9,5% пациентов соответственно (p<0,001). В литературе обсуждается роль гистологического исследования в диагностике ПГ. Опубликованы данные о несоответствии эндоскопической картины и определяемой морфологически степени тяжести ПГ. При тяжелой ПГ микроскопические изменения выявлялись менее чем у 50% обследованных больных, и, наоборот, у пациентов с легкой степенью ПГ определялись морфологические признаки тяжелой степени поражения СОЖ [3]. Другие авторы отмечают корреляцию степени тяжести ПГ с частотой выявления кишечной метаплазии и атрофии [1, 13].
Согласно полученным данным колонизация H.p. определялась в биоптате у 24,0±8,5% и 40,0±15,5% пациентов с ПГ легкой и тяжелой степени соответственно (p<0,001), что сопоставимо с результатами других исследований [2, 13]. Кроме того, существуют литературные данные, что колонизация Н.р. в гастробиоптате более часто выявляется у пациентов без признаков ПГ и не влияет на формирование и тяжесть ПГ, сочетаясь с гипохлоргидрией и вазодилатацией, которые являются основные патогенетическими факторами прогрессирования ПГ [2, 6, 11].
Нами была использована байесовская модель в виде компьютерной программы для обработки поступающей информации о пациентах с подозрением наличие ПГ тяжелой степени при ХЗП. Для определения необходимых количественных параметров были использованы данные о частоте выявления симптомов и синдромов у пациентов с ПГ легкой и тяжелой степени. Были выделены 49 признаков, определяемых при обследовании пациента, включающие данные анамнеза, общего осмотра, результаты лабораторных и инструментальных исследований.
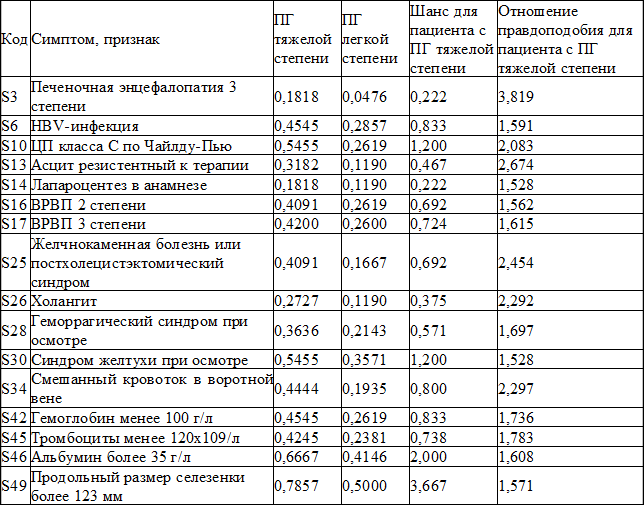
На основании полученных в исследовании данных отдельно рассчитаны правдоподобия наличия определенных клинических и лабораторных показателей у пациентов с наличием ПГ легкой и тяжелой степени. Кроме того, определены отношения правдоподобий (L) для каждого симптома (отношение вероятности развития тяжелой формы ПГ к вероятности развития легкой формы ПГ при наличии отдельного признака). Эта величина характеризует выраженность, специфичность синдрома для данного заболевания, иными словами - его информативность при тяжелой форме ПГ. Заметим, что при L<1 анализируемый симптом (признак) скорее нехарактерен для данного заболевания, чем характерен. В табл. 1 представлены отдельные симптомы с наибольшим отношением правдоподобий по результатам произведенного исследования.
В клинической практике, помимо оценки условных вероятностей симптомов при тяжелой степени ПГ у пациентов с ХЗП также определялись шансы (или логарифмические отношения правдоподобия). Шансы в их цифровом представлении указывают во сколько раз данный симптом вероятнее встретится, чем не встретится при данном заболевании.
Используя частоты, приведенные в табл. 1, мы вычисляли вероятность наличия ПГ тяжелой степени у предполагаемого пациента (частоты были рассчитаны для групп с тяжелой и легкой степенью ПГ отдельно) на основании наличия или отсутствия представленных в таблице признаков.
С помощью данной программы нами оценивалась вероятность развития ПГ тяжелой степени у 27 пациентов с ЦП, не входящих в исходную выборку. При этом у 12 пациентов по результатам эндоскопического исследования была выявлена тяжелая форма ПГ, из них при использовании диагностической программы высокий риск развития данного осложнения определен у 10 пациентов. Из 15 пациентов без признаков эрозивного процесса при ФГДС у 9 пациентов при использовании программного продукта прогнозировалось развитие ПГ тяжелой степени. На основании полученных данных чувствительность диагностического теста составила 83,3±7,1%, специфичность 40±9,43%, прогностичность положительного результата – 52,6±9,51%, прогностичность отрицательного результата – 75,0±8,33%, преваленс – 44,4%.
Таблица 1. Субъективные меры вероятности, шансы и отношения правдоподобия для отдельных симптомов у пациентов с ПГ на фоне ХЗП
Таким образом, использование разработанной программы позволяет оптимизировать диагностический процесс за счет выявления лиц, у которых еще нет клинических проявлений тяжелой степени ПГ, но определяется риск ее формирования, рассчитанный компьютерной программой по теореме Байеса.
Выводы. ПГ тяжелой степени выявлялась нами у 35% процентов пациентов с ПГ на фоне ЦП. Факторами развития тяжелого поражения СОЖ определены вирусная, алкогольная или смешанная этиология ЦП, наличие сопутствующей патологии панкреатодуоденальной зоны (хронический панкреатит, хронический холецистит, холангит). Клинически тяжелая степень ПГ маскируется проявлениями декомпенсации основного заболевания печени в виде синдрома желтухи, отечно-асцитического синдрома, печеночной энцефалопатии при ЦП класса В и С по Чайлду-Пью. Характерными лабораторными признаками тяжелой степени ПГ у наблюдаемых пациентов с ХЗП являлись снижение уровня гемоглобина, общего количества эритроцитов и тромбоцитов, концентрации альбумина, а также моноклоновая IgG-гаммапатия. При сравнительном анализе УЗ параметров тяжелая степень ПГ у пациентов с ХЗП ассоциируется с диффузными изменениями эхоструктуры печени, увеличением размеров селезенки, а также проявлениями портальной гипертензии в стадии декомпенсации с развитием портосистемных коллатералей и реканализацией пупочной вены и асцитом.
Полученные данные с использованием соответствующих методов статистической обработки могут служить для прогнозирования развития эрозивно-геморрагической (тяжелой) формы ПГ с целью более раннего назначения рациональной терапии для профилактики возможных кровотечений.
