Актуальность. Любые патологические механизмы запускаются разнообразными этиологическими факторами или биологическими событиями, поэтому большое количество неврологических болезней, в особенности ишемического генеза, с различной эволюцией (острые, хронические) являются дегенеративными и находят своё отражение в состоянии других жизненно важных органов [1, 6].
Основной задачей ликвидации церебральных ишемических катастроф является блокирование происходящих патогенетических процессов в кратчайшие сроки, с целью максимального ограничения зоны пенумбры во избежание массивной гибели клеток головного мозга [5, 11].
Исследования последних лет доказали, что гибель нервной ткани при ишемии происходит в результате каскада патобиохимических и патофизиологических процессов [5, 6]. Активация свободнорадикальных процессов при ишемии мозга приводит к развитию оксидантного стресса, являющегося универсальным механизмом повреждения любых тканей [3, 4, 8].
Несмотря на то, что главный театр действий выражается в локальной катастрофе головного мозга и неврологических нарушениях, большинством исследователей и практических врачей, не придаётся, должного внимания существенной роли «основной лаборатории» организма – морфофункциональному состоянию печени.
Работу печени в процессах адаптации и компенсации нарушенных функций при любых патологических состояниях трудно недооценить, основными значимыми из которых является решающая роль в общем метаболизме, особенно при церебральных ишемических катастрофах, инактивация продуктов гуморальной регуляции, а так же обеспечение процессов свободнорадикального окисления, в частности перекисного окисления липидов [4,5].
Полипрагмазия и большое количество лекарственных средств находящихся в современном арсенале фармакопеи ишемического инсульта, отсутствие единых стандартов применяемых препаратов и незначительная доказательность эффективности их применения – всё это осложняет работу печени, что в целом отрицательно влияет на статус пациентов с церебральными ишемическими катастрофами.
Цель исследования: изучить морфологические особенности состояния печени на ранних сроках церебрального ишемического инсульта в эксперименте.
Материалы и методы исследования. В эксперименте воспроизводилась неполная ишемия головного мозга для создания механизма реперфузионного повреждения головного мозга. Все процедуры эксперимента соответствовали требованиям Международных правил гуманного отношения к животным, отраженным в Санитарных правилах по оборудованию и содержанию экспериментально-биологических клиник (вивариев).
Крысы содержались в условиях вивария при свободном доступе к пище и воде. Выбор объекта эксперимента был обусловлен сходством ангиоархитектоники головного мозга лабораторных белых крыс породы Вистар и человека, а также близостью основных гемодинамических параметров.
Использованые животные массой 250-280 г в возрасте 4-7 месяцев были разделены на 2 группы: 1-ю группу составили 8 крыс, которым производили кожный разрез области шеи над сонной артерией с одной стороны (слева) с последующим ушиванием кожи (ложнооперированные), 2-ю группу составили 9 крыс, которым вскрывалась левая сонная артерия, производилось клипироване в течение 20 минут с последующей реперфузией и полным восстановлением мозгового кровотока.
Исследования проведены через 1, 3 и 7 дней после ишемии-реперфузии. Верификация ишемического инсульта подтверждалась на основании просмотра светооптических препаратов окрашенных по Нисслю. Для получения полутонких срезов кусочки тканей височной области головного мозга фиксировались в 2,5% глютаровом альдегиде, с последующей проводкой по стандартной методике в спиртах возрастающей концентрации и заливкой в аралдит. Полутонкие срезы получали на ультрамикротоме ЛКБ, окрашивали метиленовой синью и фуксином.
Результаты и обсуждение. Необходимо подчеркнуть, что существует специальный термин, характеризующий изменения печени при заболеваниях и патологических состояниях не являющихся первичными по отношению к печени – неспецифический реактивный гепатит, который признаётся не всеми исследователями.
Макроскопически нами отмечено, что определяется закруглённый передний край печени, очаговая гиперемия и некоторое утолщение капсулы, гладкая поверхность её. При длительном течении процесса и затяжном и тяжёлом ишемическом церебральном поражении, чаще у более старых животных, печень уплотняется, на её поверхности появляются элементы «септального рисунка».
В результате проведенных нами морфологических исследований выявлено появление мелких конфокальных участков воспалительной реакции и дистрофическими изменениями главным образом в портальных трактах – характеризующийся элементами мелкоочагового перипортального гепатита (рис. 1).
Единичные редко расположенные мелкоточечные воспалительные инфильтраты могут выходить из портальной стромы в периферические отделы дольки без развития некроза гепатоцитов (рис. 2), располагаясь между печёночными клетками – так называемый дискретный инфильтрат, изредка развиваются единичные перипортальные некрозы.
Нередко на ранних сроках экспериментального ишемического инсульта у крыс обнаруживают очаговые пролиферативные изменения внутри долек: чётко отграниченные инфильтраты из клеток – производных системы мононуклеарных фагоцитов.
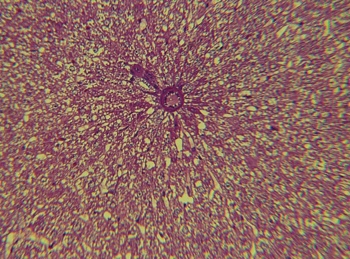
Рис. 1. Печень крысы, 1 час после односторонней ишемии-реперфузии головного мозга. Окраска: гематоксилинэозином. Увеличение: объектив - 40, окуляр - 10
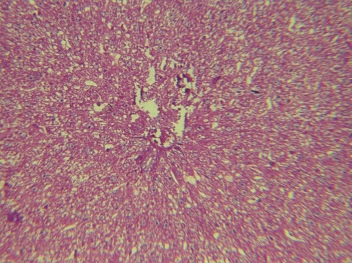
Рис. 2. Печень крысы, 24 часа после односторонней ишемии-реперфузии головного мозга. Окраска: гематоксилинэозином. Увеличение: объектив - 40, окуляр - 10
Интенсивность гематотканевого обмена в значительной степени зависит от скорости кровотока в синусоидах (рис. 3), что в свою очередь зависит и связано с особенностями их строения.
Так, нами отмечено, что в норме и первые сутки в перипортальных отделах дольки печени при экспериментальном ишемическом инсульте встречаются главным образом прямые и ветвящиеся синусоиды (рис. 4 и 2).
В последующем, к седьмым суткам перипортальные тракты до зон примыкания к центральным венам характеризуются преимущественно ветвящимися синусоидами с наблюдением чёткой тенденции к анастомозированию, причём характерной немаловажной особенностью является выявленная нами прямопропорциональная взаимосвязь появления унулиподий от степени выраженности ишемии головного мозга (рис. 5 и 3).
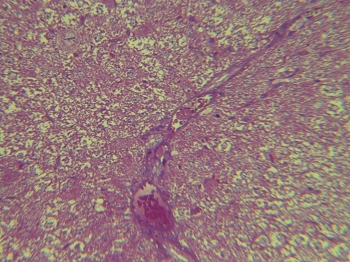
Рис. 3. Печень крысы, седьмые сутки после односторонней ишемии-реперфузии головного мозга. Выраженный внутрисосудистый стаз, отёчность соединительнотканных структур. Увеличение: объектив - 40, окуляр - 10
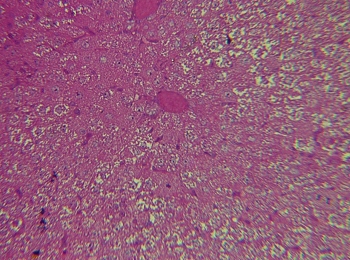
Рис. 4. Интактная печень крысы в контроле. Окраска: гематоксилинэозином. Увеличение: объектив - 40, окуляр - 10
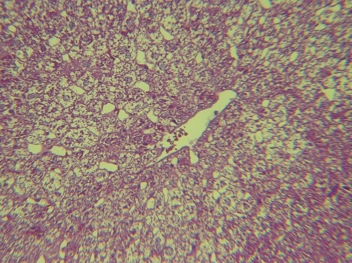
Рис. 5. Печень крысы, третьи сутки после односторонней ишемии-реперфузии головного мозга. Окраска: гематоксилинэозином. Увеличение: объектив - 40, окуляр - 10
В общей характеристике морфологические проявления при ишемических церебральных катастрофах проявляются нарушением балочного строения печени, внутридольковыми альтеративными проявлениями с проявлением некрозов единичных гепатоцитов со скоплением в этих участках небольшого количества макрофагов, лимфоцитов, нейтрофилов (рис. 5), очагами жировой дистрофии гепатоцитов, пролиферацией и гипертрофией звёздчатых ретикулоэндотелиоцитов, отёком и расширением портальных трактов с инфильтрацией их лимфогистиоцитарными элементами и нейтрофилами, иногда пролиферацией перипортальных и интралобулярных желчных протоков и формированием лимфоидных фолликулов (рис. 3).
В наших исследованиях при экспериментальном ишемическом инсульте отмечена тенденция к централизации внутрипечёночного кровообращения в связи с наличием портальных анастомозов внутри печёночных долей и коллатералей.
Микроскопически обнаруживается полиморфизм гепатоцитов (клетки различных размеров, среди них большое количество дву- и многоядерных, ядра различных размеров), их набухание, вследствие чего нарушается чёткость балочного строения.
Белковая (гидропическая, балонная) и жировая дистрофия имеют мелкоочаговый характер, причём выраженность данных изменений трудно определить как характерные или специфичные в конкретном случае.
В различных отделах печёночных долек встречаются мелкие очаги некроза паренхимы с разрушением аргирофильной стромы и очаговые инфильтраты из макрофагов, лимфоцитов, нейтрофилов. Выражены пролиферация и гипертрофии звёздчатых ретикулоэндотелиоцитов (макрофагов печени).
Портальные тракты расширены, отёчны, умеренно или слабо инфильтрированы лимфогистиоцитарными элементами с примесью нейтрофилов.
Постинсультная инвалидизация занимает первое место среди всех возможных причин утраты трудоспособности, к прежней работе возвращаются лишь около 20 % лиц, перенесших инсульт, при этом одна треть больных - люди социально активного возраста, что подчёркивает актуальность проводимых исследований [2, 7].
Клинически нейротрофические нарушения проявляются чаще всего при острых заболеваниях головного мозга (инсультах, травмах, менингоэнцефалитах и т. п.), сопровождающихся вовлечением гипоталамуса - гипофиза, ствола мозга, симпатических и блуждающих нервов [12]. При этом наибольшие функциональные и морфологические нарушения отмечаются в желудочно-кишечном тракте (язвы, эрозии, кровоизлияния), легких (отек, пневмония) и поджелудочной железе (преходящие гипергликемии) [10] и печени [13].
Многими авторами неоднократно подчёркивалось, что в патогенезе раннего периода церебрального ишемического инсульта существенную роль играют нарушения функций печени [12], нередко приводящие к гибели больного при прогрессировании положительной динамики неврологического статуса.
Наблюдаемые нами макроскопические изменения, такие как уплотнение печени, с закруглением переднего края, очаговая гиперемия и некоторое утолщение капсулы со сглаженной поверхностью, появление на её поверхности элементов «септального рисунка» указывает на высокую вероятность развития в последующем очагового фиброза.
В результате проведенных нами исследований подтверждено мнение многих авторитетных учёных, что в острейшем периоде ишемического инсульта в печени происходит сужение капилляров с замедлением кровотока и агрегацией эритроцитов в них [9], что имеет большое значение в механизме расстройств печёночного кровообращения [14]. Наступает также сужение мелких вен, постепенное расширение синусоидов с замедлением кровотока и агрегацией эритроцитов в них, внутрипечёночное шунтирование кровотока [15].
Наличие мелких конфокальных участков воспалительной реакции с элементами дистрофических изменений главным образом в портальных трактах и перипортальных зонах, то есть в I-ых зонах. Известно, что именно в этих зонах по сравнению с другими имеется наибольшее содержание кислорода и веществ для метаболических реакций, а метаболическая и регенераторная активность этой зоны наиболее высокая, поэтому мы считаем, что данные участки первыми включаются в сопутствующие первопричине патологические процессы.
Расширение портальных трактов, их отёчность и инфильтрация лимфогистиоцитарными структурами свидетельствует о дальнейшей возможности развития склеротических процессов в данных участках различной, чаще умеренной, степени выраженности.
Чётко отграниченные инфильтраты из клеток характеризующие очаговые пролиферативные изменения внутри долек на ранних сроках экспериментального ишемического инсульта у крыс являются проявлением мелкоточечного инфильтративного гранулематозного воспалительного процесса.
В результате наших исследований подтверждено, что церебральные ишемические катастрофы нарушают морфологический пейзаж печёночных структур, что определяется не только невозможностью полноценного обеспечения «центрального» контроля повреждённым ишемией головным мозгом, но и проявляется. Таким образом, при ишемии головного мозга нарушается не только прямая, но и обратная взаимосвязь системы мозг-печень.
Заключение. Нарушения функции печени при ишемических расстройствах центральных механизмов регуляции чаще всего многообразны, но морфологически не столь выражены. По мнению многих авторов нередко нарушается не одна, а несколько ее функций, которым однозначно имеется морфологическое подтверждение, выявленное в наших исследованиях. По нашим наблюдениям, центральные расстройства функции печени нередко служат не только фоном, на котором в дальнейшем под воздействием инфекции, интоксикации и др. погрешностей развиваются более тяжелые болезни этого органа, а зачастую могут играть роль активатора усугубления тяжести состояния в целом.
