Актуальность и сложность медицинской помощи больным с синдромом портальной гипертензии (ПГ) общеизвестна. Особое внимание отводится лечению пациентов с внутрипеченочной ПГ, так как функциональное состояние печени играет большую роль, как в тактике, так и долгосрочном прогнозе течения заболевания.
Внутрипеченочная ПГ может быть вызвана врожденным фиброзом печени, первичным билиарным циррозом, саркоидозом, синдромом Банти, врожденными нарушениями метаболизма (болезнь Вильсона-Коновалова, альфа-1-антитрипсиновая недостаточность, галактоземия, болезнь Гоше, идиопатический гемохроматоз, протопорфирии), циррозом печени (вирус-ассоциированным, этил-индуцированным, токсическим), узловой регенеративной гиперплазией, частичной узловой трансформацией, раком печени [1-3].
Цирроз печени (ЦП) в 70% случаев приводит к портальной гипертензии [1,4,5,6] и в большинстве случаев представляет собой неблагоприятный итог развития хронических алкогольных и вирусных гепатитов [7]. Самым грозным осложнением ПГ является кровотечение из варикозно-расширенных вен пищевода и желудка [8,9]. Многочисленные попытки разработки унифицированного и эффективного подхода к лечению больных с этим жизнеугрожающим осложнением привело к появлению «Британского руководства по лечению варикозных кровотечений у больных циррозом» (2000) [10,11], а несколько позже – «Практического руководства американской Ассоциации по изучению болезней печени» (2007) [11,12]. В отечественной и иностранной литературе до сих пор обсуждается вопрос, как лечить и профилактировать осложнения цирроза печени: консервативно или оперативно? Ответ очевиден: лечить можно разными способами, но вылечить это заболевание достаточно сложно, а иногда и невозможно. Огромное количество работ посвящено коррекции внутрипеченочной портальной гипертензии, как самой распространенной.
Целью работы является обоснование, анализ современных возможностей и улучшением результатов лечения внутрипеченочной портальной гипертензии.
Материалы и методы. В хирургической клинике Ростовского государственного медицинского университета с 1997 г. по настоящее время пролечено 341 пациент с портальной гипертензией. Из 341 больного внепеченочная (подпеченочная) портальная гипертензия развилась у 42 больных (12,3%), внутрипеченочная возникла у 297 (87,1%), у 2 пациентов (0,6%) ПГ носила смешанный тип (внутрипеченочный и надпеченочный). Из 299 больных внутрипеченочной портальной гипертензией у 287 был выявлен цирроз печени, у 6 пациентов выявлена альфа-1-антитрипсиновая недостаточность, у одного редко встречающаяся гепатоцеребральная дистрофия (болезнь Вильсона-Коновалова), приведшие к развитию фиброза печени, у ребенка 8 лет ПГ развилась, как осложнение врожденного фиброза печени. У одного пациента регенеративный узел печени вызвал ПГ. Трем пациентам был поставлен диагноз полинодулярной трансформации печени. У двоих из них ПГ носила смешанный характер за счет гипоплазии нижней полой вены в области впадения печеночных вен с деформацией и стенозом их устьев в одном случае и сдавления печеночных вен и нижней полой вены в другом.
Группу нашего наблюдения составили 128 пациентов с внутрипеченочной ПГ в возрасте от 14 до 83 лет (среднее 49,04±12,50): 77 мужчин (60,2%) и 51 женщина (39,8%), которым с целью коррекции ПГ было выполнено трансъюгулярное внутрипеченочное портосистемное шунтирование. Было выявлено, что основное заболевание (цирроз печени) развился у 76 больных на фоне перенесенного вирусного гепатита (59,4%) и у 52 больных гепатит отсутствовал в анамнезе. Прием алкоголя в анамнезе был зафиксирован у 56 пациентов (43,7%), из них у 21 - прием алкоголя в анамнезе сочетался с вирусным гепатитом, а у 35 - заболевание не было вирус-ассоциированным.
Из 128 больных внутрипеченочной формой ПГ у 3 (1,9%) отмечена печеночно-клеточная недостаточность по Child-Turcotte-Pugh «А» класса, у 67 (41,9%) - «В» класса, у 90 (56,2%) - «С» класса. Варикозное расширение вен пищевода разной степени было выявлено у всех 128 пациентов (100%). Эпизоды варикозного кровотечения были установлены у 73 больных (57,1%), причем у 31 больного кровотечение было установлено впервые (24,2%), у 22 – в анамнезе было дважды (17,2%), у 13 – трижды (10,2%), у 6 - четырежды (4,7%) и лишь у одного пациента было 6 эпизодов варикозного кровотечения (0,8%). Тяжесть пациентов с циррозом печени усугублялась наличием асцита у 93 человек (72,6%).
Всем пациентам проводилось комплексное обследование, включающее в себя общеклинические, лабораторные и инструментальные методы с обязательным выполнением ультразвукового исследования органов брюшной полости, воротной и селезеночной вен, эзофагофиброгастроскопию (ФГДС) и эзофаговидеогастродуоденоскопии (ЭВГДС), при необходимости гепатосцинтиграфию и мультиспиральную компьютерную томографию брюшной полости с болюсным контрастированием, а также пункционную биопсию печени.
При ЭВГДС определяли признаки воспаления, количество, размеры и локализацию подслизистых вариксов, наличие «красных пятен», признаки состоявшегося пищеводного кровотечения. Осмотр слизистой оболочки желудка производился при его раздувании воздухом, особое внимание обращали на малую кривизну желудка, где находятся вариксы I типа, распространяющиеся со стороны пищевода и дно желудка, где расположены вариксы II типа, отличающиеся удлиненной формой и извилистым ходом.
У 7 пациентов (5,5%) из 128 с признаками кровотечения при поступлении в стационар ФГДС проводили сразу после госпитализации в условиях палаты интенсивной терапии. Показанием к экстренной гастроскопии при кровотечении было определение его источника. При визуализации источника, тот час же устанавливали зонд-обтуратор. Фармакотерапия проводилась параллельно и включала в себя введение гемостатических препаратов, селективных вазоконстрикторов (терлипрессина и октреотида), ингибиторов протонной помпы (омепразола), переливания препаратов крови и кровезаменителей.
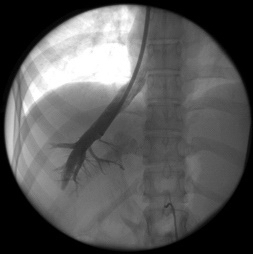
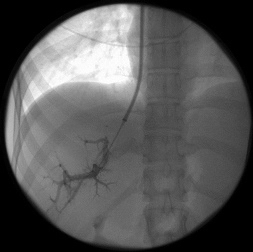
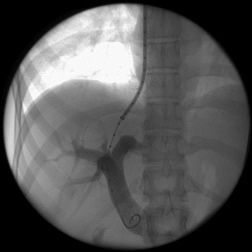
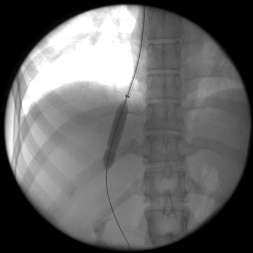
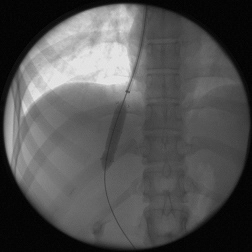
После предоперационной подготовки всем 128 больным было выполнено трансъюгулярное внутрипеченочное портосистемное шунтирование (ТВПШ) на ангиографическом комплексе с С-дугой Siemens Arcadis Avantic (Германия). Вначале пациентам выполняли непрямую мезентерикопортографию: натощак под местной анестезией 0,5-1,0% раствором новокаина или 1% раствором лидокаина проводилась пункция бедренной артерии в области правой паховой складки. Через бедренную артерию катетеризировали верхнюю брыжеечную артерию или, при невозможности, чревный ствол катетером 6F Cobra или JR5. Затем по катетеру шприцом-инъектором вводили 50 мл неионного контрастного вещества со скоростью 5-6 мл в секунду. Через 10-15 секунд производили съемку в режиме 8 кадров в секунду. Получали видеоизображение воротной вены. Одновременно правым трансъюгулярным венозным доступом также под местной анестезией в верхнюю полую вену по проводнику 0,035'' с J-образным кончиком вводили интродьюсер 10F, который под рентгенконтролем продвигали до устья печеночных вен. Катетером 5F катетеризировали среднюю или правую печеночную вену. В печеночные вены вводили 20 мл неионного рентгенконтрастного средства через катетер в момент начала контрастирования воротной вены. Визуализация воротной вены и печеночных вен выполняли в субтракционном режиме (DSA 4 кадра/сек) (рис.1). Стенка печеночной вены пунктировалась в направлении правой бранши воротной вены через паренхиму печени (рис.2). Стилет удалялся, а катетер с физиологическим раствором подтягивался до момента появления в шприце венозной крови (рис.3). По проводнику в пункционный канал между печеночной и воротной венами устанавливали баллон-катетер 8х40 мм, который раздували в паренхиматозном канале (рис.4). Для стентирования использовали самораскрывающиеся стент-графт до 10 мм в диаметре. Стент устанавливали по рентгенконтрастным меткам на нем, обращая внимание на правильное расположение краев стента, обеспечивающее свободный ток крови (рис.5). После удаления системы доставки стента баллоном-катетером производится его дилятация до 8-10 мм (рис.6). После выполнения контрольной портографии при необходимости, а она определялась наличием эпизодов варикозного кровотечения в анамнезе пациента, проводили эмболизацию спиралями Gianturco левой желудочной вены через сформированный внутрипеченочный канал. Данная процедура была выполнена в 58 наблюдениях из 128.
 |
 |
| Рис. 1. Визуализация печеночной и воротной вены (собственное наблюдение). | Рис. 2 Пункция воротной вены (собственное наблюдение). |
 |
 |
| Рис. 3. Установка катетера через паренхиму печени в воротную вену (собственное наблюдение). | Рис. 4. Раздувание баллона катетера в паренхиматозном канале (собственное наблюдение). |
 |
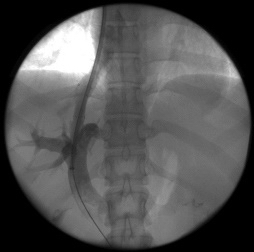 |
| Рис. 5. Стент установлен по меткам, раздут катетером (собственное наблюдение). | Рис. 6. Контроль проходимости внутрипеченочного шунта (собственное наблюдение). |
Результаты. В группе пациентов, которым было выполнено ТВПШ, несмотря на имеющую степень печеночно-клеточной недостаточности, а она у 56,2% больных имела «С» класс, только в одном наблюдении произошло летальное осложнение. На этапе дилятации внутрипеченочного баллона произошел разрыв внепеченочной порции воротной вены из-за анатомической особенности ветвления вены не внутрипеченочно, а на уровне печеночно-двенадцатиперстной связки (табл. 1). Несмотря на предпринятые меры по остановке внутрибрюшного кровотечения (ушивание поврежденного участка вены) пациент скончался через несколько часов после операции.
Таблица 1. Характер послеоперационных осложнений ТВПШ

Другие осложнения, случившиеся во время операции ТВПШ, не носили летального характера, у 3 пациентов сформировались внутрипеченочные гематомы, не требующие оперативного вмешательства, выявленные при сонографии в раннем послеоперационном периоде. У одного пациента во время выполнения пункции яремной вены возникло повреждение париетальной плевры с формированием пневматоракса, который был диагностирован после выполнения манипуляции и ликвидирован установкой плеврального дренажа. Повреждение желчного протока 2 порядка было выявлено при контрольном введении контрастного вещества во время пункции печеночной вены в направлении воротной вены через паренхиму печени, не требовало никакой коррекции. Тромбоэмболия мелких ветвей легочной артерии в одном случае была обусловлена тромбоцитопатией, потребовала корректирующей терапии и закончилась выздоровлением пациентки. Скопление жидкости в плевральной полости не носило прямой связи с выполненным оперативным вмешательством, а объяснялось основным заболеванием (циррозом печени), но требовало выполнения плевральной пункции в послеоперационном периоде. Дисфункция портосистемного шунта в виде тромбозов проявлялась в виде кровотечения из варикозно-расширенных вен пищевода и кардиального отдела желудка и подтверждалась данными сонографического исследования. Эти же пациенты страдали постгеморрагической анемией в послеоперационном периоде, требующей медикаментозной коррекции. Ожидаемое усугубление энцефалопатии было выявлено у 14 больных и диктовало проведение комплекса мероприятий: диеты, препаратов лактулозы, малоабсорбируемых в кишечнике антибиотиков. Только у 2 пациентов энцефалопатия соответствовала III-IV стадиям и сопровождалась нарушением сознания, требовала более интенсивной инфузионной терапии. Ни одному их больных после выполнения ТВПШ и явлениями энцефалопатии не потребовалась редукция шунта.
Летальность после операции ТВПШ составила 2,34% (3 наблюдения). Один из пациентов погиб в первые часы после операции и его случай приведен ранее, двое других пациентов с хронической печеночно-клеточной недостаточностью «С» класса умерли от явлений печеночно-почечной недостаточности, усугубленной выполненным вмешательством.
Обсуждение. В Европе и Америке больные с портальной гипертензией получают однотипную, стандартную и современную помощь и в госпиталях столичных городов, и в маленьких больницах, тогда как в России в областных и районных больницах она значительно различается по качеству [6]. Уже почти 50 лет успешно применяется в мировой клинической практике ортотопическая трансплантация печени, являясь единственно эффективным способом радикального лечения тяжелых заболеваний печени [13]. В США каждый год проводится 5 тысяч трансплантаций печени, в России - лишь 100 [14]. Но пятилетнее выживание больных в листе ожидания трансплантации с неактивным компенсированным циррозом печени не превышает 50-60%, а при развитии таких осложнений, как кровотечение из варикозно-расширенных вен пищевода и желудка, асцит, печеночная недостаточность и энцефалопатия, снижается до 9-15% [15]. Родственную пересадку доли печени некоторым пациентам выполнить невозможно. Варикозное пищеводно-желудочное кровотечение в 45,4% является причиной смерти больных, ожидающих трансплантацию печени [15]. В этой связи операция ТВПШ, являясь малоинвазивной и практически не имеющая противопоказаний в сравнении с операциями портосистемного шунтирования (спленоренального венозного анастомоза в частности), выполняемая пациентам с печеночно-клеточной недостаточности класса «С», на высоте кровотечения, является «мостом» к трансплантации печени и снижает риск повторного кровотечения, обеспечивает декомпрессию портальной системы. Отдаленные результаты лечения из 128 пациентов прослежены у 52 в сроки до 5 лет (операция ТВПШ выполняется в клинике РостГМУ с 2008 года). В течение года после операции умерло 9 больных от манифестации явлений печено-почечной недостаточности. Повторные кровотечения наблюдались у 15 больных, трем из них потребовалось решунтирование. Такие проявления, как асцит, спленомегалия, имели регресс у 8,16% и 32,2% больных соответственно. В 2008 г. было выполнено 34 операции ТВПШ. Пятилетняя выживаемость у больных с внутрипеченочной портальной гипертензией после ТВПШ составила 70,5% (24 из 34). Тромбоза воротной вены не возникло ни у одного пациента.
Таким образом, современным, малоинвазивным, высокоэффективным методом лечения пациентов с внутрипеченочной портальной гипертензией является трансъюгулярное внутрипеченочной портосистемное шунтирование. Данная операция является оптимальной для тяжелой категории больных циррозом печени с признаками печеночно-клеточной недостаточности класса «С», показана пациентам на высоте варикозного кровотечения, может сочетаться с эмболизацией левой желудочной вены, не усложняя процедуру шунтирования.
