Введение. В настоящее время в структуре заболеваний органов пищеварения у детей доминируют хронические воспалительные заболевания верхних отделов желудочно-кишечного тракта (ВОЖКТ), имеющие преимущественно сочетанное поражение пищевода, желудка и двенадцатиперстной кишки [1-3], а также характеризующиеся неуклонным ростом и тенденцией к утяжелению. Эти особенности связаны, во-первых, с высокой частотой Нelicobacter pylori (H.pylori) - инфекции в детском возрасте как одного из этиологических факторов формирования хронических воспалительных заболеваний эзофагогастродуоденальной области [4]; во-вторых, с особым периодом онтогенеза - пубертатным периодом, на который приходится пик манифестации хронических воспалительных заболеваний ВОЖКТ, так как известно, что начало полового созревания сопровождается несбалансированностью и напряженностью обменных процессов, нестабильностью нейро-гормональной регуляций, что может приводить к формированию морфофункциональных изменений желудочно-кишечного тракта [5, 6]. Также не исключена вероятность изменения функционального состояния эндотелия в пубертатный период с возможным развитием эндотелиальной дисфункции (ЭД). Известно, что эндотелий, рассматриваемый как эндокринный орган, участвует практически во всех процессах, определяемых как гомеостаз, гемостаз и воспаление. Также установлено, что эндотелий - это первый орган-мишень, наиболее рано реализующий многие звенья патогенеза разной патологии, в том числе заболеваний органов пищеварения [7, 8]. Имеющиеся в настоящее время исследования участия оксида азота (NO) и эндотелина-1 (Et-1) в патогенезе хронических воспалительных заболеваниях ВОЖКТ у детей имеют противоречивый характер [9]. Выявлены единичные работы по изучению участия эндотелиальных факторов в развитии данных заболеваний [10, 11]. Также отсутствуют работы, посвященные изучению возможности использования эндотелиальных факторов в качестве диагностических критериев хронических воспалительных заболеваний ВОЖКТ, что и инициировало проведение настоящего исследования.
Цель исследования. Оценить диагностическую возможность изменений уровня метаболитов оксида азота (NOx) и эндотелина-1 в периферической крови у детей 9-15 лет, страдающих хроническим гастродуоденитом (ХГД) в сочетании с гастроэзофагеальной рефлюксной болезнью (ГЭРБ).
Материалы и методы исследования. В группу исследования вошли 154 ребенка в возрасте 9-15 лет с ХГД+ГЭРБ. Все пациенты основной группы находились в стадии клинико-эндоскопического обострения заболевания. Группу контроля составили 56 детей I-II групп здоровья, сопоставимых по возрасту, полу и СПР с основной группой. Пациенты были включены в исследование на основании информированного согласия всех родителей, дети которых принимали участие в научном исследовании.
Верификация диагноза проводилась с использованием эзофагогастродуоденоскопии и выполнением прицельной биопсии слизистой оболочки (СО) желудка и пищевода. Диагностика Нelicobacter pylori осуществлялась полимеразной цепной реакцией для детекции ДНК Нelicobacter pylori в биоптатах СО антрального отдела желудка тест-системами «Литекс» (Россия) и уреазным методом с определением уреазной активности в биоптате СО желудка путем помещения его в жидкую среду, содержащую стандартный RU-Test Нelicobacter pylori (Россия).
Исследование уровня Et-1 в сыворотке крови проводилось методом иммуноферментного анализа наборами фирмы BIOMEDICA GRUPPE (Германия). Уровень NOx в сыворотке крови пациентов определяли колориметрическим методом, основанным на ферментативной конверсии нитратов в нитриты нитратредуктазой, которая идет с участием оксида азота. Определение проводили наборами фирмы R&D (США). Обследование детей осуществлялось в стандартизированных условиях, утром, натощак.
Статистическую обработку результатов исследования с помощью программы STATISTICA 7.0 (StatSoft Inc., США) и MedCalc (версия 9.3.5.0).
В работе исследованные величины были представлены в виде выборочного среднего значения (M), стандартной ошибки средней величины (m), медианы (Me), а также 25 и 75 квартиля [25%-75%]. Достоверность различий средних величин независимых выборок оценивали с помощью параметрического критерия Стьюдента при нормальном законе распределения и непараметрического критерия Манна-Уитни при отличии распределения показателей от нормального. Проверку на нормальность распределения оценивали с помощью критерия Колмогорова-Смирнова. Статистическое сравнение долей с оценкой достоверности различий выполняли с использованием критерия хи-квадрат и Фишера. Во всех процедурах статистического анализа рассчитывали достигнутый уровень значимости (р), при этом критический уровень значимости принимался равным 0,05. Кроме того, оценку диагностической эффективности скрининговых тестов проводили с помощью анализа ROC - кривых и определения площади под ROC - кривой (AUC). Площадь под ROC-кривой - полезный обобщенный показатель качества диагностического теста. Чем больше значение AUC, тем «лучше» способность диагностического теста распознавать наличие и отсутствие болезни.
Результаты исследования и их обсуждение. Проведенное эндоскопическое и морфологическое обследования СО ВОЖКТ у 154 детей позволило выделить 2 группы больных с учетом тяжести патологического процесса. В 1 группу вошли 84 (54,5%) ребенка с поверхностным гастродуоденитом (ПГД), во 2 группу - 70 (45,5%) детей с эрозивным гастродуоденитом (ЭГД) (2 группа). У всех 154 (100%) больных гастродуоденит сочетался с гастроэзофагеальной рефлюксной болезнью, осложненной рефлюкс-эзофагитом 1 степени.
У 58 (37,7%) больных эзофагогастродуоденальная патология были ассоциирована с Нelicobacter pylori. Выявлено, что Н. pylori-позитивные больные характеризовались более частым развитием эрозивной формы поражения СО гастродуоденальной области (58,6% и 37,5% соответственно долям ЭГД+ГЭРБ среди Н. pylori-позитивных и Н. pylori-негативных пациентов) (p<0,05). Эта закономерность усиливалась при наличии антител к Helicobacter pylori. В группе Н. pylori-положительных серопозитивных больных доля ЭГД составила 76,9%, что достоверно (p<0,01) превысило долю ПГД (23,1%). В группе Н. pylori-положительных серонегативных пациентов преобладали дети с ПГД (56,2%), в то время как на ЭГД приходилось 43,8%.
Проведенное исследование характера изменений NOx и Et-1 у Н. pylori-положительных детей 1 и 2 группы позволило выявить статистически достоверные изменения изучаемых показателей у больных с ЭГД+ГЭРБ при сравнении с контролем в виде пониженного уровня NOx (9,35±0,68 мкмоль/л и 14,54±2,44 мкмоль/л соответственно, р≤0,05) и эндотелина-1 (0,29±0,05 фмоль/мл и 0,73±0,18 фмоль/мл соответственно, р≤0,05) у Н. pylori-положительных серопозитивных больных. У всех пациентов 1 группы и у Н. pylori-положительных серонегативных пациентов 2 группы уровни NOx и Et-1 не отличались от контрольных значений (р˃0,05) (табл. 1).
Таблица 1. Уровень оксида азота и эндотелина-1 у Нelicobacter pylori - положительных серонегативных и Нelicobacter pylori - положительных серопозитивных больных 1 и 2 группы
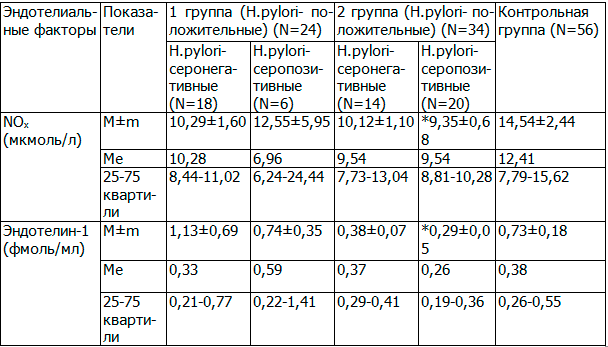
Примечание: N - к-во больных; Ме - медиана; [25-75] - нижний и верхний квартили; * - различия статистически значимы при сравнении с контрольными значениями, р≤0,05.
Было установлено, что H.pylori-ассоциированная патология ВОЖКТ сопровождалась формированием ЭД в виде преимущественного подавления синтеза оксида азота у больных с эрозивным поражением СО эзофагогастродуоденальной области, что, по-видимому, приводило к снижению цитопротективного, антибактериального и противовоспалительного эффектов NO на СО желудка. Известно, что Et-1 повышает секрецию гидрокарбонатов, включенных в состав мукозального барьера и участвующих в реализации его защитной функции. Поэтому, выявленное статистически достоверное снижение уровня Et-1 у детей 2 группы, могло свидетельствовать о снижении защитных факторов СО желудка на фоне высокой агрессии фактора гиперацидности [12]. То есть выявленная настоящим исследованием ЭД у больных с H.pylori-ассоциированной эрозивной патологией ВОЖКТ может рассматриваться как один из пусковых механизмов включения Нelicobacter pylori в повреждение слизистого барьера, что обеспечивает развитие тяжелых форм заболевания. А тот факт, что уровень NOх в сыворотке крови у H.pylori-положительных серопозитивных пациентов был достоверно ниже в сравнении с ГК (9,35±0,68 и 14,54±2,44 мкмоль/л соответственно, р=0,05), чем у H.pylori-положительных серонегативных больных (10,12±1,10 и 14,54±2,44 мкмоль/л соответственно, р>0,05), указывает на возможность, в свою очередь, H.pylori усугублять ЭД за счет способности бактерии синтезировать аргиназу, разрушающую аргинин, из которого образуется NO при участии NO-синтазы. То есть имеет место взаимообусловленный процесс: с одной стороны, для реализации повреждающего фактора, обусловленного H.pylori, необходимо наличие ЭД; с другой - способность H.pylori синтезировать аргиназу усугубляет эндотелиальную дисфункцию.
Полученные результаты, доказывающие патогенетическую роль метаболитов NO и Et-1 в формировании хронической воспалительной патологии ВОЖКТ, позволили разработать диагностические критерии выявления тяжелых форм заболевания.
Для расчета вероятности развития эрозивного поражения СО ВОЖКТ при Н. pylori-ассоциированных заболеваниях рассмотрена модель, основанная на анализе ROC-кривых уровня NOх и Et-1 в сыворотке крови. Выявлено, что модель NOх имела удовлетворительное качество (AUC=0,788±0,0525) с достаточно высокой диагностической чувствительностью 91,43% и диагностической специфичностью 61,0%. Модель Et-1 также имела удовлетворительное качество (AUC=0,737±0,064) с высокой диагностической чувствительностью 91,43% и диагностической специфичностью 36,6%. Соответственно, уровень NOх в сыворотке крови < 9,92 мкмоль/л и уровень Et-1 в сыворотке крови < 0,25 фмоль/мл могут быть использованы как прогностические критерии формирования эрозивного поражения СО ВОЖКТ, ассоциированного с Helicobacter pylori-инфекцией (табл. 2, рис. 1).
Таблица 2. Диагностические критерии Helicobacter pylori-ассоциированного хронического эрозивного гастродуоденита в сочетании с гастроэзофагеальной рефлюксной болезнью
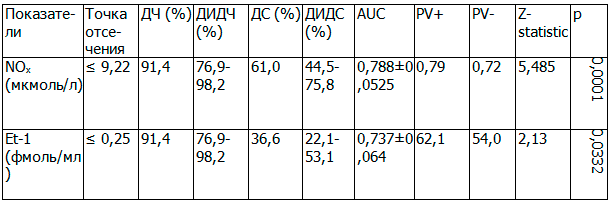
Примечание: NOх - метаболиты оксида азота; Et-1 - эндотелин-1; ДЧ - диагностическая чувствительность; ДИДЧ - доверительный интервал диагностической чувствительности; ДС - диагностическая специфичность; ДИДС - доверительный интервал диагностической специфичности; AUC - площадь под ROC-кривой; р - достоверность различий.
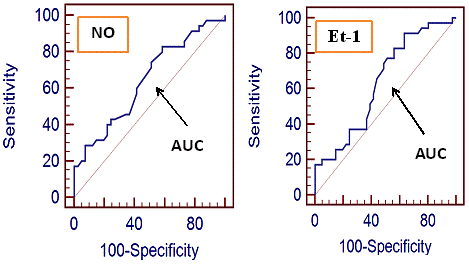
Рис. 1. ROC-кривые для прогнозирования эрозивного поражения слизистой оболочки эзофагогастродуоденальной патологии, ассоциированной с Helicobacter pylori-инфекцией, по уровню метаболитов оксида азота и эндотелина-1 в сыворотке крови.
Выводы
- При эрозивной патологии ВОЖКТ, ассоциированной с Helicobacter pylori, формируется эндотелиальная дисфункция, играющая патогенетическую роль в развитии тяжелых форм заболевания у детей, находящихся в пубертатном периоде.
- Катаральное воспаление слизистой оболочки ВОЖКТ, ассоциированное с Helicobacter pylori, не сопровождается формированием эндотелиальной дисфункции.
- Уровень NOх в сыворотке крови <9,92 мкмоль/л и уровень Et-1 в сыворотке крови <0,25 фмоль/мл могут быть использованы как диагностические критерии формирования эрозивного поражения СО ВОЖКТ, ассоциированного с Helicobacter pylori-инфекцией.
