Актуальность. В последние годы возросла значимость препаратов висмута в лечении инфекции Helicobacter pylori. Так, при применении висмута трикалия дицитрата стали понятны молекулярные механизмы защиты ДНК (дезоксирибонуклеиновой кислоты) клеток генеративной зоны слизистой оболочки желудка от мутагенных воздействий продуктов «кислородного взрыва» в нейтрофильных лейкоцитах.
При этом связывание ионами висмута свободных радикалов и торможение перекисного окисления липидов изучено только в культуре клеток [5]. А в соответствии с рекомендациями Российской Гастроэнтерологической Ассоциации после окончания эрадикационной терапии возможно продолжение лечения препаратом висмута до 4-8 недель для обеспечения защиты слизистой оболочки желудка [3].
Последнее требует проведения исследований, позволяющих определить молекулярно-клеточный эффект висмута трикалия дицитрата у пациентов с хроническим Helicobacter pylori-ассоциированным гастритом.
Цель исследования. Оценить молекулярно-клеточный эффект действия препарата висмута трикалия дицитрата на уровень повреждения ДНК клеток генеративной зоны слизистой оболочки желудка, а также определить степень и стадию хронического Helicobacter pylori-ассоциированного гастрита на фоне лечения.
Материалы и методы исследования. В исследовании принимало участие 62 пациента с хроническим Helicobacter pylori-ассоциированным гастритом.
В соответствии с рекомендациями Российской Гастроэнтерологической Ассоциации по диагностике и лечению инфекции Нelicobacter pylori у взрослых [3] и Европейскими рекомендациями - Маастрихт IV [4, 6] при хроническом Нelicobacter pylori-ассоциированном гастрите назначалась трехкомпонентная схема эрадикационной терапии, включающая Омепразол 20 мг 2 раза в день за 30 минут до еды, Амоксициллин 1000 мг 2 раза в день и Кларитромицин 500 мг 2 раза в день в течение 10 дней.
Пациенты с хроническим Нelicobacter pylori-ассоциированным гастритом методом «лотерейной» рандомизации были разделены на две группы, которые были сопоставимы по возрасту, полу и длительности хронического гастрита:
- исследуемая группа - состояла из 28 (45,2 %) пациентов, которым сразу после 10 дней трехкомпонентной эрадикационной терапии назначался висмута трикалия дицитрат (Де-Нол) в дозе 120 мг по 2 табл. 2 раза в день за 30 минут до еды в течение 4-х недель;
- группа сравнения, в нее вошли 34 (54,8 %) пациента, которым назначалась только трехкомпонентная эрадикационная терапия в течение 10 дней.
До и через 4 недели после окончания лечения проводилась фиброэзофагогастродуоденоскопия с биопсией слизистой оболочки желудка из 5-ти точек: 1 - антральный отдел желудка большая кривизна, 2 - антральный отдел желудка малая кривизна, 3 - угол желудка; 4 - тело желудка малая кривизна, 5 - тело желудка большая кривизна.
Полученные гастробиоптаты фиксировали в 10%-ном нейтральном забуференном формалине в течение 12 часов и заливали в парафин по общепринятой методике.
По Российскому пересмотру Международной классификации хронического гастрита OLGA (Operative Link for Gastritis Assessment) -system, где совмещен принцип визуально-аналоговой шкалы Модифицированной Сиднейской системы и табличной оценки степени и стадии хронического гастрита, в каждом из 5-ти гастробиоптатов описывали основные патоморфологические изменения: активность и степень воспаления, атрофию, кишечную метаплазию и степень обсемененности НР [1, 7].
В качестве градации использовались обозначения: 0 - отсутствие признака; 1 - слабая степень выраженности признака; 2 - умеренная; 3 - выраженная.
Для идентификации инфекции Helicobacter pylori до и через 4 недели после окончания лечения использовали быстрый уреазный «Хелпил»-тест и гистобактериоскопический метод (окраска 0,1% толуидиновым синим).
В качестве маркера повреждения ДНК эпителиальных клеток слизистой оболочки желудка использовали мышиные моноклональные антитела к Р53 («DAKO», Дания).
Определяли индекс метки Р53 путем оценки доли (в процентах) положительно окрашенных Р53-позитивных ядер эпителиоцитов в 10-ти случайно выбранных полях зрения (≥1000 клеток) в генеративной зоне - зоне перешейка желез, которую маркировали путем детекции гладкомышечного актина («DAKO», Дания) в миофибробластах, ассоциированных с генеративной зоной слизистой оболочки желудка.
Кумулятивным индексом метки Р53 считали сумму индексов данного маркера в 5-ти точках взятия гастробиоптатов.
Cтатистическая обработка данных проводилась на базе пакетов прикладных программ Microsoft Excel 7 и STATISTICA 6.0 (русифицированная версия).
Для проверки статистических гипотез использовали непараметрические критерии: для сравнения двух независимых групп - критерий Манна-Уитни, для сравнения двух связанных групп - критерий Вилкоксона.
В ходе сравнения категориальных переменных для оценки статистической значимости различий между группами применялся критерий χ². Результаты считались значимыми при р<0,05.
Результаты исследования и их обсуждение. При хроническом Нelicobacter pylori-ассоциированном гастрите морфологические изменения слизистой оболочки желудка до лечения характеризовались нейтрофильной и лимфоплазмоцитарной инфильтрацией собственной пластинки слизистой оболочки желудка.
В соответствии с Модифицированной Сиднейской классификацией уровень инфильтрации нейтрофильными лейкоцитами характеризовал активность воспаления, а уровень инфильтрации мононуклеарными клетками (лимфоциты, плазматические клетки) отражал степень воспаления.
При хроническом Нelicobacter pylori-ассоциированном гастрите в исследуемой группе слабая (I) степень суммарно нейтрофильной и лимфоплазмоцитарной инфильтрации в биоптатах слизистой оболочки из антрального отдела (3 биоптата) и тела желудка (2 биоптата) наблюдалась у 2 (7,2%) пациентов, а в группе сравнения - у 3 (8,8%) пациентов (χ²=0,06, р=0,809).
Умеренная (II) степень гастрита была обнаружена у 10 (35,7%) пациентов из исследуемой группы и у 12 (35,3%) пациентов из группы сравнения (χ²=0,00, р=0,973).
Выраженная (III) степень гастрита определена в исследуемой группе у 13 (46,4%) пациентов, а в группе сравнения - у 15 (44,1%) пациентов (χ²=0,03, р=0,856).
При этом у 3 (10,7%) пациентов из исследуемой группы и у 4 (11,8%) пациентов из группы сравнения была выявлена резко выраженная (IV) степень гастрита (χ²=0,02, р=0,897).
При хроническом Нelicobacter pylori-ассоциированном гастрите отсутствовали атрофические изменения слизистой оболочки желудка у 6 (21,4%) пациентов из исследуемой группы и у 8 (23,5%) пациентов из группы сравнения (χ²=0,04, р=0,844).
I стадия (слабая) атрофии была обнаружена у 8 (28,6%) пациентов из исследуемой группы и у 11 (32,4%) пациентов из группы сравнения (χ²=0,10, р=0,748).
II (умеренная) стадия атрофии выявлена в исследуемой группе у 10 (35,7%) пациентов и в группе сравнения - у 12 (35,3%) пациентов (χ²=0,00., р=0,973).
При этом у 4 (14,3%) пациентов в исследуемой группе и у 3 (8,8%) пациентов в группе сравнения была определена выраженная (III) стадия атрофии слизистой оболочки желудка (χ²=0,46, р=0,499).
Наиболее значимым морфологическим критерием успешной эрадикации Нelicobacter pylori в гастробиоптатах в исследуемой группе и группе сравнения явилось значительное уменьшение нейтрофильных лейкоцитов в собственной пластинки слизистой оболочки желудка.
В обеих группах в каждой из 5-ти точек (1-антральный отдел большая кривизна; 2-антральный отдел малая кривизна; 3-угол желудка; 4-тело желудка малая кривизна; 5-тело желудка большая кривизна) взятия гастробиоптатов было отмечено статистически значимое (р<0,05) снижение активности хронического гастрита.
Сохранение мононуклеарной воспалительной инфильтрации слизистой оболочке желудка в обеих группах не повлияло на результаты исследования, так как с помощью препарата висмута трикалия дицитрата изучалась защита от действия продуктов «кислородного взрыва», происходящего исключительно в нейтрофильных лейкоцитах.
Был ожидаемым эффект отсутствия статистически значимых отличий между группами до проведения эрадикационной терапии (р=0,460), а предполагаемым был молекулярно-клеточный эффект действия висмута трикалия дицитрата после лечения.
Прием данного препарата в течение 4-х недель по окончании трехкомпонентной эрадикационной терапии должен был привести к значимому снижению числа клеток с поврежденной ДНК именно в исследуемой группе. Но значения кумулятивных индексов метки Р53 в генеративной зоне слизистой оболочки желудка в обеих группах после лечения статистически значимо не изменились (р=0,120).
Таким образом, уровень повреждения ДНК клеток генеративной зоны слизистой оболочки желудка характеризуется высокой гетерогенностью (большой разброс значений кумулятивного индекса метки Р53), что, в свою очередь, определяет гетерогенность молекулярно-клеточного эффекта 4-х недельного приема фармакопрепарата висмута трикалия дицитрата.
Это связано с мозаичностью повреждений слизистой оболочки желудка, значительными различиями в популяции в исходном уровне числа поврежденных клеток, а также с высокой вариабельностью выборки.
Чтобы исключить фактор неопределенности, обусловленный мозаичной топографией повреждений слизистой оболочки желудка, были сопоставлены попарно показатели клеток, имеющих поврежденные ДНК, в каждой из 5-ти точек (1-антральный отдел большая кривизна; 2-антральный отдел малая кривизна; 3-угол желудка; 4-тело желудка малая кривизна; 5-тело желудка большая кривизна) взятия гастробиоптатов до и через 4 недели после окончания лечения в исследуемой группе и группе сравнения.
Статистически значимое снижение экспрессии Р53 клетками генеративной зоны слизистой оболочки желудка в исследуемой группе имело место в точке 1 (р=0,018) и 3 (р=0,012), при этом в точке 2 обнаруживалась тенденция к снижению индекса экспрессии Р53 при показателе р=0,052, близком к выбранному пороговому значению.
В группе сравнения статистически значимые отличия со снижением экспрессии Р53 выявлены только в точке 1 (р=0,016). Таким образом, молекулярно-клеточным эффектом приема фармакопрепарата висмута трикалия дицитрата является обеспечение защиты слизистой оболочки желудка: статистически значимое снижение числа клеток с поврежденной ДНК в генеративных зонах слизистой оболочки большой кривизны антрального отдела (р=0,018) и угла желудка (р=0,012).
При определении степени хронического гастрита по Российскому пересмотру Международной классификации хронического гастрита OLGA-system через 4 недели после окончания лечения установлено, что совпадение степени хронического гастрита отмечено в 11 случаях в исследуемой группе и в 15 случаях - в группе сравнения. В свою очередь, несовпадение степени хронического гастрита через 4 недели после окончания лечения выявлено в 17 случаях в исследуемой группе и в 19 случаях в группе сравнения.
Среди них уменьшение градации степени гастрита наблюдалось в 13 случаях в исследуемой группе и в 12 случаях в группе сравнения, а увеличение градации степени гастрита выявлено в 4 случаях в исследуемой группе и в 7 случаях в группе сравнения. Точки несовпадений степени выраженности воспаления слизистой оболочки желудка в обеих группах представлены в табл. 1.
Таблица 1. Точки несовпадений степени выраженности воспаления слизистой оболочки желудка; СН - случаев несовпадений
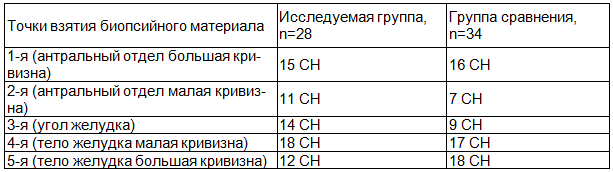
Изменение степени хронического гастрита (особенно уровень инфильтрации мононуклеарными клетками) не имело каких-либо закономерностей, и различия до и через 4 недели после окончания лечения отражали, скорее всего, мозаичность структурных изменений слизистой оболочки желудка и достаточно существенную погрешность при повторной эндоскопической оценке топографии зон взятия гастробиоптатов.
При определении стадии хронического гастрита по Российскому пересмотру Международной классификации хронического гастрита OLGA-system через 4 недели после окончания лечения установлено, что совпадение стадии хронического гастрита отмечено в 13 случаях в исследуемой группе и в 12 случаях - в группе сравнения. В свою очередь, несовпадение стадии хронического гастрита через 4 недели после окончания лечения выявлено в 15 случаях в исследуемой группе и в 22 случаях в группе сравнения. Среди них регресс стадии гастрита наблюдался в 9 случаях в исследуемой группе и в 15 случаях в группе сравнения, а прогресс стадии гастрита выявлен в 6 случаях в исследуемой группе и в 7 случаях в группе сравнения. Точки несовпадений атрофии слизистой оболочки желудка в обеих группах представлены в табл. 2.
Таблица 2. Точки несовпадений атрофии слизистой оболочки желудка
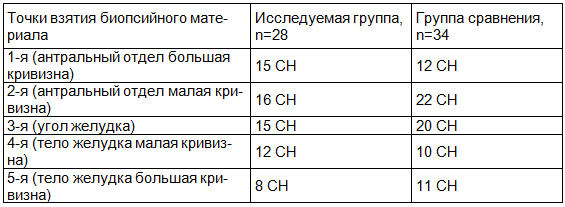
Таким образом, изменение стадии хронического гастрита (уровень атрофии слизистой оболочки желудка) при выраженной мононуклеарной инфильтрации собственной пластинки решать сложно сразу после эрадикации Нelicobacter pylori и тем более атрофические изменения могут быть мозаичными.
Объективную оценку о наличие или отсутствии атрофических изменений слизистой оболочки желудка можно будет давать через достаточно продолжительное время (6-12 месяцев) после эрадикации Нelicobacter pylori, по мере снижения мононуклеарной инфильтрации собственной пластинки слизистой оболочки желудка [2, 6].
Кроме этого, в оценке атрофических изменений слизистой оболочки желудка большое значение имеет соблюдение протокола эндоскопического забора биопсийного материала и технологии обработки материала гастробиопсии в патологоанатомическом отделении.
Выводы. На органном уровне (гастробиоптаты) обнаружены дополнительные клеточная и молекулярная мишени фармакопрепарата висмута трикалия дицитрата: в генеративной зоне слизистой оболочки желудка в результате 4-х недельного приема препарата обеспечивается защита генетического аппарата (ДНК) прогениторных клеток.
Мозаичность структурных изменений слизистой оболочки желудка является причиной несовпадения ожидаемых и реальных показателей степени и стадии хронического гастрита (по системе OLGA) до и после эрадикации Helicobacter pylori, а не отражает действительную динамику процесса в исследуемой группе и группе сравнения.
