Введение. Хронические диффузные поражения печени (ХДПП) являются одним из наиболее актуальных разделов внутренней патологии. В связи с широким распространением наркомании, алкоголизма и различных форм инфекционного гепатита отмечается повышение удельного веса диффузных заболеваний данной системы среди общей заболеваемости населения во многих странах мира. По данным ВОЗ, за последние 20 лет смертность от заболеваний печени возросла в 2 раза. ХДПП занимают первое место среди различных причин утраты трудоспособности у больных с заболеваниями желудочно-кишечного тракта.
Таким образом, медицинская проблема хронических заболеваний печени обретает медико-социальную значимость, определяемую широкой распространенностью заболеваний данной группы, тяжестью течения, ранней инвалидизацией и высокой летальностью.
К числу наиболее распространенных хронических диффузных заболеваний печени относят хронические вирусные гепатиты различной степени активности, стеатоз, стеатогепатит и циррозы печени в стадиях компенсации, субкомпенсации и декомпенсации.
Хронические гепатиты включают широкий спектр нозологически самостоятельных диффузных воспалительных заболеваний печени различной этиологии. В ряде случаев некоторые заболевания печени на определенном этапе их развития имеют ряд общих клинических и морфологических признаков, свойственных гепатитам, что требует проведения дифференциальной диагностики между ними.
Ранняя диагностика позволяет своевременно начать лечение и замедлить прогрессирование поражения печени. Большое число параметров, по которым производится оценка состояния больного, требует учета всех факторов и обоснованного подхода к диагностике, что представляет сложную задачу для врача - клинициста. При этом действия врача основываются на априорной, вероятностной оценке симптомов патологий, с одной стороны, и детерминированном подходе к постановке диагноза, с другой. Скудность клинических проявлений, их схожесть с различными другими патологическими состояниями значительно затрудняют диагностический процесс. Данное обстоятельство делает крайне сложным прогнозирование исхода заболевания печени без привлечения математических методов.
В связи с этим неоспоримо большое значение приобретает всестороннее усовершенствование методов поддержки принятия решений постановки диагноза заболеваний печени.
Использование автоматизированной системы для диагностики ХДПП на основе алгоритмов, использующих формальные методы математического анализа медицинских данных, позволит в значительной степени освободить врача от рутинной деятельности, обеспечивая возможность более глубокого анализа клинической информации.
Таким образом, актуальность проблемы заключается в необходимости разработки методов интеллектуальной поддержки процесса диагностики хронических диффузных заболеваний печени с применением методов искусственного интеллекта и математического моделирования, что способствует повышению эффективности принимаемых решений.
Целью исследования является разработка моделей и алгоритмов, повышающих эффективность процесса принятия решений при диагностике хронических диффузных поражений печени на основе многовариантного моделирования с последующим внедрением результатов исследования в клиническую практику.
Для достижения поставленной цели необходимо решить следующие задачи:
- провести статистический анализ и сформировать исходную матрицу классификационных признаков хронических заболеваний печени, представленную клиническими симптомами, результатами лабораторных и УЗИ - исследований;
- разработать математическую модель процесса принятия решений при планировании диагностического процесса заболеваний печени на основе сетей Петри;
- сформировать классификационные модели на основе экспертного оценивания и статистических методов распознавания образов для оценки состояния больных с хроническими заболеваниями печени;
- разработать алгоритм отнесения состояния пациента к одному из классов заболеваний печени на основе метода «деревьев решений»;
- реализовать систему поддержки принятий решений постановки диагноза хронических заболеваний печени на основе нейросетевого моделирования;
- создать и внедрить автоматизированную экспертную систему интеллектуализации процесса диагностики диффузных поражений печени в клиническую практику.
Для достижения поставленных задач в работе использованы методы системного анализа, распознавания образов, экспертного оценивания, прикладной статистики, имитационного моделирования, «деревьев решений», методы искусственного интеллекта и нейросетевого моделирования.
В работе получены следующие новые результаты:
- методика интеллектуальной поддержки принятия решения при диагностике хронических гепатитов, жировой дегенерации и циррозов печени, основанная на формализованном описании данных клинических, лабораторных и УЗИ - исследований;
- функциональная модель системы диагностики заболеваний печени на основе сети Петри, отличающаяся способностью формировать план диагностических мероприятий путем имитации для повышения эффективности принимаемых решений;
- методика оценки состояния больных с хроническими диффузными поражениями печени на основе статистических критериев, позволяющая учитывать индивидуальные особенности больных;
- алгоритм оценки состояния пациентов с заболеваниями печени на основе метода «деревьев решений», позволяющий определить значимость
входных переменных и снизить размерность признакового пространства;
- нейросетевые модели постановки диагноза заболеваний печени, обеспечивающие информационную поддержку принимаемых лечащим
врачом решений с проведением количественной оценки влияния различных
диагностических показателей на выходной сигнал сети;
- автоматизированная система интеллектуальной поддержки диагностики хронических диффузных поражений печени, реализующая интеграцию методов, моделей и алгоритмов рационального принятия решений.
В результате проведенного исследования разработана и научно обоснована методика дифференциальной диагностики хронических диффузных поражений печени, проведена оценка основных клинических и инструментальных показателей, позволяющая повысить эффективность диагностики хронических гепатитов минимальной, умеренной и высокой степени активности, стеатоза, стеатогепатита и цирроза печени в стадиях компенсации, субкомпенсации и декомпенсации.
Анализ классификационных признаков хронических поражений печени
Проведен анализ классификационных признаков хронических поражений печени, представленных клиническими симптомами, данными лабораторных анализов и УЗИ, целью которого является выявление наиболее значимых показателей, используемых далее для построения прогностических моделей.
Исследование проводилось на базе архивной информации по данным 256 произвольно выбранных историй пациентов от 19 до 79 лет.
Результатом анализа является вывод о малоспецифичности и слабовыраженности клинической симптоматики хронических диффузных поражений печени, в связи, с чем в процессе диагностики необходимо акцентировать внимание на данных лабораторных и инструментальных исследований.
Быстрое увеличение числа методов исследования печени наряду с развитием сети специализированных гастроэнтерологических отделений выдвигает настоятельное требование системного подхода к диагностике болезней печени. При этом врач-клиницист, применяя в работе ЭС, расширяет свои творческие возможности, но по-прежнему остается главным интеллектуальным исполнителем всего комплекса процедур диагностирования. Однако решение по управлению, полученное при помощи ЭС, может не всегда устраивать врача принимающего решение. Применение имитационного моделирования позволяет значительно повысить качество диагностики ХДПП.
Моделирование процесса управления постановкой диагноза заболеваний печени реализуется на основе модифицированной сети Петри, которая позволяет проводить формирование функциональной модели системы диагностики, отслеживать ее текущее состояние, приводить различные варианты управления путем имитации.
Имитационная сетевая модель для диагностики хронических гепатитов различной степени активности, стеатоза, стеатогепатита и циррозов печени в стадиях компенсации, субкомпенсации и декомпенсации представлена на рис. 1.
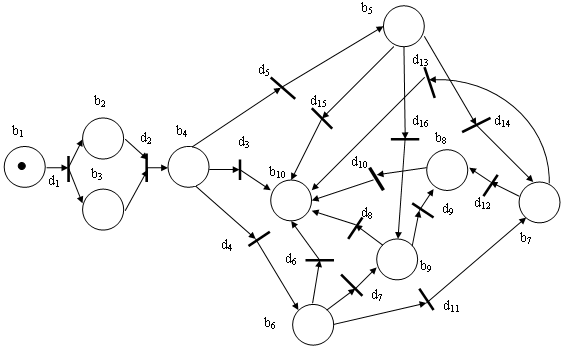
Рис. 1. Графическое изображение сетевой имитационной модели диагностики хронических диффузных заболеваний печени.
Разработанная сетевая модель позволяет формировать план диагностических мероприятий. Функциональные назначения условий и переходов приведены в табл. 1.
Таблица 1. Функциональные назначения условий и переходов

Применение различных методов поддержки принятия решений для дифференциальной диагностики хронических диффузных поражений печени
Рассмотрим применение различных методов поддержки принятия решений для дифференциальной диагностики хронических диффузных поражений печени (экспертных оценок, «деревьев решений», статистического и нейросетевого моделирования).
Обследование пациентов производилось с помощью общепринятых клинико-инструментальных методик для диагностики хронических диффузных поражений печени.
Для определения диагностической ценности и прогностической значимости наиболее часто встречающихся клинических и инструментальных признаков ХДПП использовался метод экспертного оценивания, в конечном итоге позволяющий исключить ряд исследований, несущих малое или несущественное количество информации в процессе диагностики. В качестве понятия «признак» взят результат клинического, лабораторного или инструментального исследования больного с различной степенью активности хронического гепатита (минимальной, умеренной, высокой), стеатоза, стеатогепатита или цирроза в стадии компенсации, субкомпенсации и декомпенсации. Диагностическую ценность признаков измеряли соответственно количеством информации, которую, по мнению эксперта, вносит данный признак или комплекс признаков в диагностику состояния, выраженную в баллах по значимости каждого признака для различных стадий заболеваний (1 - наименее значимый признак, 6 - наиболее информативный показатель).
В результате использования процедуры кластерного анализа заболевания печени были выделены в отдельные группы в зависимости от входных параметров. Результаты классификации пациентов приведены на рис. 2. Достоверность кластерного анализа составила 93,75 %.
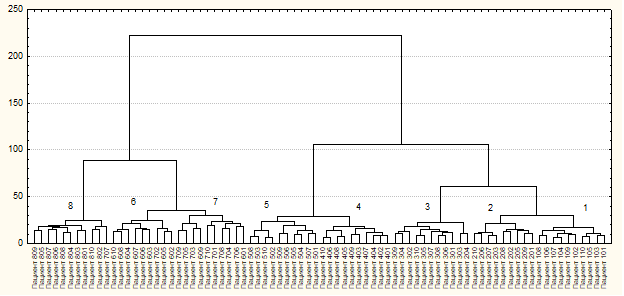
Рис. 2. Дендрограмма иерархической классификации пациентов по заболеваниям печени, где 1, 2 и 3 классы - хронический гепатит минимальной, умеренной и высокой степени активности соответственно; 4 и 5 классы - стеатоз и сеатогепатит; 6, 7 и 8 классы - цирроз печени в стадии компенсации, субкомпенсации и декомпенсации.
По результатам классификации был проведен дискриминантный анализ данных и получены математические модели каждого из 8 заболеваний, позволяющие прогнозировать к какой группе будет принадлежать тот или иной больной. Проверка точности построенных моделей осуществлялась с помощью контрольной группы, состоящей из 131 наблюдения.
Полученные дискриминантные функции каждого заболевания имеют следующий вид:
Z1=-5,982-0,512*P1-0,414*P2-0,480*P3+0,0779*P4+0,830*P5+0,119*
*P6+0,524*P7+0,038*P8-0,173*P9+0,155*P10-0,257*P11-0,296*P12-0,712*
*P13-0,547*P14+0,170*P15;
Z2=-19,280-1,219*P1-0,375*P2-0,702*P3-0,279*P4+1,684*P5+0,815*
*P6+0,388*P7+0,357*P8+0,073*P9+1,638*P10-0,560*P11-1,255*P12-1,081*
*P13-0,180*P14+0,292*P15;
Z3=-32,471-1,512*P1-0,715*P2-1,158*P3-0,177*P4+2,054*P5+1,133*
*P6+0,262*P7+1,114*P8+0,767*P9+1,452*P10+0,184*P11-1,581*P12-1,593*
*P13-1,564*P14+0,377*P15;
Z4=-10,790-1,331*P1-0,677*P2-0,239*P3-0,591*P4+0,012*P5-0,014*
*P6-0,251*P7+0,433*P8-0,501*P9+2,184*P10+0,259*P11-1,646*P12-0,663*
*P13-0,581*P14+0,172*P15;
Z5=-19,120-1,543*P1-0,345*P2-0,887*P3-0,651*P4+1,590*P5+0,892*
*P6+0,060*P7+0,675*P8-0,621*P9+1,964*P10+0,679*P11-1,801*P12-1,070*
*P13-1,122*P14+0,263*P15;
Z6=-21,871+1,239P1+0,722P2+0,063*P3+0,219*P4+1,338*P5+0,624*
*P6-0,030*P7+1,021*P8+0,056*P9+1,255*P10+0,277*P11+0,233*P12-0,281*
*P13+1,030*P14+0,214*P15;
Z7=-36,728+3,191*P1+2,623*P2+1,119*P3-0,264*P4+0,720*P5+0,166*
*P6+0,031*P7+0,603*P8+0,435*P9+0,703*P10-0,310*P11+1,181*P12+2,667*
*P13+2,379*P14+0,232*P15;
Z8=-86,973+4,467*P1+4,410*P2+3,543*P3-1,205*P4+0,089*P5-0,123*
*P6+0,823*P7+0,557*P8+1,208*P9+0,710*P10-0,433*P11+1,554*P12+6,809*
*P13+4,750*P14+0,221*P15,
где Z1 - вероятность заболевания хроническим гепатитом минимальной степени активности; Z2 - умеренной степени активности; Z3 - высокой степени активности; Z4 - стеатоз; Z5 - стеатогепатит; Z6 - цирроз печени в стадии компенсации; Z7 - в стадии субкомпенсации; Z8 - цирроз печени в стадии декомпенсации; Р1 - варикоз вен пищевода по данным эзофагодоуденоскопии; Р2 - отеки нижних конечностей; Р3 - снижение уровня протромбина; Р4 - повышение уровня связанного билирубина; Р5 - повышение уровня АСАТ; Р6 - повышение уровня АЛАТ; Р7 - повышение уровня щелочной фосфотазы; Р8 - снижение уровня альбуминов; Р9 - повышение СОЭ; Р10 - гепатомегалия по УЗИ; Р11 - эхоструктура диффузно неоднородная; Р12 - спленомегалия по УЗИ; Р13 - асцит; Р14 -признаки портальной гипертензии по УЗИ с ЦДК (ультразвуковое исследование с цветовым допплеровским картированием); Р15 - обобщенный показатель всех признаков.
Значение критерия Уилкса Λ=0,0010 стремится к нулю, что говорит о хорошем различии между классами.
Достоверность постановки диагноза на основе дискриминантных функций составляет 94,6%, что характеризует высокие интерполяционные свойства полученных моделей.
Разработаны прогностические модели принадлежности векторов наблюдений к одному из исследуемых классов ХДПП на основе метода «деревьев решений». В качестве целевой переменной использовался класс заболевания.
В результате исследования было получено «дерево решений» оценки состояния больных с хроническими диффузными поражениями печени, построенное без применения жестких мер по отсечению ветвей. Полное «дерево» применяет 16 предикторных переменных, состоит из 47 узлов и использует 25 логических правил (рис. 3).

Рис. 3. «Дерево» решений классификации заболеваний ХДПП.
Просмотр «дерева» позволяет оценить значимость предикторных переменных и выделить наиболее информативные для снижения размерности признакового пространства. Достоверность постановки диагноза на тестовом множестве составляет 90,1%. Преимущество «деревьев решений» состоит в том, что они идеально приспособлены для графического представления результатов, и поэтому сделанные на их основе выводы гораздо легче интерпретировать, чем если бы они были представлены только в числовой форме.
На следующем этапе исследования для решения задачи классификации и прогнозирования разработана нейросетевая модель постановки диагноза хронических поражений печени на базе многослойного персептрона. Обучение проводилось в режиме с кросс-проверкой на контрольном множестве: сеть обучалась на 120 примерах, 120 примеров было выделено в качестве дополнения и использовалось для независимого контроля качества сети. Для повышения эффективности работы модели было использовано экспертное оценивание при отборе наблюдений для реализации входной матрицы признаков. В результате предложена полносвязная двухслойная сеть с 31 входами и восемью выходами, соответствующими классам заболевания. Сеть имеет два скрытых слоя, состоящих из 10 нейронов. Функция активации нейронной сети представляет собой сигмоидальный преобразователь и имеет вид
![]()
Достоверность постановки диагноза при применении нейросети составляет 90,7 %.
Таким образом, разработанная нейросеть адекватно прогнозирует новые наблюдения.
Автоматизированная экспертная система интеллектуализации процесса диагностики хронических диффузных поражений печени.
На основании реализованных моделей и алгоритмов разработана автоматизированная экспертная система интеллектуализации процесса диагностики хронических диффузных поражений печени.
Разработанная автоматизированная система, структурная схема которой изображена на рис. 4, позволяет производить оценку состояния больных с хроническими диффузными заболеваниями печени на основе клинических, лабораторных признаков и выявленных патологий при ультразвуковом исследовании, что уменьшает трудоемкость принятия решений при диагностике ХДПП и обеспечивает повышение эффективности этого процесса.
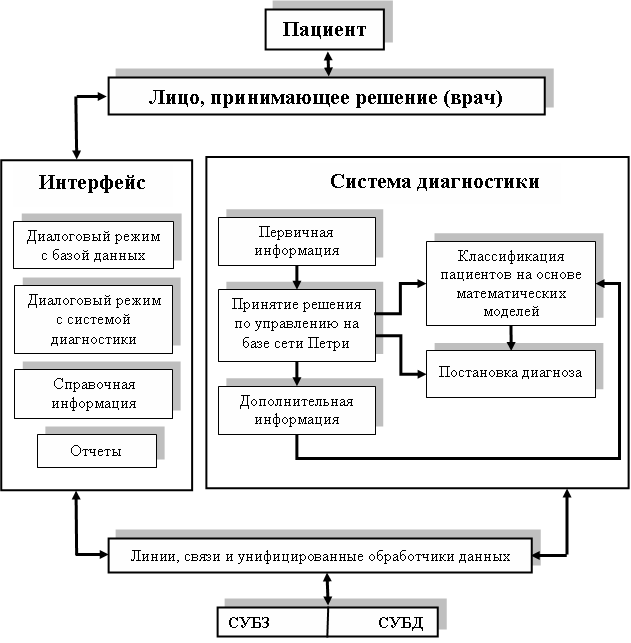
Рис. 4. Структурная схема программной реализации системы диагностики заболеваний печени.
Выводы:
- Проведен системный анализ путей повышения эффективности управления диагностикой хронических гепатитов, жировой дегенерации и циррозов печени различной степени тяжести на основе методов поддержки принятия решений.
- Выделены наиболее информативные факторы из множества динамически изменяющихся параметров состояния пациента, используемые для построения прогностических моделей постановки диагноза ХДПП.
- Реализована функциональная модель на основе сети Петри, позволяющая повысить эффективность принятия решений по управлению процессом диагностики заболеваний печени.
- Предложена классификация пациентов по различным диагностическим показателям для определения класса заболеваний и сформированы математические модели на основе дискриминантного анализа.
- Разработан алгоритм оценки состояния пациентов с ХДПП на основе метода «деревьев решений», позволяющий оценить значимость входных переменных и снизить размерность признакового пространства.
- Реализована нейросетевая модель постановки диагноза хронических поражений печени на базе многослойного персептрона. В результате анализа возможных вариантов сокращения признакового простанства и повышения эффективности работы модели предложено экспертное оценивание при отборе наблюдений для реализации входной матрицы признаков.
- По результатам сравнения интерполяционных качеств разработанных моделей наиболее достоверными показали себя математические функции, полученные методом дискриминантного анализа.
- На основании реализованных моделей и алгоритмов разработана автоматизированная экспертная система интеллектуализации процесса диагностики хронических диффузных поражений печени.
Статья представляет собой сокращенную версию автореферата защищенной диссертации автора.
