Развитие синдрома механической желтухи (МЖ) у пациентов с билиарной патологией значительно отягощает течение основного заболевания и требует неотложных мер направленных на декомпрессию желчевыводящей системы. Течение МЖ нередко сопровождается проявлениями холангита и прогрессирующей печеночно-клеточной недостаточностью. Вследствие этого хирургические вмешательства сопровождаются большим числом осложнений, а послеоперационная летальность достигает 15-30%. Неоспоримой догмой на настоящее время считается – дооперационная билиарная декомпрессия [3].
Методики транспеченочного наружного билиарного дренирования включают чрескожные антеградные методики, выполняемые под сонорентгеноскопическим контролем, применяемые внеоперационно, и интраоперационное каркасное ретроградное дренирование желчевыводящих протоков (Рraderi-Smith и Saypol-Kurian). Установленные транспеченочно в билиарный тракт дренажи в последующем позволяют выполнять лечебно-диагностические манипуляции с использованием рентгенхиругических и фиброэндоскопических методик, непосредственно чресфистульным доступом [3,4].
Неотъемлемой составляющей успешного чресфистульного чреспеченочного эндобилиарного вмешательства является каркасная и механическая прочность дренажного канала, позволяющая сохранять направление и форму после извлечения дренажа, для последующей продуктивной инструментальной инвазии. Определяющую и непосредственную роль в формирование дренажного канала играет образующаяся, вслед за механическим повреждением инородным телом (дренажом) – парадренажная соединительная ткань [4,5].
В процессе формирования соединительной ткани последовательно меняются процессы альтерации резорбции и пролиферации, с характерным изменением клеточного и тканевого состава, завершающий этап развития и формирование – ткань, состоящая из плотных коллагеновых и эластических волокон с образованной капиллярной сетью. Выполненный из подобной ткани манипуляционно-дренажный канал полноценно обеспечивает его герметичность и отграниченность от сосудисто-секреторных структур печени, и позволяет безопасно и адекватно выполнять лечебно-диагностические инструментальные манипуляции [2,6].
Цель исследования: формирование экспериментальной модели подопытных животных с наружным транспеченочным билиарным дренированием и определение сроков развития и формирования парадренажной соединительной ткани.
Материалы и методы исследования. Эксперимент выполнен на 35 лабораторных крысах линии Wistar, самцах, массой 250-300 г, прошедших карантинный режим вивария КГМУ. Все животные содержались в одинаковых условиях, на обычном пищевом рационе. Для получения достоверных результатов формировались 7 групп по 5 животных в каждой. Все исследования проводили с соблюдением принципов, изложенных в «Конвенции по защите позвоночных животных, используемых для экспериментальных и других целей» (г. Страсбург, Франция, 1986) [7]. Животных из эксперимента выводили под хлороформным наркозом. При планировании эксперимента подробно изучена топографическая анатомия и принципы моделирования эксперимента у крыс [1].
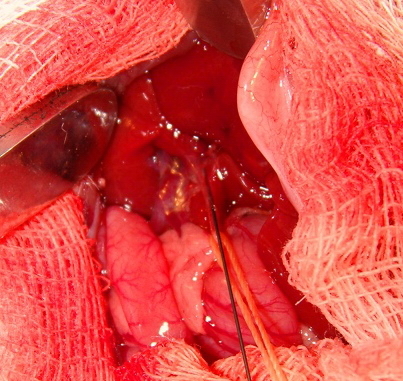
Под эфирным наркозом, после выполнения лапаротомии в строго асептических условиях, выделялся общий желчный проток в печеночно-двенадцатиперстной связке крысы. В средней трети производилась его пункция и проксимально по направлению к печени через долевой проток (выбор протока не принципиален) вводился гибкий ангиографический проводник Miracle 6, диаметром 0,014 Inch (рис. 1).
 |
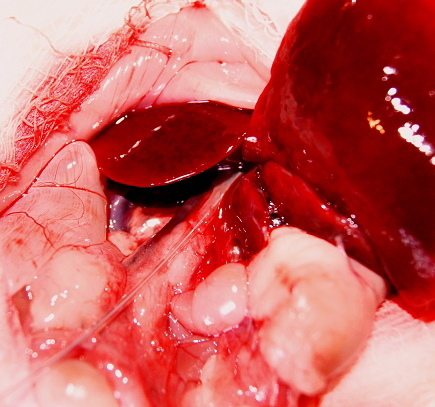 |
| Рис. 1. Фотография. В общий желчный проток крысы введен ангиографический проводник. | Рис. 2. Фотография. В печеночные протоки крысы введен мультиперфорированный катетер. |
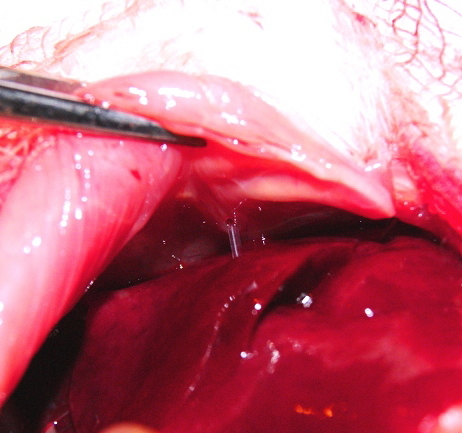
Через печеночную паренхиму на диафрагмальной поверхности печени и сквозь вентральную стенку крысы проводник выводился на кожу, кожа в месте выхода предварительно рассекалась. Далее по установленному проводнику вводился мультиперфорированный катетер для эпидуральной анестезии, диаметром 18G (рис. 2).
Катетер устанавливался таким образом, что бы его дистальная часть располагалась в нижней трети общего желчного протока крысы, дистальнее места пункции, а проксимальная часть над ее кожей, перфорационные отверстия моделировали на протяжении 10-12 мм катетера и строго соответствовали внепеченочной части желчных путей крысы. Пункционная рана общего желчного протока перитонезировалась элементами сальника, с фиксацией шовным материалом. Наружная часть катетера фиксировалась к коже крысы (рис. 3, 4).
 |
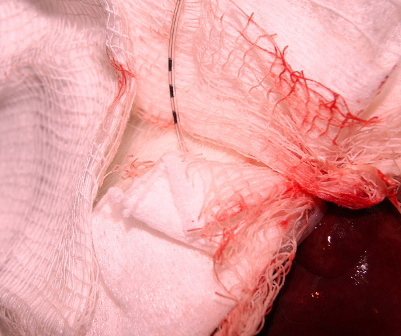 |
| Рис. 3. Фотография. Через диафрагмальную поверхность печени крысы катетер выведен на кожу. | Рис. 4. Фотография. Эндобилиарный катетер фиксирован к коже крысы. Моделировано наружное чреспеченочное дренирование желчных протоков. |
Были сформированы 7 групп животных по 5 в каждой, группы определялись исходя из поставленной цели эксперимента – определение сроков формирования соединительной ткани вокруг дренажа, и соответствовали суткам вывода из эксперимента: 2 сут., 4 сут., 6 сут., 8 сут., 10 сут.,12 сут., 14 сут.
Гистологический материал представлял собой участок парадренажной зоны печени крысы. Приготовление гистологического материала было стандартным: фиксация в растворе формалина, дегидратация и заливка парафином, микротомирование и окрашивание по Ван-Гизон и гематоксилин-эозином, увеличение 1 к 60 и 1 к 300. Выполнено в Курском областном патологоанатомическом бюро.
Результаты исследования и их обсуждение. Изменения в стенке свищевого хода печени крысы на 2-е сутки. В ткани печени определяется свищевой ход диаметром 1,6 мм. Стенка свищевого хода представлена некротической тканью печени с очаговыми кровоизлияниями, фибрином, сегментарным отёком. Клеточный состав состоит из макро и микрофагов жизнедеятельность которых направлена, в основном, на резорбциею некротической ткани. Эластический и коллагеновый каркасы не сформированы. При окраске на коллагеновые волокна по Ван-Гизон видны только остатки разрушенных коллагеновых волокон, входящих в состав портальных трактов. Вновь образованных волокон на 2 сутки в стенке свищевого хода не определяется (рис. 5 а-в).

Рис. 5а. Гистологическая структура парадренажной зоны печени крысы на 2-е сутки. Обзорная микрофотография, увеличение 1 х 60, окраска по Ван-Гизон. Зона некроза в стенке свищевого хода распространяется на всю толщу и широко варьирует, толщиной от 0,1 до 1 мм. В верхнем сегменте преимущественно отёк. Остатки коллагеновых волокон портальных трактов прослеживаются только по периферии.
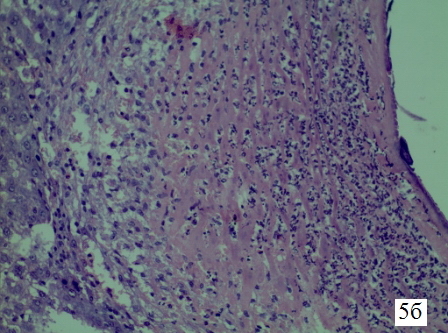
Рис. 5б. Гистологическая структура парадренажной зоны печени крысы на 2-е сутки. Микрофотография стенки свищевого хода, увеличение 1х300, окраска гематоксилин+эозин. Большое увеличение зоны некроза. Разрушенные печеночные клетки и густой воспалительный инфильтрат, состоящий преимущественно из полиморфноядерных лейкоцитов.
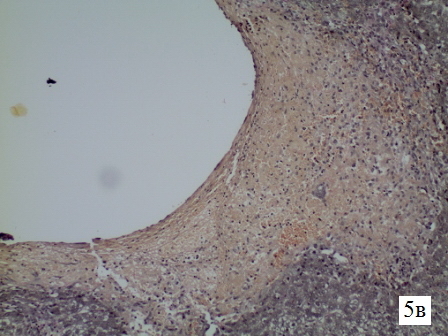
Рис. 5в. Гистологическая структура парадренажной зоны печени крысы на 2-е сутки Микрофотография стенки свищевого хода, увеличение 1х300, окраска по Ван-Гизон на коллагеновые волокна (розовое окрашивание). Вновь образованных коллагеновых волокон на 2 сутки не определяется.
Изменения в стенке свищевого хода печени крысы на 6-е сутки. На 6-е сутки резорбция некротической ткани закончена. Воспалительный инфильтрат представлен остатками нейтрофильных лейкоцитов, эозинофилами и лимфоцитами. Вся стенка представлена соединительной тканью различной степени зрелости от периферии к центру. По периферии плотность коллагеновых волокон выше, здесь формирование полноценной плотной соединительной ткани завершено. Ближе к центру соединительная ткань более рыхлая, клеточная, с меньшим количеством коллагеновых волокон. Здесь формирование плотной соединительной ткани ещё не завершено (рис. 6 а-в).
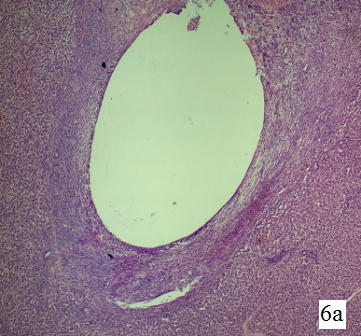
Рис. 6а. Гистологическая структура парадренажной зоны печени крысы на 6-е сутки. Обзорная микрофотография, увеличение 1х60, окраска гематоксилин+эозин. Зона некроза не определяется, стенка представлена соединительной тканью различной степени зрелости. Воспалительный инфильтрат полиморфный и носит подострый характер.
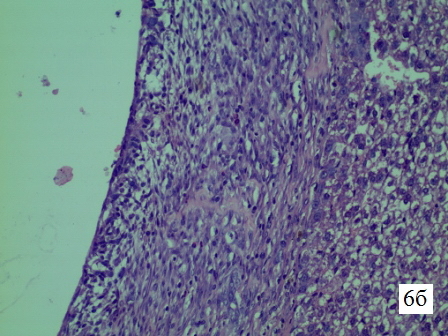
Рис. 6б. Гистологическая структура парадренажной зоны печени крысы на 6-е сутки. Микрофотография стенки свищевого хода, увеличение 1х300, окраска гематоксилин+эозин. Соединительная ткань по периферии более зрелая – межуточное вещество более волокнистое и менее клеточное. Ближе к центру соединительная ткань разрыхляется, становится менее волокнистой, местами сохраняется воспалительный инфильтрат, представленный небольшим количеством эозинофилов, остатками нейтрофилов, плазмоцитами.

Рис. 6в. Гистологическая структура парадренажной зоны печени крысы на 6-е сутки. Микрофотография стенки свищевого хода, увеличение 1х300, окраска по Ван-Гизон на коллагеновые волокна. По периферии (до 50% толщины стенки) большое количество коллагеновых волокон (розовое окрашивание), они формируют пучки, что обеспечивает максимальный механический защитный эффект. Ближе к центру волокон меньше, они расположены более рыхло.
Изменения в стенке свищевого хода печени крысы на 10-е сутки. Стенка свищевого хода полностью представлена зрелой плотной соединительной тканью с хорошо развитым коллагеновым остовом от периферии к центру. Сформирована капиллярная сеть стенки (рис. 7 а-в).
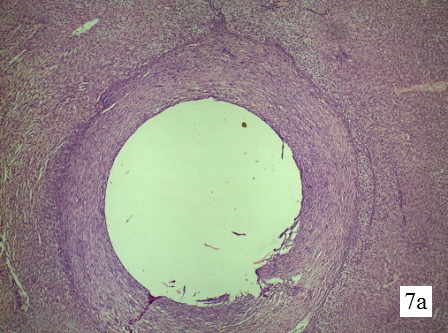
Рис. 7а. Гистологическая структура парадренажной зоны печени крысы на 10-е сутки. Обзорная микрофотография, увеличение 1х60, окраска гематоксилин+эозин. Стенка свищевого хода представлена зрелой плотной соединительной тканью.
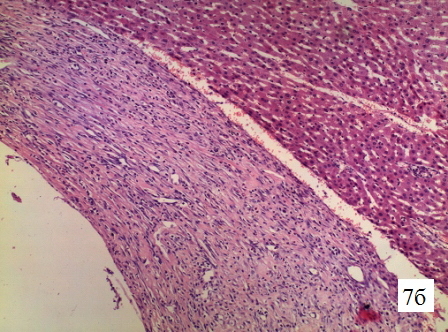
Рис. 7б. Гистологическая структура парадренажной зоны печени крысы на 10-е сутки. Микрофотография стенки свищевого хода, увеличение 1х300, окраска гематоксилин+эозин. Соединительная ткань зрелая на всю толщу стенки. Вновь образованные капилляры пронизывают половину толщины стенки свища.

Рис. 7в. Гистологическая структура парадренажной зоны печени крысы на 10-е сутки. Микрофотография стенки свищевого хода, увеличение 1х300, окраска по Ван-Гизон на коллагеновые волокна. Коллагеновые волокна (розовое окрашивание) формируют плотные пучки на всю толщу стенки, оплетая капиллярную сеть.
Изменения в стенке свищевого хода печени крысы на 14-е сутки. Изменения незначительно отличаются от 10-х и 12-х суток. Стенка свищевого хода сформирована как орган, полностью представлена зрелой плотной соединительной тканью с хорошо развитым коллагеновым остовом (очаговая гиалинизазия) от периферии к центру. Сформирована капиллярная сеть стенки («богатая васкуляризация») (рис. 8 а-б).

Рис. 8а. Гистологическая структура парадренажной зоны печени крысы на 14-е сутки. Микрофотография стенки свищевого хода, увеличение 1х300, окраска гематоксилин+эозин. Соединительная ткань зрелая на всю толщу стенки. Вновь образованные капилляры пронизывают субтотально стенку свища. Появление сосудистых сплетений по периферии свища.
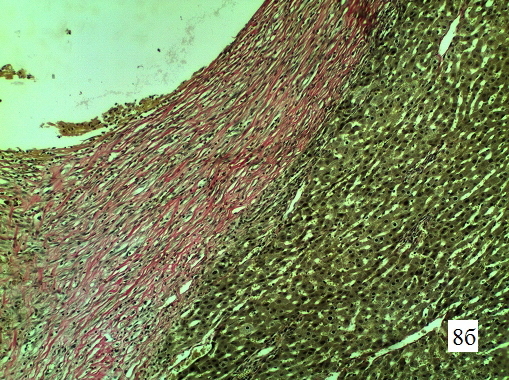
Рис. 8б. Гистологическая структура парадренажной зоны печени крысы на 14-е сутки. Микрофотография стенки свищевого хода, увеличение 1х300, окраска по Ван-Гизон на коллагеновые волокна. Коллагеновые волокна (розовое окрашивание) формируют плотные пучки на всю толщу стенки, местами образуя гомогенные гиалинизированные пучки.
В результате проведенного исследования подтверждено, что отграничительные барьерные и каркасные свойства парадренажного транспеченочного канала обеспечивает вновь образованная соединительная (грануляционная) ткань. Ее формирование и развитие происходит непосредственно в месте инструментального повреждения ткани печени, и последовательно проходит несколько фаз. Альтерация и резорбция – начинаются с 1-х и завершаются к 4-м суткам эксперимента. Параллельно с ними активизируются и протекают фазы синтеза и пролиферации, начинающиеся уже с 3-4-х суток и плавно переходящие в фазу дифференцировки и «созревания» с 6-7-х суток. На 6-е сутки эксперимента видно, что образованная парадренажная соединительная ткань неоднородна, ее формирование еще не закончено, она на половину состоит из коллагеновых и эластических волокон. Процессы ее дифференцировки и созревания завершаются к 10-м суткам эксперимента, когда она представлена плотными коллагеновыми волокнами на всю её толщу с развитой капиллярной сетью. Процессы ее дифференцировки продолжаются после 10-х суток, однако принципиально интересующих отличий на 12-е и 14-е сутки эксперимента получено не было.
Выводы. Таким образом, на основании проведенного исследования можно сделать выводы, что с 6-х суток чреспеченочного дренирования, парадренажная зона очистилась от некротических клеток, травматическое воспаление нивелировано. Сформирована незрелая грануляционная ткань, состоящая из эластических и коллагеновых волокон, обеспечивающая в основном гистологический барьер между дренажем и паренхимой печени, который предотвращает патологические билиовенозные рефлюксы. В клинической практике считаем возможным с 6-х суток выполнение малоинвазивных чресфистульно-чреспеченочных лечебно-диагностических рентгенхирургических манипуляций с возможной дилатацией фистульного канала. С 10-х суток, когда формирование зрелой грануляционной ткани, состоящей из плотных коллагеновых волокон с сосудистой сетью, практически завершено, она полноценно обеспечивает защиту от механического воздействия и выполняет каркасную функцию. Выполненный зрелой грануляционной тканью дренажный канал позволяет безопасное выполнение эндобилиарных чресфистульных манипуляций с использованием ригидной оптики и манипуляторов.
