Сахарный диабет (СД) I типа является широко распространенным хроническим заболеванием, развивающимся преимущественно в детском и подростковом возрасте и представляющим серьезную медицинскую и социальную проблему [1]. В результате аутоиммунной атаки организма разрушаются β-клетки поджелудочной железы, что приводит к прогрессированию инсулиновой недостаточности [4].
На сегодняшний день, проблема достижения полной клинико-метаболической компенсации СД I типа чрезвычайно актуальна. Несмотря на проведение адекватной заместительной терапии, манифестируют тяжелые осложнения, приводящие к инвалидизации и смертности пациентов уже в молодом возрасте [4].
Учитывая вышеизложенное, необходим поиск и включение в комплексную терапию СД I типа дополнительных средств, усиливающих эффекты традиционного лечения.
Исходя из данных литературы о механизмах действия α-липоевой кислоты, ее применение патогенетически обосновано в качестве средства иммунометаболической коррекции при СД I типа у детей [5,10]. Однако, в современной клинической практике препараты α-липоевой кислоты используются лишь при лечении диабетической полинейропатии [9], а ее эффективность при неосложненном диабете, особенно на ранних этапах развития заболевания не изучены.
Целью исследования являлось установление характера иммунологических расстройств и оценка эффективности их коррекции препаратом «Берлитион» при СД I типа у детей с различной давностью заболевания.
Материалы и методы исследования
Нами было обследовано 136 детей, страдающих СД I типа, и 30 детей контрольной группы в возрасте от 9 до 16 лет. Исследование проводилось на базе эндокринологического отделения Областной детской клинической больницы г. Курска. Пациенты с СД I типа имели различную давность заболевания, были госпитализированы в стадии декомпенсации и не имели сопутствующей аутоиммунной, врожденной, инфекционной патологии, которая затруднила бы интерпритацию полученных данных. В контрольную группу включены дети без аутоиммунной, врожденной, инфекционной патологии и аллергических заболеваний.
Пациентов с СД I типа распределяли по группам в зависимости от давности заболевания (стаж диабета до двух лет – группа 1, от трех до пяти лет – группа 2, более пяти лет – группа 3) и подгруппам – в зависимости от вида проводимой терапии. В подгруппу 1А вошли 23 ребенка (11 мальчиков и 12 девочек), подгруппу 2А – 23 пациента (11 мальчиков и 12 девочек), подгруппу 3А – 24 ребенка (10 мальчиков и 14 девочек). Дети этих подгрупп получали традиционную терапию. Подгруппу 1Б составили 22 ребенка (11 мальчиков и 11 девочек), подгруппу 2Б – 22 пациента (9 мальчиков и 13 девочек), подгруппу 3Б – 22 ребенка (7 мальчиков и 15 девочек). Дети указанных подгрупп наряду с традиционной терапией получали «Берлитион». В контрольную группу вошли 17 мальчиков и 13 девочек, сопоставимых по возрасту.
«Берлитион» применяли в дозе 300 мг внутривенно капельно 1 раз в сутки на протяжении 7 дней, с дальнейшим переходом на поддерживающий пероральный прием в той же дозе в течение месяца [6].
Фагоцитарную активность нейтрофилов периферической крови оценивали по фагоцитарному показателю (ФП) и фагоцитарному числу (ФЧ), кислородзависимую активность – по реакции восстановления нитросинего тетразолия спонтанной и стимулированной зимозаном (НСТ-тест) с расчетом функционального резерва [3]. Уровень IgA, IgM, IgG определяли методом радиальной иммунодиффузии по G. Mancini [12]. Изучение содержания СD3+ (общие Т-лимфоциты), CD4+ (Т-хелперы), CD8+ (цитотоксические клетки), CD20+ (В-лимфоциты) проводили непрямым иммунопероксидазным методом с использованием моноклональных антител (ТОО «Сорбент», г. Москва) [8]. Концентрации цитокинов исследовали в сыворотке крови детей методом твердофазного иммуноферментного анализа с использованием унифицированных тест-систем Pro Con [11]. Исследование иммунологических показателей проводили при поступлении детей в стационар и по окончании терапии.
Статистическую обработку результатов исследования осуществляли путем вычисления средней арифметической (М) и среднего квадратичного отклонения (σ). Достоверность различий сравниваемых показателей определяли с помощью t критерия Стьюдента [2].
Полученные результаты и их обсуждение
На первом этапе исследования нами были изучены показатели функциональной активности нейтрофилов периферической крови, клеточного и гуморального иммунитета, цитокинового статуса у детей с учетом стажа заболевания (табл. 1).
У всех детей с диабетом были выявлены более низкие значения ФЧ и ФП по сравнению с контролем (p<0,05). При этом минимальные параметры зарегистрированы у пациентов группы 3, отличающиеся от контрольных значений в 2,2 раза и 1,3 раза соответственно (p<0,05). Аналогично изменялись уровни спонтанного и стимулированного НСТ-теста и индекс активации нейтрофилов (ИАН). Полученные нами данные свидетельствовали о прогрессировании нарушений показателей функциональной активности нейтрофилов периферической крови, выявляемых уже на ранних этапах развития заболевания, что может повышать риск развития бактериальных осложнений (табл.1).
У детей с давностью СД I типа до двух лет отмечалось достоверное увеличение содержания CD4+ лимфоцитов в 1,7 раза, абсолютного числа CD20+ лимфоцитов в 1,8 раза и всех трех классов Ig по сравнению с контрольными значениями (p<0,05). Кроме того, выявлено повышение концентрации ИЛ-1β, ФНОα в 11,6 раза и снижение - ИЛ-4, ИЛ10 в 33 и 22 раза соответственно по сравнению с контрольной группой (p<0,05). При давности СД более пяти лет развивалась иммуносупрессия, о чем свидетельствовало снижение уровня CD3+, CD4+, CD20+лимфоцитов, IgА и IgМ (табл. 1).
Таким образом, при малом стаже заболевания выявляются изменения, характерные для активного иммунного воспаления, с увеличением давности диабета отмечается истощение иммунной системы, вследствие чего развивается иммуносупрессия. Полученные данные указывают на необходимость и целесообразность включения в комплексную терапию данного заболевания дополнительных лекарственных препаратов, способных корригировать имеющиеся нарушения и усиливать эффекты инсулинотерапии [7].
Таблица 1. Показатели иммунного статуса у детей с различным стажем сахарного диабета I типа (М±σ)
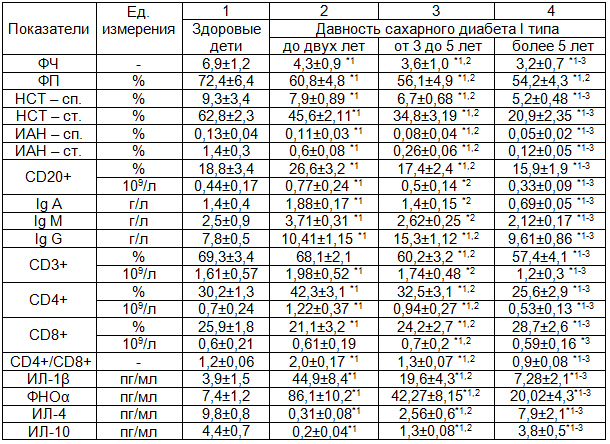
Примечания: 1. * - p<0,05; 2. Цифра рядом со звездочкой указывает на группу, по отношению к которой различия достоверно отличаются.
При последующей сравнительной оценке эффективности коррекции выявленных иммунных нарушений «Берлитионом» показано, что изолированная традиционная терапия не оказывала влияния на измененные показатели клеточного, гуморального звеньев иммунитета, цитокинового статуса и функциональной активности нейтрофилов периферической крови.
У детей с длительностью СД до двух лет комплексное лечение «Берлитионом» достоверно снизило абсолютное содержание CD3+ и CD4+ клеток в 1,3 раза по сравнению с исходными значениями (p<0,05). При достижении нормального абсолютного уровня CD8+ лимфоцитов на фоне терапии снижался CD4+/CD8+ в 1,2 раза (p<0,05). Абсолютное содержание CD20+ лимфоцитов в данной подгруппе уменьшилось в 1,4 раза, концентрация Ig всех классов снижалась по сравнению с исходными значениями (p<0,05) (рис. 1).
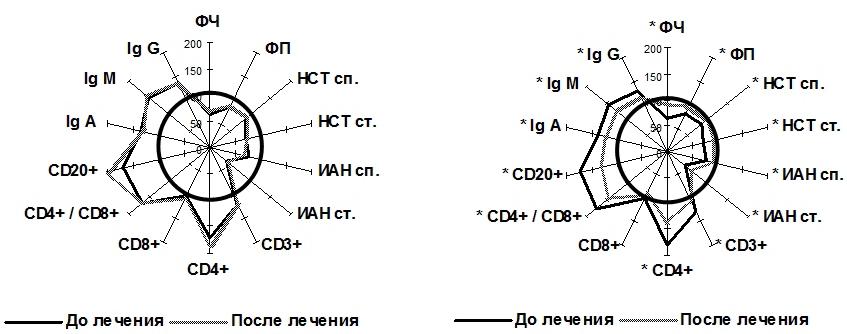
Рис. 1. Динамика показателей клеточного, гуморального звеньев иммунитета и функциональной активности нейтрофилов периферической крови у детей с давностью сахарного диабета I типа до двух лет в зависимости от вида терапии: радиус окружности - контрольные показатели ( традиционная терапия - слева, традиционная терапия + «Берлитион» - справа); * обозначает достоверность различий показателей до и после лечения (p<0,05).
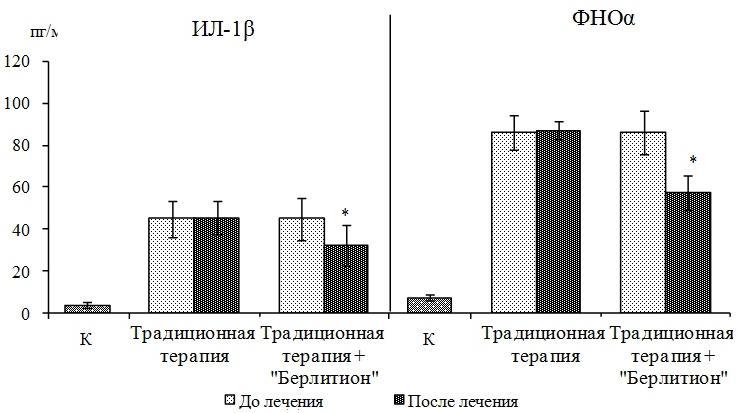
Рис. 2. Динамика уровня провоспалительных цитокинов у детей с давностью сахарного диабета I типа до двух лет в зависимости от вида терапии (М±σ): К – контрольная группа; * обозначает достоверность различий величин до и после лечения (p<0,05).
Кроме того, у пациентов с малым стажем заболевания терапия «Берлитионом» приводила к достоверному увеличению ФЧ, ФП, спонтанного и стимулированного НСТ-теста и ИАН (p<0,05), однако нормализации всех показателей достичь не удалось (рис. 1).
Показано, что применение препарата α-липоевой кислоты приводило к коррекции уровня цитокинов в данной подгруппе – снижению ИЛ-1β в 1,4 раза, ФНОα – в 1,5 раза (рис. 2) и повышению ИЛ-4 и ИЛ-10 – в 1,6 раза и 1,4 раза соответственно по сравнению с исходными значениями (p<0,05). Однако нормализации показателей цитокинового статуса не отмечалось (рис. 2).
У детей с более длительным СД I типа включение «Берлитиона» в терапию приводило лишь к частичной коррекции измененных показателей. При стаже заболевания более пяти лет препарат не влиял на изучаемые параметры иммунитета.
Таким образом, применение «Берлитиона» у детей с давностью СД I типа до пяти лет корригирует показатели функциональной активности нейтрофилов периферической крови (ФЧ, ФП, спонтанный и стимулированный НСТ-тест и ИАН), содержание CD3+, CD4+, CD20+ лимфоцитов, IgА, IgМ, IgG, ИЛ-1β, ФНОα, ИЛ-4, ИЛ-10, при этом максимальной степени иммунокоррекции удается достичь у пациентов с давностью заболевания до двух лет. У детей с длительностью диабета более пяти лет препарат не оказывает влияния на измененные показатели иммунного статуса. Коррекция иммунологических расстройств препаратом «Берлитион» в составе комплексной терапии СД I типа у детей, возможно, повысит эффективность традиционного лечения.
