Введение. Последние десятилетия характеризуются стремительным ростом распространенности гастроэнтерологических заболеваний в детском возрасте [1, 2]. В настоящее время отмечается интенсивное «омоложение» данной патологии, начало ее формирования в первые годы жизни ребенка, когда преимущественно определяются функциональные и/или дисбиотические расстройства желудочно-кишечного тракта (ЖКТ), формирование хронической патологии органов пищеварения уже в дошкольном возрасте [1,3]. Характер формирующейся в младшем возрасте гастродуоденальной патологии во многом отражает возрастные особенности органов пищеварения и иммунитета у детей первых семи лет жизни: морфофункциональная незрелость, несовершенство местной специфической и неспецифической защиты, незавершенность развития клеточного, гуморального иммунитета и регулирующих их механизмов, что способствует поступлению в организм чужеродных белков [4, 5, 6, 19]. В настоящее время доказано, что аллергический фактор занимает основное место в генезе заболеваний органов пищеварения у детей, особенно первых семи лет жизни [7, 8]. Поскольку, развитие гастроэнтерологических заболеваний на фоне пищевой аллергии (ПА) обусловлено влиянием иммунной системы, актуальным является исследование взаимосвязей между иммунологическими нарушениями и особенностями течения гастроэнтерологической патологии на фоне пищевой аллергии у детей, с учетом функциональных возможностей иммунитета растущего организма, на этапах его становления.
Цель исследования: изучить клинико-иммунологические особенности заболеваний ЖКТ на фоне ПА у детей первых семи лет жизни.
Материалы и методы. В клинике в ФГБУ «Нижегородский научно-исследовательский институт детской гастроэнтерологии» Минздрава России обследованы 137 детей в возрасте от 2 месяцев до 7 лет: 66 мальчиков (48%) и 71 девочка (52%) с заболеваниями ЖКТ на фоне ПА.
Всем детям проведено стандартизованное обследование гастроэнтерологического больного. Диагноз хронического гастрита, дуоденита и гастродуоденита (ХГД) ставился в соответствии с рабочей классификацией хронического гастрита, дуоденита и гастродуоденита у детей, сопутствующей патологии – в соответствии с МКБ 10 [9, 10]. Для постановки диагноза атопического дерматита (АД) применялась рабочая классификация, разработанная в рамках научно-практической программы «Атопический дерматит у детей: диагностика, лечение и профилактика» [11]. Диагноз ПА основывался на данных аллергологического анамнеза, диетического анализа с оценкой результатов ведения пищевого дневника, проведении элиминационной диеты, провокационных тестов, данных лабораторного исследования [12].
Состояние клеточного иммунитета (CD4+, CD8+, CD16+CD56+, CD19+) оценивали методом проточной цитометрии на Cytomics FS (Becton Diskenson) с панелью моноклональных антител CD3+/CD4+/CD8+ /CD16+CD56+/CD19+. С целью оценки состояния гуморального иммунитета в сыворотке крови исследовали основные классы иммуноглобулинов - общего IgE методом трехфазного иммунноферментного анализа с применением тест-систем Labodia–Xema (фирма «Хема», Россия – Швейцария), IgA, IgM, IgG - методом радиальной иммунодиффузии в геле по Manchini с использованием стандартных наборов сывороток диагностических моноспецифических (производство ФГУП “НПО Микроген” МЗ РФ, Нижний Новгород).
Результаты иммунологических параметров сравнивали с нормативными показателями, разработанными сотрудниками ФГУ “ННИИ ДГ Росмедтехнологии” [13].
Согласно возрастной периодизации все обследованные дети были разделены на 3 группы [14]: I группа (грудной возраст) – 32 ребенка от 2-х месяцев до 1 года; II группа (ранний возраст) - 41 пациент в возрасте с 1 года до 3 лет; III группа (дошкольный возраст) - 64 пациента с 4 до 7 лет.
Статистическая обработка полученных результатов. Для оценки клинико-лабораторных показателей применяли современные методы статистического анализа, интегрированные в ряде прикладных программ – «Statistiсa 6.0», for Windows ХР, Excel for Windows ХР. Анализ полученных данных включал расчет коэффициентов корреляции Спирмена (R), гамма (γ). Статистически достоверными различия в сравниваемых группах считались при р<0,05 [15].
Результаты и их обсуждение. При исследовании анамнеза определено, что у большинства обследованных первые проявления ПА возникали на первом году жизни – у 100 % детей I группы, у 97% (40 из 41) раннего и у 84% (54 из 64) детей дошкольного возраста. Её ранние признаки проявлялись гастроинтестинальными расстройствами после приема непереносимого продукта: синдромом срыгивания более чем у половины больных наблюдаемых групп; кишечными коликами чаще у детей II и III групп - у 44 % (18 из 41) и 55% (35 из 64) (р=0,004), синдромом диареи более чем у половины обследованных всех трех групп (69%, 59%, 55% соответственно), реже синдромом запоров - у каждого четвертого ребенка в наблюдаемых группах (25%, 27%, 27% соответственно). Кожные проявления пищевой аллергии на 1 году жизни в виде сухости, аллергических папулезных высыпаний и локальной гиперемией кожи (преимущественно щек), стойкими явлениями опрелостей в естественных складках кожи отмечались у большинства пациентов трех групп – 78% (25 из 32), 73% (30 из 41) и 66% (42 из 64), соответственно. Cочетание кожных и гастроинтестинальных проявлений пищевой аллергии, на первом году жизни, имели более половины пациентов - 72% (23 из 32), 61% (25 из 41), 58% (37 из 64) соответственно.
При анализе гастроэнтерологической патологии установлено, что синдром диареи достоверно чаще отмечался у детей I группы – 69% (22 из 32) (р=0,03, р=0,00001), во II группе одинаково часто регистрировался синдром диареи и запоров – 34% (14 из 41) и 34% (13 из 32), соответственно, в III группе увеличивалась частота синдрома запоров – 52% (33 из 64) (р=0,006). В отличие от пациентов I и II групп у 77% (49 из 64) детей III группы диагностирован ХГД в периоде обострения у 76% (37 из 49) и неполной клиникой ремиссии у 24% (12 из 49).
Наиболее частым кожным проявлением ПА был АД – у 72% (23 из 32), 68% (28 из 41) и 80% (51 из 64) больных I, II, III соответственно. АД в периоде обострения отмечался у большинства наблюдаемых детей первого года жизни – у 83% (19 из 23), при этом среднетяжелое и тяжелое течение АД отмечалось значительно чаще, чем легкое – 44% (10 из 23) (р=0,003) и 52% (12 из 23) (р=0,001) соответственно. У больных II группы АД встречался в 68% случаев (28 из 41), среднетяжелое и тяжелое течение АД, также как и у пациентов I группы, отмечалось достоверно чаще, чем легкое – 46% (13 из 28) (р=0,005) и 43% (12 из 28) (р=0,001). В дошкольном возрасте АД диагностирован у большинства наблюдаемых - 80% (51 из 64), однако, легкая степень тяжести по SCORAD регистрировалась достоверно чаще, чем у детей первого года жизни (р=0,04).
При сравнительном анализе субпопуляционного состава лимфоцитов в периферической крови у детей разного возраста с заболеваниями ЖКТ на фоне ПА выявлены следующие возрастные особенности. У большинства детей I группы чаще, чем во II и III группах, отмечалось нормальное относительное количество клеток с фенотипическими маркерами CD4+ (р=0,03; р=0,003, соответственно), CD8+ (р=0,005; р=0,02), CD16+CD56+(р=0,04) и CD19+ (р=0,0002; р=0,00001) (рис.1). Сочетание нормальных значений всех изучаемых показателей клеточного звена иммунитета наблюдалось у 22% (7 из 32) пациентов в возрасте до 6 месяцев, для них была характерна манифестация АД в первые три месяца жизни, с тяжелым течением, выраженными гастроинтестинальными проявлениями ПА, в виде диареи с синдромом крови в стуле. Полученные результаты, можно объяснить тем, что клеточный иммунитет у детей грудного возраста сформирован достаточно, имеет высокий процент Т-клеток, но функциональная активность этих клеток становится достаточной лишь к году, Т-клетки имеют незрелый фенотип [16]. Это объясняет дисбаланс между нормальным количеством Т-лимфоцитов и тяжелыми клиническими проявлениями ПА у данного контингента больных. Полученные данные подтверждены, результатами корреляционного анализа. Так у детей грудного возраста нормальное количество CD16+CD56+ было взаимосвязано с ранней манифестацией ПА с гастроинтестинальными нарушениями, протекающими с синдромом крови в стуле (R=0,7; р=0,001). Тяжелое непрерывно-рецидивирующие течение АД коррелировало со сниженным относительным содержанием СD8+ (γ=0,7, р=0,01), на фоне нормального уровня CD16+CD56+ (γ=0,7, р=0,002). Установлено, что сниженное количество NK было взаимосвязано с повышенным содержанием CD4+ (R=0,5, р=0,02), что косвенно могло свидетельствовать о смещении иммунного ответа в сторону Т-хелперов 2-го типа [17].
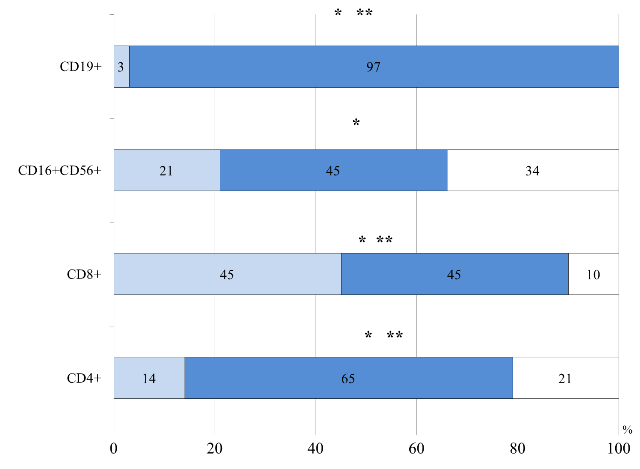
Рис. 1. Распределение больных I группы по содержанию относительного числа лимфоцитов крови: здесь и далее ![]() - количество больных с показателем, соответствующим норме,
- количество больных с показателем, соответствующим норме, ![]() - количество больных с показателем, превышающим норму,
- количество больных с показателем, превышающим норму, ![]() - количество больных с показателем ниже нормы. *- достоверность различий между I и II группами, **- достоверность различий между I и III группами
- количество больных с показателем ниже нормы. *- достоверность различий между I и II группами, **- достоверность различий между I и III группами
Для детей II и III групп, напротив, была характерна большая частота выявления повышенного относительного числа CD4+ (р=0,007), (р=0,003) и сниженного содержания CD8+ (р=0,005), (р=0,0007), соответственно. При анализе количества CD16+CD56+ и CD19+ у детей II и III групп также выявлены однонаправленные изменения - у детей данных групп значительно чаще, чем в I группе, отмечалось превышение нормальных значений NK-клеток (р=0,007), (р=0,04) и снижение CD19+ (р=0,0002), (р=0,0001), соответственно (рис. 2).
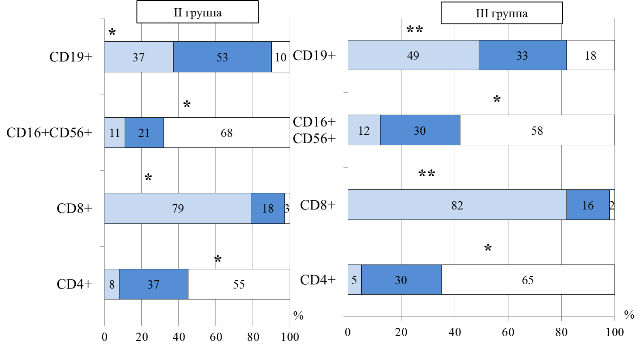
Рис. 2. Распределение больных II и III групп по содержанию относительного числа лимфоцитов крови: *- достоверность различий между I и II группами, **- достоверность различий между I и III группами
Таким образом, у детей старше года отмечалось статистически значимое увеличение количества CD16+CD56+, возможно, за счет нарастания антигенной стимуляции и отражает компенсаторный процесс, направленный на противостояние реализации аллергии [19]. Снижение количества CD19+, вероятно связано с избыточной трансформацией в плазматические клетки, синтезирующие IgE [16, 17].
Установлено, что только у пациентов II группы повышенное количество CD4+ было связано с гастроинтестинальными проявлениями пищевой аллергии (R=0,4, р=0,005). Тяжелое течение АД коррелировало со сниженным содержанием СD8+(γ=0,6, р=0,03), так же как и у пациентов I группы, на фоне повышенного количества NK-клеток (R=0,4, р=0,02), что подтверждает компенсаторное участие данных клеток, направленное на противостояние реализации аллергии.
В III группе, напротив, снижение относительного количества CD8+ было взаимосвязано с более легким течением (R=0,3, р=0,02) и ремиссией АД (γ=0,6, р=0,006). Однако, в этой группе повышенное количество CD4+ снижение числа CD8-лимфоцитов были взаимосвязаны с обострением хронического дуоденита/гастродуоденита (R=0,5, р=0,03; γ=1,0, р=0,01). Данные взаимосвязи объясняют изменения «шокового» органа» в дошкольном возрасте, которым является ЖКТ [3, 7, 8, 20]. В III группе, также как и во II, повышенное содержание CD16+CD56+ было взаимосвязано с низким относительным количеством CD4+ (R=0,3, р=0,04), что возможно также отражает одну из определяющих ролей этих клеток в регуляции Th1/Th2-ответа, с преимущественным участием клеточных механизмов у детей старших возрастных групп. Установлено, что только у детей III группы сниженное количество CD19+лимфоцитов было связано с тяжелым течением (по SCORAD) (R=0,5, р=0,02) и периодом обострения АД (γ=0,3, р=0,0004), это вероятно обусловлено избыточной трансформацией в плазматические клетки, синтезирующие IgE, особенно при тяжелых формах АД, что так же было подтверждено результатами исследования гуморального иммунитета у обследованных детей.
В результате сравнительного анализа содержания иммуноглобулинов E, A, M, G в крови выявлены различия, характерные для детей разных возрастных периодов. Так, в I группе уровень IgE общего был повышен у половины детей, что характерно для детей с атопией; сниженный IgА свидетельствовал о незрелости иммунитета и отражал снижение местной защиты [4, 5, 16]; уровень IgМ был повышен у большинства пациентов, а IgG у каждого третьего, что значительно чаще чем детей II группы (р=0,002, р=0,0002) (рис. 3).
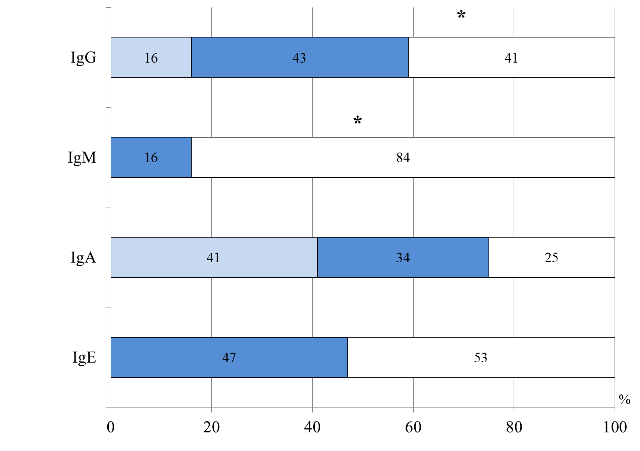
Рис. 3. Распределение больных I группы по уровню иммуноглобулинов в сыворотке крови: *- достоверность различий между I и II группами
Повышенный уровень IgM у детей I группы, очевидно, связан с тем, что в этом возрасте первичный иммунный ответ на проникновение многих антигенов, в том числе и пищевых, развивается за счет синтеза IgM, при этом, не оставляя иммунологической памяти [5, 16, 17]. Повышенный уровень IgG у детей грудного возраста, возможно, обусловлен транспортом материнских иммуноглобулинов, так и с повышенной антигенной нагрузкой [5, 8]. В результате корреляционного анализа выявлена взаимосвязь раннего дебюта ПА (на первых месяцах жизни) с повышенным уровнем IgM, IgG (R=0,4, р=0,002; R=0,47, р=0,007), с низкой концентрацией IgА (R=0,72; р=0,000005). Установлено, что гастроинтестинальные проявления аллергии, в виде синдрома диареи, ассоциированы с повышенным уровнем IgE общего (γ=0,6, р=0,04) и сниженным уровнем IgA в сыворотке крови (γ=0,7, р=0,004).
Тяжелое течение АД (по объективному показателю SCORAD) коррелировало с высоким уровнем IgE общего (γ=0,6, р=0,008), что подтверждает атопический генез заболевания. Во II группе изменения со стороны гуморального иммунитета, так же как и у детей грудного возраста, чаще характеризовались повышенным уровнем IgE общего и сниженным IgА, но нормальным уровнем IgM (р=0,0002) и IgG (р=0,001) (рис. 4).
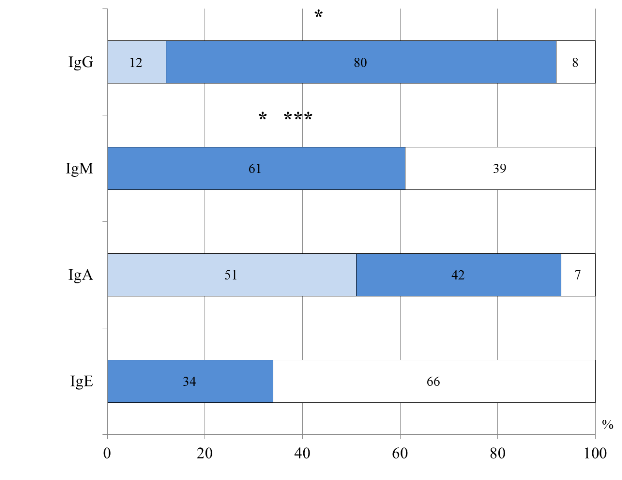
Рис. 4. Распределение больных II группы по уровню иммуноглобулинов в сыворотке крови: *- достоверность различий между I и II группами, ***- достоверность различий между I и III группами
Нормальный уровень IgG в сочетании с неизменным IgM, может свидетельствовать в пользу формирования адаптивного иммунитета и созревании способности переключения изотипов иммуноглобулинов с IgM на IgG, что характерно для детей этого возраста [5,16].
Методом корреляционного анализа установлена взаимосвязь между ранним дебютом ПА повышенным уровнем IgM (R=0,4, р=0,003) и сниженным IgA (R=0,4, р=0,001). Тяжелое течение АД (по объективному показателю SCORAD) коррелировало с высоким уровнем IgE общего (γ=0,5, р=0,04), что подтверждало аллергический генез и было однонаправленно с полученными данными в I группе. Только у детей II группы в результате корреляционного анализа выявлено, что повышенный уровень общего IgЕ был взаимосвязан с повышением количества CD16+CD56+ (R=0,4, р=0,009), что, возможно, отражает участие различных субпопуляций лимфоцитов в регуляции уровня IgE у детей 2-3 лет жизни [18, 21, 22].
О преобладании Th2-ответа в данной группе свидетельствовали выявленные корреляции: между повышенным содержанием IgA, IgM и увеличенным количеством CD4-лимфоцитов (R=0,3, р=0,004; R=0,4, р=0,008, соответственно). У детей III группы изменения со стороны гуморального иммунитета чаще проявлялись – повышенным уровнем IgE, сниженным IgА, как у детей первых двух групп. Повышенный IgM отмечался у большинства пациентов, IgG у каждого четвертого ребенка (рис. 5).
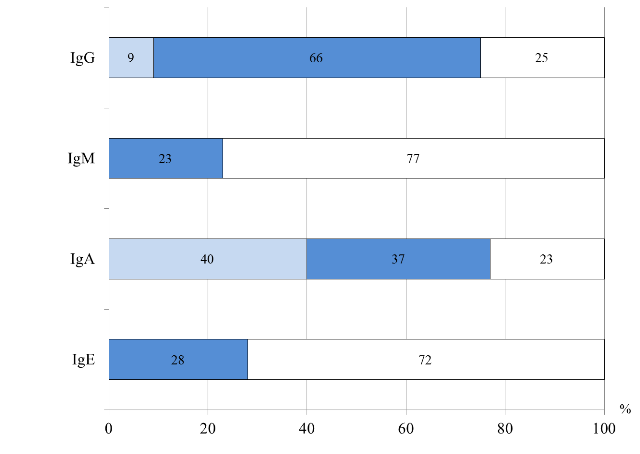
Рис. 5. Распределение больных III группы по уровню иммуноглобулинов в сыворотке крови
Методом корреляционного анализа установлено, что длительное течение ПА (более 3 лет) у наблюдаемых детей было взаимосвязано с низкой концентрацией IgА в сыворотке крови (R=0,5, р=0,000003). Выявлено, что у детей III группы гастроинтестинальные проявления аллергии, в виде синдрома запоров, были ассоциированы с повышенным уровнем IgE общего (γ=0,5, р=0,01). Отмечено, что тяжелое течение АД у детей данной группы, так же как I и II группах, было сопряжено с высоким уровнем IgE общего (γ=0,5; р=0,003).
При анализе взаимосвязей показателей гуморального иммунитета с особенностями течения хронического дуоденита/гастродуоденита у пациентов III группы, установлено, что в период обострения чаще отмечались низкий уровень IgA и повышенный IgM (γ=0,5; р=0,02 и γ=0,6; р=0,001, соответственно). Выявлено, что у детей дошкольного возраста тяжелое течение ХГД было взаимосвязано с повышенным уровнем IgE общего и IgM (γ=0,5, р=0,04; γ=1,0, р=0,02, соответственно) и с низким IgA (R=0,6; р=0,004). Установлено, что у детей дошкольного возраста активация иммуноглобулинов IgA, IgM, IgG коррелировала с низким уровнем CD16+CD56+ (γ=0,4, р=0,01; γ=0,3, р=0, 03 и γ=0,6, р=0,002, соответственно), что могло подтверждать преобладание Th2-ответа, с последующей гуморальной реакцией – повышенной секрецией специфических иммуноглобулинов.
Выводы. Таким образом, для детей первых семи лет жизни с ПА характерны: дебют на первом году жизни, сочетание гастроинтестинальных и кожных форм ПА и/или АД, с возрастом уменьшение синдрома диареи и увеличение частоты синдрома запоров, в дошкольном возрасте у 2/3 детей диагностирован ХГД. У обследованных детей изменения в клеточном и гуморальном звеньях иммунитета опосредуют преобладание Тh2-ответа и обуславливают ранний дебют, тяжелое течение гастроэнтерологических и аллергических заболеваний.
Особенностью иммунных нарушений у детей первого года жизни является несостоятельность функциональных возможностей клеточного звена иммунитета, что объясняет дисбаланс между нормальным количеством Т-лимфоцитов и тяжелыми клиническими проявлениями ПА у данного контингента больных.
