Повышенный интерес к проблеме развития и прогрессирования метаболического синдрома (МС) объясняется не столько высокой частотой встречаемости инсулинорезистентности и компенсаторной гиперинсулинемии, нарушения толерантности к глюкозе или сахарного диабета 2 типа, сколько наличием других, взаимосвязанных между собой метаболических и эндокринных нарушений, возникающих при этой патологии и определяющих высокий уровень летальности [1,10].
Большинство ученых всего мира сходятся во мнении, что в основе развития МС лежит формирование инсулинорезистентности (ИР) с последующим развитием компенсаторной гиперинсулинемии (ГИ). Механизмы формирования ИР довольно сложны и на сегодняшний день нет единого мнения о причинах ее развития. Скорее всего, ИР – это полиэтиологическое состояние, в основе которого лежат множественные генетические изменения в эндокринной и других системах, реализующиеся под действием факторов внешней среды [3,6]. Большая часть исследований посвящена ограниченному набору генов, которые кодируют белки, регулирующие тонус сосудов, функцию эндотелия, минеральный обмен, метаболизм и транспорт липидов в сосудистом русле. Относительно недавно стал изучаться вопрос об участии генов цитокинового каскада в развитии компонентов МС [2].
Цитокины являются ключевыми медиаторами межклеточных взаимодействий, в том числе в процессе воспаления. На сегодняшний день установлен ряд цитокинов паракринного и эндокринного действия, участвующих в формировании и развитии составляющих МС. Фактор некроза опухоли альфа (TNF-α) изучен как гуморальный агент вторичной альтерации, цитокин–регулятор преиммунного и иммуннного ответов, эндогенный пироген, индуктор апоптоза и некробиоза. Этот цитокин тормозит тирозин-протеинкиназную активность рецептора инсулина и экспрессию глюкозного переносчика GLUT-4 в мышцах и липоцита [5].
Одно из крупнейших исследований, посвященных связи TNF-α с компонентами метаболического синдрома, было проведено в 2002 Skoog et al [8]. Было установлено, что уровень TNF-α в плазме крови связан с систолическим и диастолическим АД, уровнем ТГ и холестерина липопротеидов низкой плотности (ХС ЛПНП), объемом талии (ОТ), а также со степенью выраженности инсулинорезистентности [4].
Ранее проведенные исследования показали, что повышенная продукция TNF-α ассоциирована с полиморфизмом G-308A гена. В промоторной области гена TNF-α определяются несколько полиморфизмов: замена гуанина на аденин в нуклиотидных позициях -308 (G-308A), -238 (G-238A), - 863 (G-863A). Повышение продукции TNF-α связано с наличием G-308A полиморфизма, который является активатором транскрипции с 6-7 кратным повышением уровня TNF-α [11].
Многолетние наблюдения, подкрепленные данными многоцентровных международных исследований, позволяют рассматривать полиморфизм гена TNF-α как один из основных объединяющих факторов, лежащих в основе развития и прогрессирования основных компонентов метаболического синдрома [7,9,10].
Целью данного исследования явилась оценка 5-летней вероятности развития компонентов метаболического синдрома у пациентов с различными аллелями гена TNF-α.
Материал и методы исследования. На этапе включения в исследование в 2001-2002 г. было обследовано 92 практически здоровых пациента (50 женщины и 42 мужчины) в возрасте 35-55 лет, обратившиеся в поликлинику ОАО «Медицина» для проведения диспансеризации.
Все пациенты прошли обследование включающее:
-анкетирование с целью сбора данных анамнеза и выявления факторов риска развития сердечно-сосудистых заболеваний с использованием стандартных опросников;
-измерение АД дважды на обеих руках, ЭКГ, индекса массы тела (ИМТ), объема талии (ОТ), объема бедер (ОБ). Диагноз артериальной гипертезнзии устанавливался с учетом рекомендаций по профилактике, диагностике и лечению артериальной гипертонии (2008);
-проведение перорального глюкозотолерантного теста с определением уровня глюкозы и иммунореактивного инсулина натощак и через 2 часа после нагрузки 75г глюкозы;
-анализ структуры гена TNF-α методом полимеразной цепной реакции (ПЦР) из материала лейкоцитов периферической крови.
Статистическую обработку данных проводили с использованием стандартного пакета статистических программ SPSS версии 11.0. Количественные показатели описывали в терминах среднего значения и стандартной ошибки среднего (M±m), достоверность различий между группами оценивали по t-критерию Стьюдента. Различия между качественными и категориальными показателями оценивали методом χ2. Результаты признавали значимыми при уровне вероятности P≤0,05. С помощью метода Каплана-Мейера был проведен анализ развития атеросклероза у пациентов в зависимости от пола и генотипа TNF-α. Для количественной оценки риска развития атеросклероза построена регрессионная однофакторная модель Кокса, проверка коэффициентов уравнения регрессии проводилась с использованием лог-ранк теста. Результаты представлены в виде относительного риска с 95% доверительным интервалом.
Результаты исследования. Гомозиготами по аллелю G (генотип GG) являлись 63% пациентов (N=58), гетерозиготами (генотип GA) – 34,8% пациентов (N=32), гомозиготами по аллелю А (генотип АА) - 2,2% (2 пациента). Распределение генотипов соответствовало равновесию Харди-Вайнберга. Проводили сравнение двух групп пациентов с генотипами GG и GA+АА в зависимости от пола.
При включении в исследование изучаемые группы были сопоставимы по возрасту, индексу массы тела, анамнезу курения, уровню физической активности. В группе GG было 28 мужчин (48,3%) и 30 женщин (51,7%), а в группе GA - 14 мужчин (41,2%), 20 женщин (58,8%). Средний возраст мужчин составил 41,6±1,8 и 44,5±3,2 лет соответственно (Р=0,40), средний возраст женщин – 40,9±2,0 и 44,2±1,8 лет (Р=0,08). Индекс массы тела в среднем достоверно не различался и не превышал 27 кг/м2 и составил в среднем 26,1±0,59 и 26,4±0,90 кг/м2 (Р=0,77) в группе мужчин и 24,5±0,90 и 25,9±1,13 кг/м2 (Р=0,32) у женщин.
Объем талии в изучаемых группах также не различался: в группе мужчин гомозиготных по аллелю G этот показатель определялся на уровне 90,8±1,54 против 92,9±2,09 см в случае носительства аллеля А (р=0,44). У женщин объем талии в группе GG составлял 76,5±2,36 см, в то время как у гетерозиготных пациенток по аллелю A наблюдалась тенденция к превышению уровней, рекомендованных EGIR, достигая 83,0±2,70 (р=0,08).
При оценке данных анамнеза и уровня АД на момент включения в исследования данных за превышение нормативных показателей, прием лекарственных препаратов получено не было.
Через пять лет наблюдения ИМТ вырос на 3,8% у мужчин с генотипом GG и на 7,6% при генотипах GА+AA (Рис. 1). В среднем не отмечено достоверных различий между изучаемыми группами по этому показателю, который составлял у мужчин 27,1±0,60 и 28,4±1,20 кг/м2 (р=0,25) соответственно. За 5-летний период наблюдения во всех группах также наблюдалось увеличение показателя ОТ на 4,5% у пациентов с генотипом GG и на 10,1% - при генотипах GA+AA. В группе мужчин гомозиготных по аллелю G этот показатель определялся на уровне 94,9±1,9 против 102,2±3,0 см в случае носительства аллеля А (р=0,44).
Анализ динамики АД выявил ухудшение показателей САД в процентах по отношению к исходному уровню у носителей аллеля А мужского пола на 17,0% и 10,5% с генотипом GG соответственно, определяясь на уровне 137,9±4,3 мм рт.ст. против 131,7±2,6 мм рт.ст. В изучаемой группе пациентов достоверных изменений ДАД не наблюдалось. Среди носителей аллеля А в группе мужчин средний уровень ДАД вырос на 12,5% против 8,4 % у пациентов с генотипом GG и составил 86,80±2,70 и 84,20±1,5 мм рт.ст. соответственно.
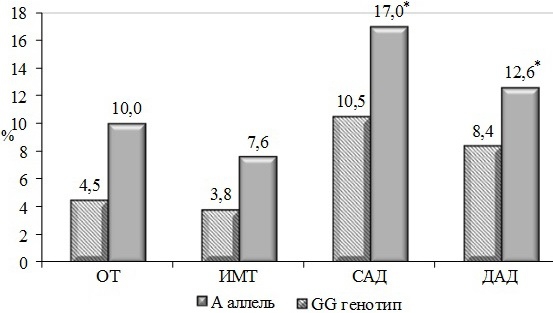
Рис. 1. Динамика клинических показателей через 5 лет у мужчин с различными генотипами по гену ТNF-α: *-статистически достоверные различия между группами (P<0,05)
У женщин ОТ в группе GG вырос на 8,9% и составил 83,3±2,80 см, в то время как у пациенток-носителей аллеля A наблюдалась менее выраженная динамика изменения показателя (на 3,0%). Однако в группе GA+AA отмечена тенденция к превышению уровней ОТ, рекомендованных EGIR, достигая 85,50±3,40 (р=0,08).
В исследуемой группе пациентов не было получено достоверных различий в динамике ИМТ и АД. Обращает на себя внимание то, что у женщин с аллелем G отмечалось повышение уровня САД относительно исходных значений, чем у гомозиготных по генотипом GА+АА. Отмечался рост данного показателя на 10,5% и 6,4% соответственно, оставаясь в пределах нормы. Средние значения ДАД достоверно не различались между группами и не превышали нормальных значений.
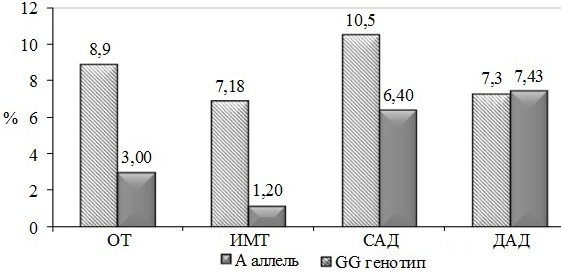
Рис. 2. Динамика клинических показателей через 5 лет у женщин с различными генотипами по гену ТNF-α
За 5-ти летний период наблюдения у части пациентов изучаемых групп выявлена АГ, требующая гипотензивной терапии (рис. 3). Однако в группе носителей аллеля А мужского пола доля пациентов, получающих лекарственную терапию, была в 2 раза выше, чем у пациентов с генотипом GG, составляя 71,4 против 35,7% (Р<0,001).
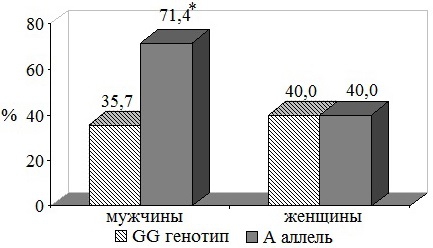
Рис. 3. Развитие артериальной гипертензии, требующей гипотензивной терапии, за 5-ти летний период наблюдения: *- достоверные различия между группами, P<0,05
Учитывая тот факт, что в прогрессировании метаболического синдрома решающее значение имеет совокупность определяющих его компонентов, нами была проанализирована частота совместной встречаемости повышения ИМТ, увеличения ОТ и развития АГ, требующей медикаментозной коррекции. Полученные результаты указывают, что среди женщин данное сочетание в наибольшей степени встречается в группе с генотипом GA+AA (20% случаев). При этом у гомозиготных по аллелю G женщин в нашей исследовании не наблюдалось совместной встречаемости описанных факторов.
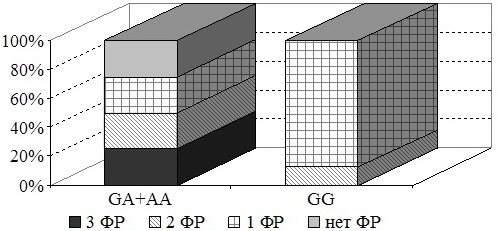
Рис. 4. Сочетание факторов риска в у женщин с различными генотипами по гену ТНФ-α
Несколько иная картина наблюдается у мужчин. При наличии генотипа GA+AA у всех пациентов наблюдается сочетание факторов риска. В группе гомозиготных по аллелю G мужчин совместная встречаемость трех компонентов наблюдается лишь в 8% случаев, а у наибольшего количества пациентов определяется 1 фактор риска.
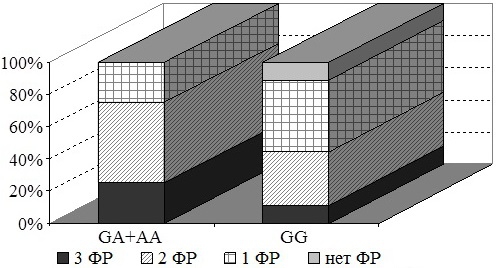
Рис. 5. Сочетание факторов риска у мужчин с различными генотипами по гену ТНФ-α
Обсуждение результатов и заключение. Анализ современных литературных данных указывает на участие гена TNF-α в формирование компонентов метаболического синдрома. В нашем исследовании через пять наблюдения у мужчин наблюдалось увеличение ИМТ, ОТ и уровней АД, при этом достоверное увеличение ОТ и уровня САД наблюдалось только в группе с генотипом GA+AA.
Среди женщин с аллелем А по сравнению с гомозитотами по аллелю G увеличение ОТ носит менее выраженный характер. Однако превышение рекомендованных EGIR значений ОТ, наблюдается именно в группе пациенток с генотипом GA+AA. При исследовании динамики уровня АД выявлено, что у женщин отмечен рост САД от исходного уровня на 10,5 и 6,4 при генотипах GG и GA+AA соответственно.
При включении в исследование пациентами отрицался факт приема лекарственных препаратов. Через пять отмечено, что среди мужчин носителей аллеля А доля пациентов, принимающих лекарственную терапию была в 2 раза выше, чем при генотипе GG.
Особенного внимания заслуживает совокупность встречаемости компонентов МС. Полученные результаты указывают, что в группе пациентов с генотипом GA+AA без зависимости от пола отмечается сочетание факторов риска, что не может не оказывать влияние на дальнейшее прогрессирование метаболического синдрома.
Таким образом, полученные в результате работы результаты показывают, что при наличии генотипа GA+AA отмечаются более выраженные изменения антропометрических показателей и уровня АД. В этом же случае наблюдается сочетание описанных компонентов, что подтверждает роль аллеля А в формировании и прогрессирование компонентов метаболического синдрома.
