Знания о естественном течении хронического гепатита С (ХГС) позволяют выделить среди больных группу риска с быстрым прогрессированием заболевания. Решать вопрос о необходимости противовирусной терапии следует, учитывая предикторы прогрессирования ХГС в цирроз печени и гепатоцеллюлярную карциному (ГЦК). Процесс развития заболевания от момента инфицирования до исхода болезни может занимать несколько десятилетий [10]. Причем, в случае ХГС необходимо отказаться от представления о линейном нарастании фиброза печени: прогрессирование заболевания может ускоряться со временем [17, 24].
Все факторы, влияющие на естественное течение ХГС, можно разделить на 3 группы:
1. Особенности организма хозяина: сюда традиционно относят пол, возраст, расу, наличие ряда сопутствующих заболеваний (в том числе инфицированность ВИЧ и HBV), а также иммунологические особенности (в том числе антигены главного комплекса гистосовместимости – HLA II).
2. Вирусологические факторы: разными авторами рассматривалось значение генотипа вируса, вирусной нагрузки и квазивидов вируса.
3. Влияние окружающей среды: такие факторы как курение, злоупотребление алкоголем, употребление наркотиков, наличие загрязнения среды обитания могут в той или иной мере ускорять развитие цирроза печени и ГЦК.
Учитывая и по возможности корригируя эти факторы, можно отсрочить наступление исходов болезни.
Alter et al указывают на то, что прогрессирование заболевания происходит у меньшего числа больных, чем это принято считать. Большинство же из них умирают от причин, не связанных с HCV-инфекцией, прежде чем у них успевают развиться опасные для жизни осложнения заболевания [1]. Однако, учитывая широкую распространенность HCV-инфекции, даже при относительно низкой частоте развития тяжелой патологии печени она остается актуальной проблемой современной медицины. Поэтому прогрессирование ХГС с формированием цирроза печени остается одной из наиболее частых причин проведения трансплантации печени.
Целью настоящей работы явилась оценка прогностического значения ряда клинических и вирусологических факторов в отношении характера естественного течения ХГС.
Материалы и методы исследования. Для решения поставленных задач в исследование были включены 100 больных, наблюдавшихся в нижегородском гепатологическом центре по поводу ХГС и не получавших противовирусной терапии.
Диагноз «хронический гепатит С» устанавливался на основании анамнеза (в том числе тщательно выяснялась давность заболевания и наиболее вероятный путь инфицирования), клинических данных и сохранения специфических маркеров по данным иммуноферментного анализа (ИФА) и полимеразной цепной реакции в реальном времени (ПЦР) не менее 6 месяцев.
Возрастная и половая структура исследованной группы подробно представлена в табл. 1.
Таблица 1. Распределение больных ХГС по полу и возрасту
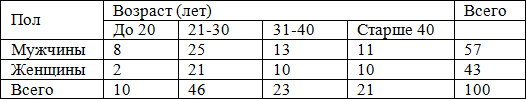
Сроки заболевания варьировали в широких пределах: от 1 года до 27 лет (в среднем 5,56 лет). Больные со стажем заболевания до 5 лет составили 68%, больные с продолжительностью инфекции более 5 лет – 30%. У 2% больных не удалось определить длительность заболевания.
На основании данных парентерального анамнеза определялась исходная доза инфекта. В группу больных с низкой исходной дозой инфекта были отнесены инфицированные при единичных медицинских манипуляциях (инъекции, операции, стоматологические или гинекологические манипуляции), половым путем или трансплацентарно. Группу больных с высокой исходной дозой инфекта составили пациенты, инфицированные при гемотрансфузиях или внутривенном введении наркотических веществ. В группу больных с высокой исходной дозой инфекта вошли 34% больных, в группу с низкой исходной дозой инфекта – 54% больных; у 13% больных определить путь инфицирования не удалось.
Репликативная активность вируса оценивалась по данным ИФА и ПЦР. Высокая репликативная активность (наличие a/HCVcor IgM и/или HCV РНК) установлена у 71% больных, низкая репликативная активность (отсутствие a/HCVcor IgM и HCV РНК) – у 29% больных.
Генотипирование HCV было проведено у 45% больных: у 20% больных был выявлен генотип 1b, у 24% больных – генотип 3а, у 1% больных генотипировать HCV не удалось (генотип не 1а, 1b, 2, 3а, 3b). Данное распределение генотипов вируса в целом характерно для нашего региона.
Для оценки иммунного ответа исследовались методом ИФА антитела к неструктурным белкам вируса: a/HCVns3 и a/HCVns5.
Оценка тяжести заболевания проводилась на основании наличия синдрома малой печеночной недостаточности (МПН), частоты повышения уровня АлАт и наличия структурных изменений печени по данным УЗИ и биопсии печени.
К синдрому МПН относились жалобы астенического характера и указывающие на патологию билиарной системы диспептические явления. Признаками структурных изменений по данным УЗИ служили повышение эхогенности и нарушение эхоструктуры печени. При анализе биоптатов печени в первую очередь оценивались наличие выраженного фиброза и величина индекса гистологической активности (ИГА).
Результаты и обсуждение. При анализе влияния пола больных на характер течения ХГС было выявлено, что МПН у мужчин регистрируется значительно чаще, чем у женщин: 91% и 60% соответственно (p < 0,001). Очень схожие результаты получены в отношении повышения АлАт. У мужчин повышенный уровень АлАт регистрировался в 91,3% образцов, у женщин – 62,1% (p < 0,001). Диффузное повышение эхогенности и изменение эхоструктуры печени по данным УЗИ выявлено у 96,4% мужчин и 71,9% женщин (р=0,002). При морфологическом исследовании биоптатов ИГА у мужчин оказался выше, чем у женщин (12,5 и 11,5 соответственно), а выраженный фиброз зарегистрирован у 90% женщин и 75% мужчин, однако последнее статистически недостоверно (р=0,633).
Полученные данные отчасти согласуются с данными иностранных авторов [2, 12, 17, 23]. Благоприятное течение болезни у женщин можно объяснить цитопротективным действием эстрогенов [5]. У мужчин, напротив, из-за наличия ряда неблагоприятных факторов (высокая частота привычных интоксикаций, ожирение, повышенный уровень сывороточного железа) ХГС протекает тяжелее [17].
Далее было проанализировано влияние возраста в момент инфицирования на характер течения ХГС. По данным авторов инфицирование в старшем возрасте приводит к более агрессивному течению заболевания [17, 18].
В ходе исследования нам не удалось установить связи возраста в момент инфицирования с частотой повышения уровня АлАт, частотой симптомов МПН и частотой выявления структурных изменений печени по данным УЗИ. Однако была выявлена четкая зависимость гистологических изменений печени от возраста в момент инфицирования, согласующаяся с данными иностранных авторов [6, 7, 8, 15, 17, 18].
Из рис. 1 видно, что с увеличением возраста в момент инфицирования частота выявления выраженного фиброза постепенно возрастает, достигая 100% при инфицировании в возрасте старше 30 лет.
На рис. 2 представлена зависимость ИГА от возраста в момент инфицирования. В рассмотренных возрастных группах значение ИГА постепенно увеличивается от 12,1 до 13,2, а при инфицировании в возрасте старше 40 лет резко снижается до 10. Снижение ИГА в последней группе происходит за счет воспалительного компонента, что отражает, по-видимому, сниженную активность иммунной системы.
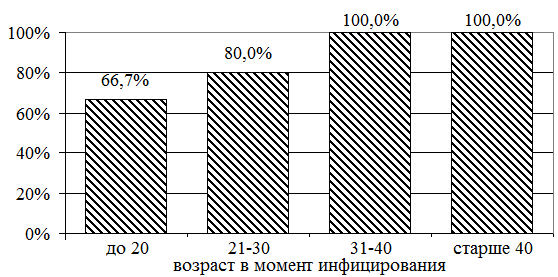
Рис. 1. Частота регистрации выраженного фиброза при инфицировании в разном возрасте
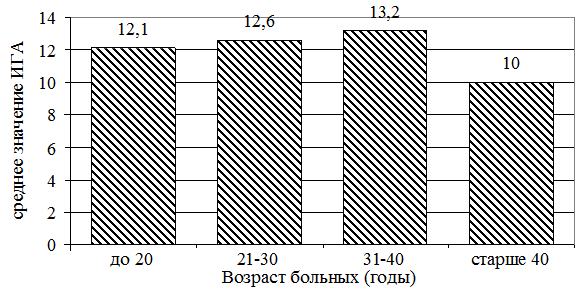
Рис. 2. Зависимость ИГА от возраста больных
Связь возраста в момент инфицирования с темпами прогрессирования фиброза и интенсивностью воспаления остается недостаточно изученной. Можно предположить, что она обусловлена возрастными изменениями иммунной системы [21].
Продолжительность заболевания, по нашим данным, слабо влияет на частоту симптомов МПН и морфологические изменения в печени по данным УЗИ и биопсии (табл. 2). Это согласуется с данными Thabut et al. [20]. В то же время было установлено, что при стаже заболевания до 5 лет частота подъема АлАт составляет 82%, а у больных с большей продолжительностью болезни – 71% (р=0,025). Различия в частоте подъема АлАт можно объяснить с позиций патогенеза заболевания. На ранних этапах болезни иммунный ответ является более напряженным, что проявляется повышенным цитолизом инфицированных гепатоцитов. С течением времени наблюдается постепенное истощение иммунной системы; интенсивность цитолиза снижается, ферментные обострения становятся все более редкими.
Таблица 2. Влияние продолжительности болезни на характеристики естественного течения ХГС
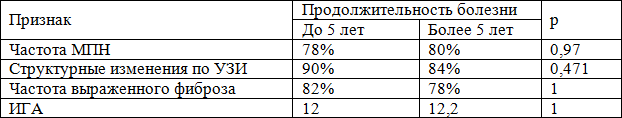
Исследуя особенности эпидемиологического анамнеза у больных ХГС, зарубежные авторы указывают на важное прогностическое значение пути инфицирования. При этом мнения относительно тяжести прогноза сильно варьируют. Так, при инфицировании в ходе гемотрансфузий (высокая инфицирующая доза) частота развития цирроза печени в течение 8 – 20 лет оценивается разными авторами в пределах 3,4 – 24% [4, 11, 13, 19, 22, 23]. Инфицирование при внутривенном употреблении наркотиков также ведет к быстрому прогрессированию заболевания [2], что, вероятно, связано с попаданием большой дозы инфекта в организм с заведомо ослабленной иммунной системой. Характер течения заболевания при инфицировании малыми дозами вируса в литературе освещен слабо.
По нашим данным, исходная доза инфекта оказывает выраженное влияние на характер течения ХГС. Симптомы МПН выявлялись у 91% больных, инфицированных высокой дозой вируса, и лишь у 70% больных с низкой исходной дозой инфекта (р=0,031). Различия в частоте подъема АлАт оказались еще более выраженными: 91,6% и 66,1% при большой и малой инфицирующей дозе соответственно (р<0,001). Частота выявления морфологических изменений в печени по данным УЗИ при большой и малой инфицирующей дозе также различалась: 97% и 81,8% соответственно (р=0,07). Средний ИГА у больных с высокой инфицирующей дозой составил 12, а у больных с низкой – 11,2. Лишь на частоту выявления выраженного фиброза исходная доза инфекта не оказывала существенного влияния: 80% и 77% при высокой и низкой инфицирующей дозе соответственно (р=1).
Хроническое употребление алкоголя можно считать одним из наиболее важных факторов, способствующих прогрессированию фиброза печени при ХГС [3, 9, 17]. Алкоголь не только оказывает прямое токсическое действие на печень, но также подавляет иммунитет, способствует прогрессированию стеатогепатоза, усиливает выработку провоспалительных и профибротических цитокинов, стимулирует перекисное окисление липидов.
Мы оценили влияние привычных интоксикаций (употребление наркотиков, злоупотребление алкоголем) на естественное течение ХГС. Наличие привычных интоксикаций увеличивало частоту выявления МПН с 43% до 93% (р< 0,001), а частоту подъема АлАт – с 58% до 87,5% (р<0,001). Морфологические изменения в печени по данным УЗИ выявлялись при наличии привычных интоксикаций у 97% больных, а при их отсутствии – у 63% больных (р<0,001). Данные УЗИ закономерно подтверждались результатами биопсии печени. Выраженный фиброз при наличии привычных интоксикаций выявлялся у 87% больных, при отсутствии – у 62,5% (р=0,161), а средний ИГА составил соответственно 12,5 и 10,8.
Изучение роли репликации вируса позволило установить отсутствие статистически достоверной связи между репликативной активностью HCV, частотой МПН и частотой подъема АлАт, выраженностью морфологических изменений в печени по данным УЗИ и биопсии (табл. 3).
Таблица 3. Влияние продолжительности болезни на характеристики естественного течения ХГС
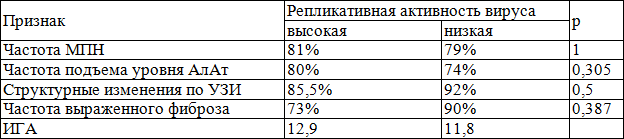
Поскольку HCV является слабым иммуногеном, то и его репликация, по-видимому, оказывает минимальное влияние на темпы прогрессирования фиброза и тяжесть течения заболевания.
Анализ роли генотипа HCV в естественном течении ХГС выявил связь генотипа вируса с частотой МПН и морфологическими изменениями в печени, но не с частотой подъема АлАт. МПН выявлена у 70% больных с генотипом 1b и у 88% больных, инфицированных HCV генотипа 3а (р=0,261). Известно, что генотип вируса оказывает определенное влияние на вирусную кинетику [16, 25], поэтому можно предположить, что особенности HCV разных генотипов опосредованно сказываются и на выраженности МПН.
Литературные данные о влиянии генотипов HCV на темпы прогрессирования фиброза противоречивы [2, 14]. В нашем исследовании мы наблюдали выраженный фиброз у 89% больных, инфицированных HCV генотипа 1b, и у 60% больных, инфицированных HCV генотипа 3а (р=0,303). Напротив, средний ИГА был значительно выше у больных, инфицированных HCV генотипа 3а, чем при инфицировании HCV генотипа 1b: 15 и 11,7 соответственно.
Заключительным этапом исследования был анализ влияния иммунного ответа на характер течения ХГС.
Мы не обнаружили достоверной связи наличия a/HCVns3 с частотой МПН и наличием структурных изменений печени у больных ХГС. При анализе частоты подъема АлАт в зависимости от наличия a/HCVns3 были выявлены статистически достоверные различия. Повышение уровня АлАт при наличии a/HCVns3 зарегистрировано в 81% образцов, а при отсутствии a/HCVns3 – в 69% (р=0,026).
Было зарегистрировано увеличение частоты симптомов МПН при наличии a/HCVns5 с 69% до 81%, однако эти различия статистически не достоверны (р=0,264). Выраженность цитолиза при наличии a/HCVns5 существенно возрастала: 56% при отсутствии a/HCVns5 и 90% при наличии a/HCVns5 (р<0,001).
Повышение эхогенности и изменение эхоструктуры печени по данным УЗИ выявлено при наличии a/HCVns5 у 92% больных. При отсутствии a/HCVns5 эхоскопическая патология печени зарегистрирована у 77% больных (р=0,134). Однако по данным биопсии печени выраженный фиброз при наличии a/HCVns5 был выявлен у 79% больных, а при отсутствии a/HCVns5 – у 100% больных (р=0,198). Средний ИГА при наличии a/HCVns5 также был ниже, чем при их отсутствии: 11,72 и 13,33 соответственно.
Необходимо отметить, что выработка антител к неструктурным белкам вируса в первую очередь проявляется повышением уровня АлАт, однако длительный цитолиз ускоряет прогрессирование фиброза печени.
Выводы
При оценке прогноза естественного течения ХГС необходимо исходить из комплекса клинических и вирусологических критериев.
Наиболее значимыми благоприятными прогностическими факторами являются женский пол, молодой возраст в момент инфицирования, низкая исходная доза инфекта, отсутствие привычных интоксикаций и отсутствие a/HCVns5.
Среди неблагоприятных прогностических факторов есть важный корригируемый фактор: наличие привычных интоксикаций. Отказ от употребления наркотических веществ и алкоголя может существенно улучшить прогноз заболевания.
Возраст в момент инфицирования влияет, прежде всего, на развитие гистологических изменений в печени.
Наличие у больного предикторов неблагоприятного течения ХГС говорит о необходимости проведения противовирусной терапии.
