Характерных клинических симптомов H.pylori инфекции в настоящее время выявить не удалось. У большинства людей инфекция протекает бессимптомно, носит персистентный характер и лишь часть инфицированных лиц заболевает манифестными формами хеликобактериоза. В 1994 г. ВОЗ признала H.pylori инфекцию облигатным канцерогеном (канцерогеном 1–го порядка), т. е. ведущим патогенетическим фактором не только язвенной болезни желудка и двенадцатиперстной кишки, но и злокачественной лимфомы желудка (MALToma-Mucosa Associated Lymphoid Tissue lymphoma). Европейские рекомендации по диагностике и лечению хеликобактерной инфекции – так называемый «Маастрихтский консенсус» – были приняты в Маастрихте (Нидерланды) в 1996 г. В последующем были приняты рекомендации «Ма-астрихт-2» в 2000 г., «Mаастрихт-3» в 2005 г. (Флоренция) и в настоящее время действующими являются рекомендации «Mаастрихт-4» (г.Дублин, Ирландия).
Очевидно, что Н.pylori является не единственно возможной причиной возникновения MALToma - и карциномы желудка. Известны и другие триггерные факторы, играющие роль в индукции злокачественной трансформации клеток. Среди них значение вирусов в этиопатогенезе опухолей, показанное еще Л.А.Зильбером, нашло подтверждение после открытия в составе вирусов онкогена и его предшественника протоонкогена, имеющегося в клетках человека.
Известен механизм превращения вирусами, как генетическими паразитами, протоонкогена в онкоген и трансформации нормальной клетки в опухолевую. В первую очередь это касается вирусов, обладающих латентными свойствами, таких как папиллома-вирус (рак кожи), вирус лейкемии Т-клеток человека (Т-клеточная лейкемия), вирус простого герпеса-2 (карцинома шейки матки), вирус Эпштейн-Барр (лимфома Беркитта, назофарингеальная аденокарцинома), цитомегаловирус (рак толстой кишки), саркома Капоши, ассоциированная с вирусом герпеса человека 8 типа, описанная при ВИЧ-инфекции.
Чаще всего латентное состояние вируса связано с тем, что, встраиваясь в геном клетки вирус не экспрессирует на мембране клетки свои антигены (пример, вирусы семейства Herpesviridae, которые могут оставаться латентными и лишь периодически активироваться и реплицироваться). И это при том, что существуют механизмы самозащиты клетки, позволяющие исключить возможность функционирования в ней чужеродного генома. Однако, интегрирование вирусного генома в геном клетки хозяина происходит достаточно часто, если вообще не является общебиологической закономерностью. Это может приводить к состоянию вирогении, при котором потомство инфицированной клетки сохранит в одной из своих хромосом геном вируса. Поскольку это состояние часто фенотипически не проявляется, то чужеродная информация может быть не реализована. Но это не исключает, что при определенных обстоятельствах часть генов чужеродного генома может транкрибироваться и клетка приобретет новые свойства, а в случае интегрирования онкогенного вируса в геном клетки - трансформироваться в злокачественную. В свою очередь, выживаемость таких клоногенных клеток может привести к возникновению опухоли.
Вместе с тем инфекционный процесс, вызванный вирусами, развивается в пределах того или иного органа или ткани, так как большинство вирусов обладают достаточно высокой органной или тканевой тропностью. Известны случаи поражения слизистой оболочки гастродуоденальной зоны обусловленные вирусами группы герпеса [1-4]. Известно и обнаружение фрагментов генома H.pylori в мононуклеарных клетках (МНК) периферической крови при хеликобактериозе, а также и микст-инфицировании-обнаружение H.pylori и вирусов семейства Herpesviridae в МНК [5-7]. H.рylori инфекция и герпесвирусная инфекция приводят к деструкции и метаплазии эпителия желудка и двенадцатиперстной кишки, создает условия длительной персистенции других патогенных микроорганизмов, приводит к развитию дисбиоза. Это обусловлено неспособностью иммунной системы слизистых оболочек гастродуоденальной области справиться с элиминацией патогенных микроорганизмов и патогенных продуктов их жизнедеятельности. Это достигается путём вовлечения в иммунный ответ в очаге воспаления Т-хелперов 1-го типа и провоспалительного пула цитокинов ИЛ-1β, ИЛ-2, ИФγ и др., что, в свою очередь, приводит к дальнейшей деструкции эпителия и lamina propria слизистой оболочки и созданию воспалительного порочного круга.
Цель исследования. Разработать диагностические критерии тяжести течения воспалительных заболеваний гастродуоденальной области вызванные H.рylori и вирусами группы герпеса человека (ВГЧ) 6, 7 и 8 типов, вирусом Эпштейна Барр (ВЭБ), цитомегаловирусом (ЦМВ).
Материалы и методы: Всего обследовано 92 пациентов с различной по выраженности патологии слизистой оболочки желудка (СОЖ) и луковицы двенадцатиперстной кишки (ЛДПК). Выделено было три группы больных.
Критерием для отбора больных в группы служило следующие:
1. группа сравнения - отсутствие признаков воспаления по данным эзофагогастродуоденоскопии (ЭГДС), гистологии и цитологии,
2. группа с поверхностным воспалением СОЖ и ЛДПК (поверхностный гастрит, поверхностный дуоденит),
3. группа с деструктивным воспалением СОЖ и ЛДПК (хронический эрозивный гастрит, хронический эрозивный дуоденит и язва желудка и луковицы двенадцатиперстной кишки).
Всем больным проводилось исследование биопсийного материала слизистой оболочки желудка или двенадцатиперстной кишки (СОЖ и ЛДПК) и мононуклеарных клеток (МНК) периферической крови, регистрируя методом полимеразной цепной реакции (ПЦР) специфические участки генома (ure C,vac A, cag A), характерные для H.pylori, кодирующие факторы патогенности данного микроорганизма - С-субъединицу уреазы, А-субъединицы вакуолизирующего цитотоксина и цитотоксин ассоциированного белка и вирусы группы герпеса человека 6,7 и 8 типов, вирус Эпштейна Барр, цитомегаловирус.
Диагностическая чувствительность способа, обуславливается чувствительностью применяемых ПЦР-тест-систем и находится в пределах 102-103 микробных тел. Из локтевой вены пациента брали 5-10 мл крови с использованием динатриевой соли этилендиаминтетрауксусной кислоты в качестве антикоагулянта в стандартной концентрации, выделяли фракцию мононуклеарных клеток по общепринятой методике на градиенте плотности, выдерживая при комнатной температуре 15-20 минут, наслаивая надэритроцитарную фазу в объеме 2 –2,5 мл на 3 - 4 мл смеси 9% водного раствора фиколла 400 и верографина (р=1.077), центрифугируя при 1500-2000 об/мин в течение 15-20 минут, отбирая интерфазное кольцо, содержащее мононуклеарные клетки, отмывая их в забуференном изотоническом растворе NaCl (pH – 7,2) или растворе Хэнкса по общепринятой методике, клеточный осадок ресуспендируют в 400-600 мкл используемого для отмывки раствора.
Одновременно исследовали биопсийный материал слизистой оболочки, полученный от этого же пациента. Из полученной суспензии клеток выделяют ДНК известными методами, в частности лизированием биопробы раствором гуанидина с последующей сорбцией ДНК на сорбенте, многократной отмывке и ресорбции ДНК, проводят амплификацию с использованием праймеров к специфическим участкам генома H. pylori (ure C, vac A, cag A) и вирусам группы герпеса. МНК исследовали методом ПЦР на наличие тех микроорганизмов, которые обнаружены в бипсийном материале СОЖ и ЛДПК. Осуществляли детекцию продуктов амплификации, после чего делали вывод о наличии участков генома H.pylori и вирусов группы герпеса в биопсийном материале и МНК периферической крови. При совпадении полученных результатов делали вывод о системности и неблагоприятном развитии инфекционного процесса.
Степень тяжести системного поражения оценивалась таким образом:
- Совпадения результатов ПЦР в биопсийном материале и МНК нет, в слизистой оболочке желудка обнаружено не более трех инфекционных агентов - I степень.
- Совпадение результатов ПЦР в биопсийном материале и МНК имеется не более чем по двум инфекционным агентам - II степень.
- Совпадение результатов ПЦР в биопсийном материале и МНК имеется по трем и более инфекционным агентам - III степень.
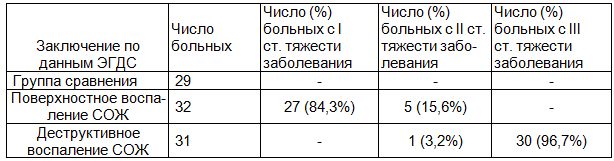
Результаты. Сравнивая результаты определения инфекционных агентов в биопсийном материале СОЖ ,ЛДПК и в МНК позволило определить степень тяжести и системность процесса, обусловленного инфекцией, табл. 1.
Таблица 1. Количество пациентов с различной степенью тяжести заболевания в исследуемых группах
В качестве иллюстрации приводим примеры полученных результатов.
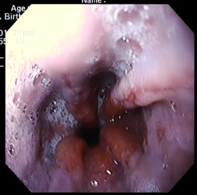
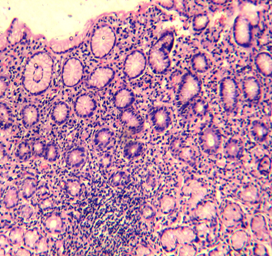
Пример 1. Больной А., 31 лет, обратился к врачу гастроэнтерологу с жалобами на периодические боли умеренной интенсивности в области эпигастрия, изжогу, отрыжку. Болен в течение 3 лет. Весной 2005 г. впервые обратился в поликлинику по месту жительства с жалобами: на боли в области желудка, умеренной интенсивности, изжогу, чувство переполнения желудка после приема пищи, даже в небольших количествах. Установлен клинический диагноз: хронический гастрит в стадии обострения. Лечился амбулаторно, были назначены ультоп, вентер. После лечения некоторое время чувствовал себя удовлетворительно. Осенью этого же года и весной 2009 г. повторно стал отмечать боли в эпигастральной области, изжогу, отрыжку воздухом. Проведена ЭГДС с взятием биопсийного материала СОЖ и ЛДПК. Биологический материал направлен на гистологическое исследование и определение H.pylori методом ПЦР. По данным ЭГДС - Рефлюкс-эзофагит. Гастропатия с гиперплазией (рис. 1, 2). Морфологическое заключение: Хронический неатрофический гастрит, с гиперплазией лимфоидных фолликулов (рис. 3), H.pylori в мазке отпечатке (рис. 4)
 |
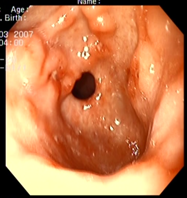 |
| Рис. 1. Рефлюкс-эзофагит. | Рис. 2. Гастропатия с гиперплазией. |
 |
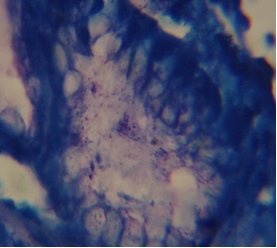 |
|
Рис. 3. Хронический неатрофический гастрит, с гиперплазией лимфоидных фолликулов. Окраска гематоксилином и озином. Увеличение х 400. |
Рис. 4. H.pylori в мазке отпечатке. |
При исследовании методом ПЦР участки генома H.pylori и вирусов герпеса обнаружены в биопсийном материале СОЖ и МНК, табл. 2.
Таблица 2. Результаты ПЦР полученные при исследовании биологического материала СОЖ и МНК периферической крови

Совпадение результатов по двум возбудителям в биоптате и МНК свидетельствует о включении в инфекционный процесс организма в целом, что является неблагоприятным прогностическим признаком развития заболевания. Степень тяжести заболевания - II.
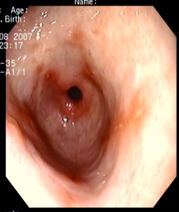
Пример 2. Больной Р., 55 лет, с жалобами на боли в эпигастральной области, ослабевающие после приема пищи, чувство тяжести в желудке, изжогу. Болен в течение 5 лет. При ЭГДС сделано заключение - острые эрозии антрального отдела желудка. Рубцовоязвенная деформация луковицы 12 перстной кишки. Хроническая язва луковицы 12 перстной кишки (рис. 5-6).
 |
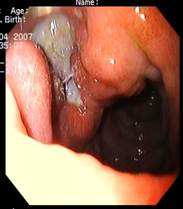 |
Рис. 5-6. Острые эрозии антрального отдела желудка. Рубцовоязвенная деформация луковицы 12 перстной кишки. Хроническая язва луковицы 12 перстной кишки.
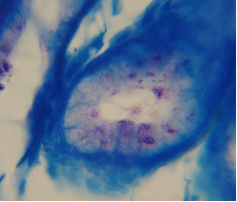
При цитологическом и гистологическом исследовании H. pylori выявлены в большом количестве (рис. 7-8).
 |
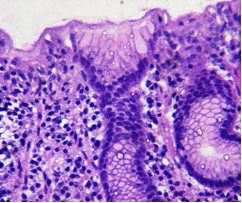 |
| Рис. 7. H. pylori в мазке отпечатке. |
Рис. 8. Хронический атрофический гастрит, высокой степени активности, с дисплазией эпителия желез 1 ст. Окраска гематоксилином и эозином. Увеличение х 400. |
При исследовании методом ПЦР участки генома H.pylori и вирусов герпеса обнаружены в биопсийном материале СОЖ и МНК, табл. 3.
Таблица 3. Результаты ПЦР полученные при исследовании биологического материала СОЖ и МНК периферической крови

Совпадение результатов по трем возбудителям в биоптате и МНК свидетельствует о включении в инфекционный процесс организма в целом, что является неблагоприятным прогностическим признаком развития заболевания. Степень тяжести заболевания – III.
Выводы
Предлагаемые критерии прогнозирования тяжести течения воспалительных заболеваний гастродуоденальной зоны является методом диагностики, отвечающим современным требованиям комплексного подхода к оценке воспалительных изменений непосредственно в СОЖ и степени включения в инфекционный процесс организма в целом, путем оценки инфицированности МНК периферической крови.Полученные данные позволили выявить факт персистенции генома H.pylori и вирусов в МНК при хронических воспалительных заболеваниях гастродуоденальной области его связи с интенсивностью процессов, происходящих в слизистой оболочке.
