Церебральная ишемия (ЦИ) - повреждение мозговой ткани, возникающее в результате недостаточного поступления кислорода. Она встречается у детей первого года жизни в 21-45 % случаев. Наиболее частым ее вариантом является синдром внутричерепной гипертензии, приводящий в дальнейшем в 10-45 % случаев к тяжелой неврологической патологии и инвалидности. Патоморфологически эта патология проявляется стойкой гипоксией мозговой ткани вследствие спазма мелких кровеносных сосудов, снижением уровня кровотока мозга, обменными расстройствами в нервных клетках [1-3].
Большинство исследователей придерживается мнения о том, что главной причиной развития церебральной ишемии является внутриутробная гипоксия, в 80-87% случаев развивающаяся на фоне хронической плацентарной недостаточности (ХПН) [4].
Длительное нарушение кровотока в системе «мать-плацента-плод» приводит к снижению синтеза плацентарных гормонов, стимулирующих рост плода. Нередко при компенсированных и субкомпенсированных формах ХПН реализация симметричных и асимметричных гипотрофий происходит уже во внеутробной жизни ребенка [5].
Целью нашей работы явилось изучение динамики основных биометрических показателей у новорожденных с церебральной ишемией на фоне комплексного лечения с использованием немедикаментозных методов.
Материалы и методы исследования
Под наблюдением находилось 150 детей первого месяца жизни с церебральной ишемией средней степени тяжести, синдромом внутричерепной гипертензии, проходивших этап стационарного лечения в ММУ ДГКБ № 1 им. Н.Н. Ивановой г. Самары в 2009-2010 г. Для оценки эффективности проводимого лечения изучена динамика биометрических показателей.
Для количественных нормально распределённых признаков оценку статистической достоверности проводили при помощи критерия Стьюдента (t). Различия считали достоверными при вероятности ошибки р<0,05. С целью выявления значимости предлагаемых прогностических факторов использовали однофакторный дисперсионный анализ. Для расчета диагностически значимых уровней использовали определение референтных интервалов с применением центрального диапазона, охватывающего 95% величин данных. Обработку полученных результатов исследований проводили с применением пакета прикладных программ «STATISTICA 6.0» [6].
В зависимости от применяемого лечебного комплекса все дети с церебральной ишемией методом рандомизации были разделены на статистически однородные группы по 50 человек в каждой: I и II группы сравнения и III - основную группу.
Лечение всех пациентов проводили согласно приказам Минздравсоцразвития РФ от 07.05.1998 г. № 151 «О временных отраслевых стандартах объема медицинской помощи детям» и № 306 от 28.04.2007 г. «О внесении изменений в приказ МЗ РФ от 07.05.1998 г. № 151 «О временных отраслевых стандартах объема медицинской помощи детям». Все лечебные факторы назначали с учетом сопутствующей патологии и противопоказаний. Из медикаментозных средств применяли сосудистые препараты, ноотропы, витамины группы В, дегидратационную терапию - по показаниям.
Дети с церебральной ишемией, входившие в I группу сравнения, получали стандартный комплекс лечения, включавший медикаментозную терапию и массаж с элементами лечебной физкультуры.
Пациентам II группы сравнения наряду со стандартным комплексом назначали общую магнитотерапию по разработанной нами методике [7]. Процедуры проводили от аппарата «Колибри-эксперт» в конфигурации соленоидов «призма», вращающимся импульсным магнитным полем. Использовали 1 режим воздействия, частота импульсов составляла 100 Гц, величина магнитной индукции - 10% от максимальной. Длительность процедур составляла 8-12 мин., лечение проводили за 30-40 мин. до или через 30-40 мин. после кормления. Курс лечения включал 8-10 процедур, проводимых ежедневно.
Дети III (основной) группы получали стандартную для данной патологии терапию, курс общей магнитотерапии, а после его окончания им назначали курс гипербарической оксигенации (ГБО). Процедуры ГБО проводили в физиотерапевтическом отделении ММУ ДГКБ № 1 им. Н.Н. Ивановой в барокамере БЛКС-3-01. Используемое оборудование соответствовало всем необходимым требованиям и было разрешено Минздравосоцразвития РФ и Госгортехнадзором России для проведения процедур ГБО.
Перед первой процедурой ГБО-терапии родителей детей знакомили с сущностью предстоящего лечения в барокамере, требованиями к одежде ребенка. Перед помещением в барокамеру пациентов переодевали в хлопчатобумажное бельё, на голову надевали хлопчатобумажную шапочку. Для выполнения процедур гипербарической оксигенотерапии детям первых месяцев жизни нами было разработано устройство в виде специального небольшого матраса Г-образной формы, изготовленного из технического поролона, пропитанного огнезащитным составом. Матрас располагался в барокамере, закрывая панели ввода, тем самым не мешая ребенку двигаться и исключая возможность его травматизации [8].
Гипербарическую оксигенацию проводили в атмосфере чистого кислорода без режима вымывания. Давление повышали до 1,2-1,4 атмосфер (ата), со скоростью 0,1 избыточных атмосфер (ати) в 2 мин. Сатурация составляла 15-20 мин. Декомпрессию проводили со скоростью 0,1 ати в 1 мин. Длительность компрессии составляла по 4-8 мин, декомпрессии – 2-4 мин. Длительность процедур составляла 30 мин. Курс лечения включал 8-10 процедур, проводимых ежедневно.
Результаты исследования
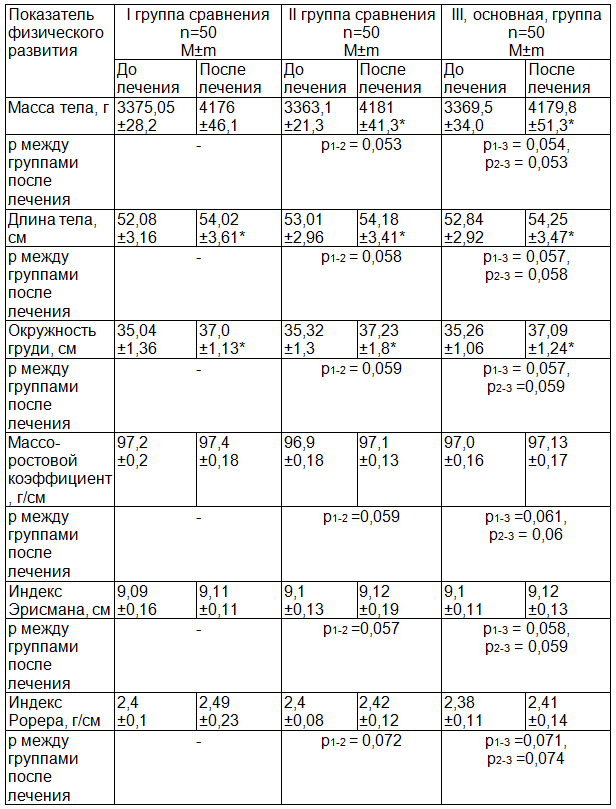
Динамика антропометрических данных больных с ЦИ до лечения и после лечения в возрасте 1 месяца представлена в табл. 1.
Исходно параметры физического развития при рождении наблюдаемых пациентов соответствовали коридору от 25 до 75 центилей и характеризовалось как «средние» для данной возрастной группы.
При сравнительной оценке динамики основных антропометрических показателей у детей после проведенного лечения отмечали их достоверный рост согласно календарному возрасту ребенка (р<0,05). Однако статистически достоверных различий между группами, независимо от выбранной тактики лечения, выявлено не было (p1-2≥0,05, p1-3≥0,05, p2-3≥0,05).
Таблица 1. Динамика антропометрических данных пациентов с ЦИ на фоне проведенного лечения
Примечания: здесь и далее * – различие в группе достоверно (* – р<0,05; ** – р<0,01) по сравнению со значениями до лечения, M - среднее значение признака, m - ошибка среднего значения.
Антропометрические коэффициенты, такие как массо-ростовой, Эрисмана, Рорера, в ходе наблюдения не претерпевали достоверных различий ни по группе (р≥0,05), ни между изучаемыми группами (p1-2≥0,05, p1-3≥0,05, p2-3≥0,05).
Согласно современным литературным данным, синдром внутричерепной гипертензии проявляется увеличением морфологических размеров черепа ребенка и (или) отдельных его частей [1]. Мы изучили основные биометрические параметры черепа детей с ЦИ при поступлении, а также влияние терапии на их динамику. Полученные результаты представлены в табл. 2.
Все показатели при поступлении у пациентов изучаемых групп соответствовали 90-97 центилю, что говорило о «высокой» оценке данного показателя, выходящего за границы возрастной нормы. Статистических различий по группам не отмечали, следовательно, они были сопоставимы по данным показателям (p1-2≥0,05, p1-3≥0,05, p2-3≥0,05).
Окружность головы (ОГ) – один из основных, доступных антропометрических критериев, характеризующих наличие повышенного внутричерепного давления. У пациентов всех изучаемых нами групп при поступлении данный показатель выходил за пределы возрастной нормы. В I группе сравнения он составил 36,22±1,23 см, во II группе сравнения – 36,71±1,31 см, в III, основной, группе – 36,54±1,38 см.
Стабилизация роста ОГ согласно календарному возрасту ребенка на фоне терапии произошла лишь у детей, получавших комплексное лечение с использованием общей магнитотерапии и ГБО. На фоне терапии данный показатель достоверно увеличился с 36,54±1,38 см до 38,01±0,93 см (p3=0,038). У больных I и II групп сравнения размеры головы достоверно увеличивались несоответственно возрасту, значительно превышая календарные нормы прироста для данного показателя. В I группе сравнения – до 40,52±1,03 см, во II группе сравнения – до 38,98 ± 1,1 см с четкой зависимостью от выбранной тактики лечения (p1-2=0,041, p1-3= 0,008, p2-3= 0,045).
Таблица 2. Динамика морфологических показателей черепа у детей с ЦИ на фоне проведенного лечения
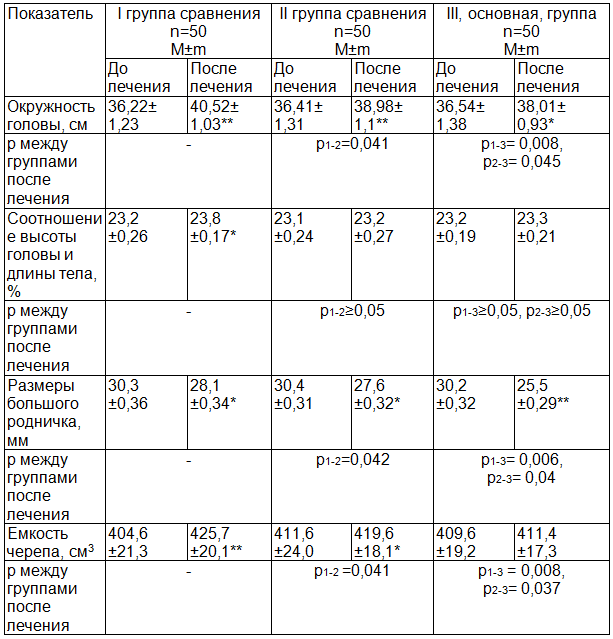
Выявлено наличие корреляционной связи высоких размеров между нефизиологическим ростом окружности головы ребенка с ЦИ и емкости черепа (rxy 1= 0,82, rxy 2= 0,84, rxy 3= 0,83). Таким образом, чем выше ежемесячный прирост ОГ ребенка, тем больше прирост емкости черепа и вероятности вентрикуломегалии.
В ходе исследования установлено достоверное влияние метода лечения на динамику размеров большого родничка у детей изучаемых групп, представленную на рис. 1.
По аналогии с окружностью головы достоверный регресс диагональных размеров большого родничка выявлен у детей III, основной группы. Изучаемый показатель уменьшился с 30,2 ± 0,32 мм до 25,5 ± 0,29 мм (p1-2=0,042, p1-3= 0,006, p2-3= 0,04).
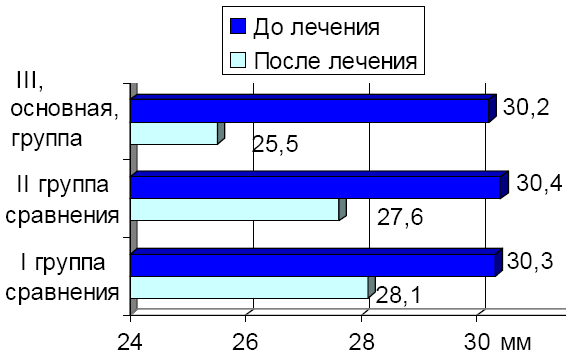
Рис. 1. Регресс размеров большого родничка у детей с ЦИ на фоне лечения.
Таким образом, проведенные нами исследования позволяют говорить о развитии асимметричной гипотрофии с преобладанием ряда морфологических размеров головы у детей с церебральной ишемией, синдромом внутричерепной гипертензии.
Установлено, что включение в лечебный комплекс ГБО и общей магнитотерапии приводит к быстрейшей нормализации черепных биометрических критериев у данной группы пациентов.
