Высокие показатели заболеваемости, инвалидизации и смертности от сосудистых заболеваний головного мозга делает их актуальной и основной проблемой клинической неврологии. На лечение и содержание больных, перенесших мозговой инсульт, затрачиваются колоссальные суммы, в результате чего проблема приобретает как медицинский, так и социальный характер [2,7].
Хорошо известно, что в патогенезе развития сердечно-сосудистых нарушений особое место занимает артериальная гипертония, ожирение, дислипидемия, инсулиннезависимый сахарный диабет или нарушения толерантности к глюкозе. Указанные патологические процессы являются факторами риска развития атеросклероза, который при сочетании нескольких из них возрастает многократно. Хотя частое сочетание упомянутых факторов риска давно отмечалось многими авторами долгое время возможная причинно-следственная связь между ними многими игнорировалась. И только в последнее десятилетие интенсивно развивается концепция, согласно которой сочетание названных выше факторов риска атеросклероза - не случайность, а проявление общего для них метаболического нарушения – повышения резистентности тканей к инсулину [1, 5].
Впервые данную концепцию сформулировал M. Reaven в 1988 г. [13]. Обобщив данные многочисленных исследований, он сделал вывод, что гиперинсулинемия, нарушение толерантности к глюкозе, повышение уровня триглицеридов и понижение уровня липопротеинов высокой плотности в плазме крови, а также артериальная гипертония могут развиваться в результате понижения чувствительности клеток тканей к инсулину. Для обозначения упомянутого симптомокомплекса автор предложил термин "синдром X" [13].
В 1989 г. N.M.Kaplan дополнительно выделил абдоминальное ожирение как важнейший этиологический фактор формирования инсулинорезистентности и, объединив его с тремя основными клиническими последствиями данного метаболического, ввел понятие "смертельный квартет", подчеркнув этим, что наличие подобного сочетания существенно повышает смертность населения от сердечно-сосудистых заболеваний [10].
Начиная с середины 90-х г.г. чаще всего используется термин "метаболический синдром" (МС), предложенный М. Henefeld и W. Leonhardt еще в 1980 г. [11].
Распространенность МС, по данным разных авторов, составляет 5-20%. В связи с тем, что МС представляет собой комплекс метаболических нарушений, патогенетически связанных между собой, чрезвычайно сложно определить первопричину в патогенезе МС [9]. Возможно, первичным звеном патогенеза является нарушение углеводного обмена, которое ранее других видов обмена меняется под воздействием внешних факторов [14]. Возникающая при этом гипергликемия вызывает гиперинсулинемию (ГИ) как компенсаторную реакцию. При истощении адаптационных возможностей ГИ способствует повышению уровня свободных жирных кислот и глюкозы, что приводит к развитию инсулинорезистентности (ИР).
Нельзя исключить, что первичным патогенетическим звеном МС может являться нарушение липидного обмена. При этом снижение поглощения инсулина в печени приводит к развитию ГИ, а затем и к ИР [4].
Абдоминальное ожирение, как самостоятельное заболевание обмена веществ, также ассоциируется с ГИ и ИР и рассматривается некоторыми авторами как основное звено в патогенезе МС [8]. Между ожирением и артериальной гипертонией (АГ) существует тесная патогенетическая связь. На ранних стадиях развития АГ повышенная активность симпатической нервной системы (СНС) вторично может индуцировать ИР. Ожирение предрасполагает к развитию артериальной гипертензии, а артериальная гипертензия способна вызвать снижение чувствительности периферических тканей к инсулину и в последующем ожирение. Вероятность развития АГ у лиц с избыточной массой тела на 50% выше, чем у лиц с нормальной массой тела [6].
В настоящее время доказано, что именно развитие иммунорезистентности и гиперинсулинемии сопровождается развитием дислипидемии, характеризующийся повышением концентрации ЛПОНП (триглицеридов) и понижением концентрации ЛПВП в плазме крови. Данная дислипидемия является атерогенной [4]. В связи с этим нормализация липидного обмена является необходимым компонентом мероприятий по снижению риска сосудистых катастроф.
Целью настоящего исследования было проведение сравнительной оценки гиполипидимической эффективности препаратов группы фенофибрата (липидекс) и симвастатина.
Материал и методы исследования. В обследование было включено 75 больных с ишемическим инсультом, развившийся на фоне метаболического синдрома. Верификация МС проводилась согласно критериям ВОЗ (2003):
Инсулинрезистентность, о наличии которой свидетельствуют:
- Сахарный диабет 2 типа.
- Повышенный уровень глюкозы натощак (> 6,0 ммоль/л).
- Нарушенная толерантность к глюкозе.
Сочетание любых 2 факторов из нижеперечисленных:
- Артериальная гипертензия – систолическое АД > 140 мм рт. ст. и/или диастолическое АД >90 мм рт. ст.
- Гиперлипидемия- триглицериды плазмы > 1,7 ммоль/л.; холестерин ЛПВП < 0,9 ммоль/л у мужчин и < 1,0 ммоль/л у женщин.
- Индекс массы тела > 30 кг/м2 и/или отношение окружность живота/окружность бедер > 0,9 у мужчин и > 0,85 у женщин.
Для решения поставленной задачи обследованные больные были разделены на 2 группы: в 1 группе (52 больных) для коррекции гиперлипидемии нами был использован препарат группы фенофибрата (Липидекс SR) в дозе 250 , во 2 группе (33 больных) симвастатин в дозе 20. Курс лечения составил 8 недель.
Тяжесть заболевания и степень неврологического дефицита оценивали по Американской (NIHSS) шкале тяжести инсульта, степень нарушения сознания – по шкале Глазго. Исследования больных проводились в отделении интенсивной неврологии и реанимационном отделении 1-клиники ТМА. Диагноз полушарного ишемического инсульта (ПИИ) подтверждался компьютерно-томографическими исследованиями у всех 75 (100,0%) больных. Средний возраст всех обследованных нами пациентов составил 61,39±5,2 лет. Средний возраст больных, принимавших фенофибрата составил 61,0±4,9 лет, а больных принимавших симвастатин - 62,2±5,3 лет. Из 75 обследованных 42 (56,7%) больных составили мужчины, 33 (43,3%) - женщины. Половой состав обследованных обеих групп был практически идентичным.
Из 75 больных с полушарными инсультами у 32 (43,33%) ишемические очаги поражения локализовались в правом полушарии, у 43 (56,67%) – в левом полушарии головного мозга.
Все больные с ПИИ поступали в клинику в остром периоде заболевания. В ясном сознании, т.е. в полном сохранном сознании с адекватными реакциями на окружающее поступили 65 (86,66%) больных. Нарушение сознания различной степени выраженности отмечались у 10 больных (13,3%). Из них, согласно оценке степени нарушения сознания по шкале ком Глазго, у 6 (8,3%) больных определялось оглушение – нарушение сознания при сохранности ограниченного словесного контакта на фоне повышения порога восприятия внешних раздражителей и снижения собственной активности. У 3 (5,0%) больных выявлено выключение сознания с сохранностью координированных реакций и открывания глаз на раздражители при возможности эпизодического кратковременного элементарного словесного контакта, т.е. сопор.
Исследование показателей липидного спектра крови проводилось в лаборатории ЦНИЛ. Утром натощак после 12–часового голодания, из локтевой вены больного проводили забор 5,0 мл крови. Показатели липидного обмена определяли, исследуя общий холестерин (ОХС), триглицериды (ТГ), холестерин в липопротеидах высокой плотности (ХС ЛПВП), холестерин в липопротеидах низкой плотности (ХС ЛПНП), холестерин в липопротеидах очень низкой плотности (ХС ЛПОНП) и коэффициент атерогенности (КА) с помощью ферментных наборов.
Изучение липидного спектра проводилось с помощью «VINROS DT60// Chevistry» фирмы «Jonson&Jonson» (сухая химия Чип, реактив Бейтрос Бельгия) - метод фотоколорометрии.
Результаты исследования. Известно, что у больных с МС дислипидемия представлена в виде липидной триады: гипертриглицеридемии, повышения концентрации ЛПНП и снижения уровня ЛПВП, которые, очевидно, являются основополагающими факторами, определяющими его атерогенный потенциал. У включенных в наше исследование больных преобладала смешанная гиперлипидемия (IIb тип). Как видно из таблицы наиболее значимые отклонения отмечены по содержанию триглицеридов. Изменение содержания фракций липидов характеризовалось повышением уровня ЛПОНП и ЛПНП на фоне снижения содержания ЛПВП 1,2 раза. Данные изменения показателей липидного спектра крови повлекла за собой увеличение КА, являющегося интегральным показателем соотношения липидных фракций сыворотки крови. В целом, у больных с ИИ на фоне МС выявлена гиперхолестеринемия с повышением «атерогенных» триглицеридов, ЛПНП, ЛПОНП и КА.
Таблица 1. Динамика показателей липидного спектра на фоне лечения
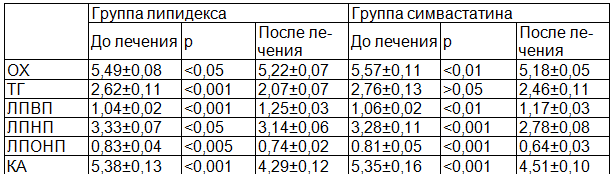
На фоне проведенной терапии параметры липидтранспортной системы изменились следующим образом: уровень ОХ снизился на 7% в группе симвастатина и липидекса на 5,4%. Значительное снижение ТГ (на 21%) сочеталось с повышением уровня ЛПВП в 1,2 раза. В группе симвастатина отмечалось недостоверное снижение уровня ТГ на 10,9% (р>0,05) с повышением ЛПВП в 1,1 раз.
В то же время в группе симвастатина отмечается более значимое снижение уровней ЛПНП и ЛПОНП (на 15,2% и 20,9% соответственно), тогда как в группе липидекса снижение показателей было менее значимым (на 5,7% и 10,8% соответственно).
Таким образом, современное лечение дислипидемии статинами фокусируется на снижении концентрации липопротеидов низкой плотности (ЛПНП) с меньшим влиянием на такие важные показатели, как уровни липопротеидов высокой плотности (ЛПВП) и триглицеридов (ТГ). В результате, несмотря на лечение, остается резидуальный риск сердечно-сосудистых катастроф, что диктует необходимость применения фенофибратов наряду со статинами. Фибраты (липидекс) повышают содержание ЛПВП и снижают ЛПНП и ТГ. Не следует также рассматривать фибраты как гиполипидемические агенты в «чистом» виде. Эта группа препаратов имеет широкий спектр благоприятных нелипидных эффектов, среди которых особый интерес представляют противовоспалительные, антиоксидантные, антикоагулянтные эффекты, влияние на функциональное состояние эндотелия сосудистого русла [12].
В заключение следует отметить, что несмотря на значительный прогресс в лечении дислипидемий статинами, остается ряд факторов риска, которые не получают должного внимания. Фенофибрат (липидекс) представляет собой препарат, который благоприятно влияет на атерогенный профиль липопротеидов и является важной альтернативой или дополнением статинотерапии.
