Введение. Известно, что содержание макро- и микроэлементов во внутренних органах и средах определенным образом отражает гомеостатический статус организма, является весьма точным и чувствительным критерием, позволяющим служить сигналом наступивших в нем патологических изменений [2,3,13]. Именно с этой точки зрения оцениваются сдвиги в содержании ряда микроэлементов в крови при клинических исследованиях [12]. Поддержание постоянства внутренней среды организма предусматривает в первую очередь поддержание качественного и количественного содержания минеральных веществ в тканях органов на определенном уровне [7].
На физиологические процессы оказывает влияние не только недостаток или избыток какого-либо элемента, но очень важным является соотношение элементов между собой. Известно, что кальций в ионизированной форме циркулирует в крови и межклеточной жидкости, участвуя в регуляции нервно-мышечной проводимости, сосудистого тонуса, продукции гормонов, проницаемости капилляров, препятствует депонированию в организме токсинов, тяжелых металлов и радиоактивных элементов. Однако стронций может замещать его в ацинарных клетках слюнных желез в механизме выделения в ротовую жидкость, и может включаться в механизм накопления вместо кальция, конкурируя с ним за включение в кристаллическую решетку оксиапатита кости [13]. Кроме того, к задержке кальция во всех тканях ведет дефицит магния. Магний – элемент, который является активатором для множества ферментативных реакций, регулятором нервно-мышечной проводимости, тонуса гладкой мускулатуры. Пониженное его содержание может вызвать беспокойство, нервозность, страх, а также бессонницу и усталость, судорожные припадки, тремор и другие симптомы. Дефицит магния усугубляется с возрастом, достигая максимума у людей старше 70 лет. Медь и цинк, являясь эссенциальными иммуномодулирующими микроэлементами [8], входят в состав миелиновых оболочек нервов, присутствует в системе антиоксидантной защиты организма, способствуют усвоению железа.
Система всасывания и выделения элементов характеризуется определенными балансовыми параметрами. Адекватное физиологическим условиям всасывание элементов у здорового человека уравновешивается элиминацией, в которую включается удаление элементов из организма, отложение их в клеточные и тканевые депо, в том числе в ротовую жидкость [2,3]. Нет сомнения в том, что обмен микроэлементов в тканях организма регулируется центральной нервной системой. Процессы возбуждения и торможения оказывают влияние на содержание микроэлементов не только в крови и органах, но и в различных отделах мозга. Обмен микроэлементов связан также с активностью вегетативных отделов нервной системы [7]. Однако вопросы элементного дисбаланса при нейродегенеративных изменениях состояниях организма отражены в литературе недостаточно.
Известно, что при болезни Паркинсона (БП) возникает сиалорея, частота которой колеблется по данным различных авторов от 45% до 80% [6]. Хотя ассоциация слюнотечения с болезнью Паркинсона известна еще со времен классической монографии Джеймса Паркинсона, патофизиология сиалореи изучена недостаточно.
Исследованиями различных авторов было показано, что при болезни Паркинсона имеет место как увеличение продукции, так и снижение всасывания, а соотношение серозной и мукозной составляющих не изменяется [16]. Выраженность слюнотечения коррелирует с возрастом пациента, продолжительностью и стадией болезни Паркинсона [1]. Большинство исследователей не обнаруживают влияния допаминергической терапии на выраженность слюнотечения, хотя некоторые авторы считают леводопу препятствующим сиалорее фактором [4,14]. Определение уровня микроэлементов в ротовой жидкости пациентов с БП не проводилось.
Процесс продукции слюны регулируется вегетативной нервной системой. Центры слюноотделения располагаются в продолговатом мозге. Стимуляция парасимпатических окончаний вызывает образование большого количества слюны с низким содержанием белка. Наоборот, симпатическая стимуляция приводит к секреции малого количества вязкой слюны. Слюна продуцируется из плазмы крови путем захвата и фильтрации ее железистыми ацинусами и на этом этапе имеет сходную с плазмой структуру. Затем по мере прохождения в протоки, слюна подвергается электролитической реабсорбции с формированием гипотонического раствора. Такая слюна и попадает в ротовую полость. Гематосаливарный барьер (ГСБ) между кровью и внутренним содержимым слюнных желез высокоизбирателен [10]. Предполагается, что изменение состава смешанной слюны при нейродегенеративных изменениях может являться косвенным признаком того, что аналогичные процессы могут происходить и в определенных клеточных структурах организма человека, и стать биомаркером ранней и пресимптоматической стадии нейродегенеративного процесса.
Нам представляется, что область исследования элементного дисбаланса разных биохимических процессов (особенно секреторных) в организме человека на фоне нейродегенеративных нарушений требует к себе значительно больше внимания ученых и врачей в силу своей чрезвычайной актуальности.
Целью настоящего исследования явилось определение уровня микроэлементов кальция, магния, меди, цинка в ротовой жидкости пациентов с болезнью Паркинсона.
Материалом исследования явились образцы ротовой жидкости 81 пациента БП (46 мужчин, 35 женщин) в возрасте от 54 до 80 лет, находящихся на диспансерном наблюдении в Республиканском клинико-диагностическом центре экстрапирамидной патологии и ботулинотерапии МЗРТ (зав. центром – д.м.н., профессор кафедры неврологии и реабилитации ГБОУ ВПО КГМУ Минздравсоцразвития З.А. Залялова) [5]. Пациенты были разделены на две исследуемые группы. Группу №1 составили первичные пациенты БП, не принимающих препараты леводопы (n=35). Группу №2 - пациенты БП, принимающих препараты леводопы (n=46). Контрольную группу (группа №3) составили образцы ротовой жидкости 36 пациентов, различных по гендерно-возрастному составу, обратившихся в ноябре-декабре 2011 г. в стоматологическую поликлинику Казанского государственного медицинского университета с целью санации полости рта [15].
Методы исследования. Для определения микроэлементов смешанную слюну собирали свободным током без стимуляции утром натощак в стерильные градуированные пробирки в количестве 5 мл [11]. Далее пробирки с биообразцами ротовой жидкости доставлялись в лабораторию Государственного бюджетного учреждения «Республиканский центр независимой экспертизы и мониторинга потребительского рынка» Республики Татарстан для исследования методом масс-спектрометрии с индуктивно связанной плазмой (ИСП-МС) [9]. Использовался масс-спектрометр с индуктивно связанной плазмой Agilent 7500, технические характеристики которого составляют: скорость газового потока через колонку – 1,0–2,0 мл/мин, интервал температур 0–350°С, макс. внутренний диаметр колонки 0,25–0,53 см, чувствительность до 10-14 г.[17].
Для статистической обработки использовался пакет программ SPSS 13.0. Для проверки нормальности распределений использовался критерий Колмогорова-Смирнова. Множественные сравнения проводились с применением критерия Стьюдента с поправкой Бонферони. Данные представлены в виде средней и ее стандартной ошибки (M±m). Различия считали достоверными при р<0,05.
Результаты исследования. Проведенный анализ показал, что содержание кальция в ротовой жидкости у пациентов контрольной группы (группа №3) составляет 82,4±11,55 мг/дм3 (табл. 1), у пациентов с БП (№2) – 80,87±5,63 мг/дм3. Однако, в группе первичных пациентов БП, не принимающих леводопу (группа №1), этот показатель составил 108,24±7,98 мг/дм3 (р=0,034).
Таблица 1. Сравнительная характеристика концентрации микроэлементов ротовой жидкости у пациентов, исследуемых и контрольной групп
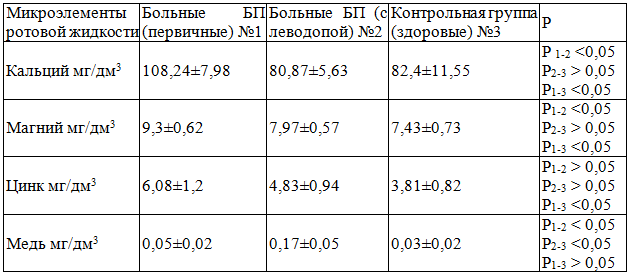
Установлено, что содержание магния в ротовой жидкости у контрольной группы пациентов (№3) составляет 7,43±0,73 мг/дм3, у пациентов с БП (№2)–7,97±0,57 мг/дм3. Однако, в группе первичных пациентов этот показатель составил 9,3±0,62 мг/дм3 (р=0,041).
Содержание меди в ротовой жидкости у контрольной группы пациентов (№3) составляет 0,03±0,02 мг/дм3, у пациентов с БП (№2) – 0,17±0,05 мг/дм3 (р=0,021). В группе первичных пациентов БП (№1) этот показатель составил 0,05±0,02 мг/дм3.
Анализ содержания цинка в ротовой жидкости также свидетельствует о достоверных различиях: у пациентов контрольной группы (№3) содержание Zn составляет 3,81±0,82 мг/дм3, у пациентов с БП (№2) – 4,83±0,94 мг/дм3. В группе первичных пациентов БП (№1) этот показатель составил 6,08±1,2 мг/дм3 (р=0,491).
В результате анализа выявлено статистически значимое отличие показателей групп первичных БП (без леводопы) (№1) и БП (принимающих леводопу) (№2) по: уровню кальция – 108,24±7,98 и 80,87±5,63 (р=0,034), уровню магния - 9,3±0,62 и 7,97±0,57 (р=0,041), уровню меди - 0,05±0,02 и 0,17±0,05 мг/дм3 (р=0,021). Показатели отличия уровня цинка в ротовой жидкости в группах первичных БП (№1) и БП (с леводопой) (№2) недостоверны, однако, несмотря на то, что результаты не попали в предел статистической достоверности, они соответствовали критериям позитивной тенденции.
При сопоставлении показателей контрольной группы (№3) и БП (с леводопой) (№2): уровень кальция 82,4±11,55 и 80,87±5,63 (показатели практически не отличаются), уровень магния 7,43±0,73 и 7,97±0,57 (показатели практически не отличаются), уровень цинка 3,81±0,82 и 4,83±0,94 (показатели практически не отличаются). Выявлено статистически значимое отличие показателей меди в ротовой жидкости у контрольной группы пациентов (№3) и у пациентов с БП (с леводопой) (№2) – 0,03±0,02 и 0,17±0,05 (р=0,021).
Сравнивая концентрации микроэлементов в ротовой жидкости первичных пациентов БП (без леводопы) (№1) с контрольной группой (№3), прослеживается та же корреляционная зависимость: статистически значимое отличие показателей по уровню кальция – 108,24±7,98 и 82,4±11,55 (р=0,034), уровню магния - 9,3±0,62 и 7,43±0,73 (р=0,041), а также уровню цинка - 6,08±1,2 и 3,81±0,82 (р=0,021). Показатели содержания микроэлемента меди в ротовой жидкости в группах первичных БП (№1) и контрольных пациентов (№3) недостоверны, но вполне сопоставимы (0,05±0,02 и 0,03±0,02).
Полученные результаты подтверждают, что микроэлементный состав ротовой жидкости определяется особенностью обменных процессов в его организме. При болезни Паркинсона проницаемость гематосаливарного барьера для кальция, магния и цинка усиливается, что дает нам картину достоверного увеличения содержания этих микроэлементов в ротовой жидкости у первичных пациентов БП по сравнению с контрольной группой. Использование же леводопы у больных с болезнью Паркинсона приближает проницаемость гематосаливарного барьера к функциональному соответствию у здоровых лиц, чем и обусловлены достоверные (или недостоверные) различия в концентрации исследуемых элементов в этой группе пациентов. Тем не менее, влияние леводопы на проницаемость гематосаливарного барьера в отношении меди неоднозначна: при приеме леводопы она усилена (достоверное различие от группы здоровых лиц), а у первичных пациентов БП, не принимающих леводопу, она снижена.
Заключение. При БП возникает не только увеличение выделения слюны и нарушение ее всасывания, но и изменение проницаемости гематосаливарного барьера для ряда микроэлементов. Сиалорея при БП связана с нейроденеративными процессами нигростриарной системы, продолговатого мозга, периферических механизмов регулирования слюнотечения с вовлечением дофаминергических, норадренергических и холинергических механизмов. Показанное в нашем исследовании влияние леводопы на нормализацию содержания некоторых микроэлементов, является тому доказательством.
Закономерным следующим шагом, раскрывающим перспективы элементной саливадиагностики в лабораторной медицине, является создание данных, позволяющих судить о проницаемости гематосаливарного барьера, составление методологических основ лечения различных заболеваний, разработка реабилитационных мероприятий. Мы также прогнозируем, что в данном направлении исследователей может ожидать целый ряд новых, важных для биомедицинской сферы, экспериментальных исследований и клинических наблюдений.
