Актуальность проблемы. Актуальность изучения вертеброгенного поясничного хронического болевого синдрома определяется его клинической, социальной, экономической и научной значимостью [1,2,4,10,11]. Боль в спине остается лидирующей причиной временной нетрудоспособности у лиц трудоспособного возраста, по данным ВОЗ боль в спине признана основной причиной невыхода на работу [9,11, 13, 14]. Перед клиницистами и научными работниками встает вопрос о причинах боли в нижней части спины, причинах перехода острой боли в хроническую, особенностях психического реагирования и функционирования нервной системы у пациентов с болью в спине, понимание которых позволит найти пути эффективного лечения и реабилитации [1,2,4,10]. При клиническом осмотре пациентов с вертеброгенным поясничным хроническим болевым синдромом выявляют две основных группы: пациенты с корешковыми синдромами (с радикулопатией) и пациенты с рефлекторными синдромами (с люмбоишалгией) [10]. Перед исследователями встает вопрос о различии этиологии и патогенеза болевого синдрома у данных групп пациентов, о выборе эффективного метода диагностики и последующего лечения и реабилитации, о прогнозировании исходов болевого синдрома.
При обследовании данной категории пациентов широко используют нейровизуализационные методы, в том числе и магнитно-резонансную томографию (МРТ). Но изменения в позвоночнике, например, обнаружение протрузии диска со сдавлением дурального мешка, узкий позвоночный канал по данным МРТ, возможны у людей без жалоб на боль в нижней части спины [10, 12].
Возникает необходимость исследования не только анатомических структур, но и функциональных характеристик нервной системы [4,10]. Боль является системной реакцией организма [5,6], характер реакции предопределяется свойствами нервной системы. Интегративный характер организации физиологических механизмов боли и клиническая гетерогенность вертеброгенного поясничного хронического болевого синдрома определяют актуальность изучения взаимоотношений физиологических параметров и прогнозирования на их основе характера течения синдрома.
Учитывая интегративный характер организации физиологических и патофизиологических механизмов боли, в качестве значимых показателей для решения задачи прогнозирования могут быть использованы параметры деятельности сенсорных афферентных систем, периферических спинальных нервных центров и изменения гомеостатических показателей [5-8].
Цель исследования: провести оценку прогностической значимости параметров функциональной активности нервной системы у пациентов с вертеброгенным поясничным хроническим болевым синдромом для определения особенностей течения синдрома в клинических подгруппах с помощью метода искусственных нейронных сетей.
Материалы и методы. В исследовании приняло участие 100 человек. Обследуемые были разделены на 3 группы: 1 группа – 40 пациентов с корешковыми синдромами, из них 19 мужчин и 21 женщина, средний возраст 45,4±3,4 года; 2 группа – 40 пациентов с рефлекторными синдромами, из них 18 мужчин и 22 женщины, средний возраст 43,4±3,3 года; 3 группа - 20 лиц, которые не предъявляли жалобы на боли в спине, средний возраст 38,7±1,3 лет. Пациенты 1 и 2 групп получали консервативное лечение в неврологическом отделении ГБУ РО ОКБ. Длительность заболевания в 1 и 2 группах составила 4,05±2,55 года. Обследуемые 1 и 2 группы были госпитализированы в стационар впервые и имели при поступлении выраженный болевой синдром. Наше обследование проводилось на третьей неделе госпитализации, после интенсивного медикаментозного и физиотерапевтического лечения, в стадии стихающего обострения. Все лица давали информированное согласие на участие в исследовании.
У всех пациентов 1 и 2 группы было проведено МРТ-исследование поясничного отдела позвоночника. По данным МРТ-исследования у всех пациентов в обеих группах отмечались признаки дегенеративно-дистрофических изменений в позвоночнике.
Оценка состояния афферентных сенсорных систем проводилась с помощью метода коротколатентных соматосенсорных вызванных потенциалов (ССВП) посредством многофункционального компьютерного комплекса «Нейро-МВП» с математическим анализом полученных результатов. Повышение амплитуд и латентностей ССВП говорит о центральной сенситизации, снижение амплитуд и латентностей указывает на деафферентационные процессы – поражение толстых миелинизированных волокон [1, 3].
Оценка деятельности периферических спинальных нервных центров осуществлялась с помощью анализа параметров поздних нейрографических феноменов (F-волны и H-рефлекса), полученных при проведении стимуляционной электронейромиографии (ЭНМГ) посредством многофункционального компьютерного комплекса «Нейро-МВП».
Оценка гомеостаза, функциональной реактивности организма обследуемых лиц осуществлялась с помощью кардиоинтервалометрии по методу Р.М. Баевского: математического анализа ритма сердца посредством программы «ИСКИМ». Оценивалось состояние вегетативной нервной системы (показатели адекватности процессов адаптации и компенсации (ПАПР), индекс напряжения регуляторных систем (ИН) и показатель адекватности регуляторных систем - ПАРС).
Статистическая обработка результатов исследования проводилась с использованием пакета программ Statistica 6.0. Для описательной характеристики исследуемых групп пациентов применялись непараметрические методы статистики (критерий Мэнн-Уитни, медиана, верхний и нижний квартили). Для моделирования сложных нелинейных отношений между нейрофизиологическими параметрами и их связи с клиническими характеристиками был построен набор из искусственных нейронных сетей с помощью пакета программ Statistica Neural Networks 4.0, что позволило классифицировать исследуемых на кластеры на основе физиологических показателей. В качестве показателей эффективности нейронной сети использовались уровень ошибки, производительность, а также результаты решения задачи классификации. Дополнительному регрессионному анализу подвергались значимые для прогноза переменные (предикторы).
Результаты исследования и их обсуждение. При анализе показателей ССВП (табл. 1) в обеих исследуемых группах отмечается снижение латентностей компонентов по сравнению с группой контроля, что указывает на гиперактивность соматосенсорной зоны коры полушарий головного мозга соответствующей проекции ноги. Гиперактивность в свою очередь может быть косвенным признаком центральной сенситизации. Одновременно с этим в обеих исследуемых группах отмечается снижение амплитуды компонентов, что указывает на повреждение соматосенсорных афферентных проводников на периферии. Отмечается тенденция на более выраженную гиперактивность соматосенсорной зоны коры у пациентов с рефлекторными синдромами по сравнению с пациентами с корешковыми синдромами. Кроме того, в группе 2 отмечалось преобладание снижения латентностей при стимуляции со стороны без боли, что указывает не только на гиперактивность афферентной системы, но и на дезорганизованность ее работы.
Таблица 1. Показатели при исследовании ССВП
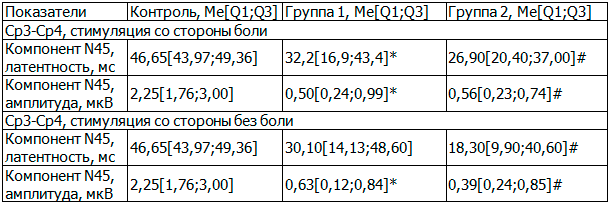
Примечание: здесь и далее *- достоверное различие (р<=0,05) группы 1 по сравнению с группой контроля; # - достоверное различие (р<=0,05) группы 2 по сравнению с группой контроля; ^ - достоверное различие (р<=0,05) между группой 1 и группой 2.
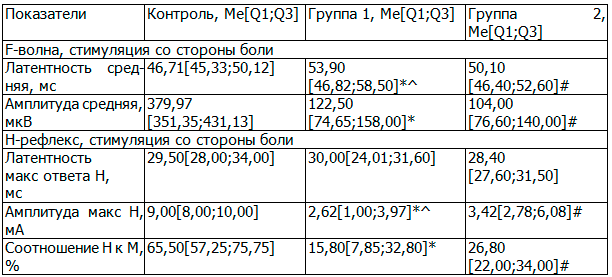
При анализе показателей, полученных при исследовании поздних электрофизиологических феноменов (табл.а 2), установлено, что у пациентов в обеих исследуемых группах при стимуляции большеберцового нерва отмечается снижение возбудимости мотонейронов спинного мозга, генерирующих F-волну. При этом мотонейроны спинного мозга, генерирующие F-волну при стимуляции данного нерва у пациентов с корешковыми синдромами, оказались менее возбудимыми, чем мотонейроны, генерирующие F-волну при стимуляции большеберцового нерва со стороны боли у пациентов с рефлекторными синдромами.
При анализе параметров Н-рефлекса установлено, что в обеих группах отмечается снижение возбудимости сенсорных спинальных центров. Кроме того, полученные данные могут указывать на вертеброгенное поражение задних корешков спинного мозга с уменьшением количества 1а-афферентных волокон и их не значительной демиелинизацией.
Таблица 2. Показатели при исследовании поздних электрофизиологических феноменов
При анализе показателей кардиоинтервалометрии (табл. 3) у пациентов в обеих исследуемых группах отмечается повышение степени централизации в управлении сердечным ритмом, что отражает показатель ИН, и характерно для состояния стресса и тревожности. При этом в группе пациентов с рефлекторными синдромами это соответствует компенсированному дистрессу; в группе пациентов с корешковыми синдромами значение этого показателя выше и соответствует дистрессу, приводящему к функциональным расстройствам.
Таблица 3. Показатели кардиоинтервалометрии у пациентов исследуемых групп и группы контроля, условные единицы
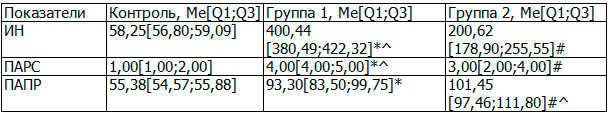
Параметр ПАРС в обеих группах отражает умеренное напряжение регуляторных систем, когда для адаптации организма требуются дополнительные резервы. Но при этом в группе 1 отмечается тенденция к сдвигу в сторону выраженного напряжения регуляторных систем, которое связано с активной мобилизацией защитных механизмов, в том числе и повышении активности симпатоадреналовой системы. Параметр ПАПР отражает соответствие между активностью парасимпатического отдела вегетативной нервной системы и функционированием синусового узла сердца. В группе пациентов с рефлекторными синдромами отмечается повышение парасимпатической активности как в сравнении с группой контроля, так в сравнении с группой пациентов с корешковыми синдромами.
Проведенный регрессионный анализ подтвердил валидность изучаемых физиологических показателей и позволил ранжировать их в порядке значимости для решения задачи классификации пациентов по клиническим подгруппам. Показатели, в порядке убывания их прогностической значимости, включали в себя: индекс напряжения регуляторных систем ИН (r=0,520); средняя латентность F-волны при стимуляции большеберцового нерва с больной стороны (r=0,286); амплитуда Н-ответа (r=0,261); амплитуда Ср N 45 при стимуляции большеберцового нерва с больной стороны (r=0,136); показатель активности процессов регуляции ПАПР (r=0,130); латентность Н-ответа (r=0,125); амплитуда F-волны при стимуляции большеберцового нерва с больной стороны (r=0,097); латентность Ср N 45 при стимуляции большеберцового нерва с больной стороны (r=0,033).
Для моделирования сложных нелинейных отношений между нейрофизиологическими параметрами и их связи с клиническими характеристиками был построен набор из искусственных нейронных сетей. Оптимальными характеристиками обладала нейронная сеть с архитектурой многослойного персептрона (3 слоя промежуточных нейронов) с 12 входными элементами, 13 нейронами в скрытом слое и 2 выходными; с производительностью – 1,0, уровнем ошибки 0,00982. В качестве входных переменных использовались ранее представленные показатели.
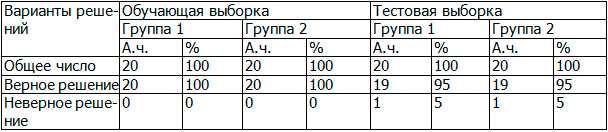
В таблице 4 представлены результаты классификации выборки данной нейронной сетью. В обучающей выборке несоответствие результата классификации, определенного при обработке входных параметров, известному исходному номеру группы, приводило к подстройке синаптических весов элементов искусственной нейронной сети (обучение). В тестовой выборке отражены результаты итогового обучения нейронной сети.
Из таблицы 4 следует, что задача обучения была эффективно реализована в последовательных циклах обучения нейронной сети (отсутствие ошибки в обучающей выборке). При этом в тестовой выборке были сделаны ошибки при распределении исследуемых: к группе пациентов с корешковыми синдромами был отнесен 1 пациент из группы с рефлекторными синдромами, а к группе пациентов с рефлекторными синдромами был отнесен 1 пациент из группы с корешковыми синдромами.
Таблица 4. Результаты работы нейронной сети
Выводы
- Методика искусственных нейронных сетей и регрессионный анализ позволили подтвердить валидность изучаемых физиологических показателей и ранжировать их в порядке значимости для решения задачи классификации пациентов по клиническим подгруппам.
- Наиболее мощным предиктором оказался индекс напряжения регуляторных систем ИН, показывающий степень централизации в управлении сердечным ритмом. Этот показатель отражает степень дистресса и ожидание повреждающего действия стресс-реализующих систем на органы. При дистрессе высока вероятность поддержания «порочного круга» хронического болевого синдрома, низкая приверженность к лечению и низкая эффективность лечения, неблагоприятный прогноз по выздоровлению и реабилитации.
- Статистическая выборка, полученная при анализе групп пациентов, в ряде случаев не совпала с клинической выборкой. Программа STATISTICA при подаче на вход нейронной сети данных для классификации 19-ти пациентов с корешковым синдромом классифицировала их на 2 группы: У 18 человек параметры физиологического обследования соответствовали данным, полученным в ходе клинического обследования, у 1 человека соответствовали рефлекторному синдрому. При анализе данных 19-ти пациентов с рефлекторным синдромом 1 пациент был отнесен к группе с корешковым синдромом.
- Опираясь на классификацию по данным статистической выработки, можно индивидуализировать подход к лечению данной категории пациентов, учитывая, прежде всего особенности функциональной активности нервной системы и адаптационных особенностей организма.
