Актуальность проблемы. Классификация эпилепсии является одним из сложных и непрерывно совершенствуемых вопросов эпилептологии [16]. Основой классификации в настоящее время является анатомо-физиологическая концепция, определение этиологии, выделение электроклинических синдромов [13, 16].
Вместе с тем, комплексное описание состояния больных эпилепсией должно характеризовать тип приступов, их динамику на фоне получаемой пациентами антиконвульсантной терапии, а также особенности психологической сферы, качество жизни, в том числе социальную адаптацию пациентов с эпилепсией [4, 5], а основанная на данных характеристиках адекватная фармакотерапия позволяет снизить прямые экономические затраты при лечении больных [11].
Вместе с тем интегративное описание состояния пациентов требует характеристики объективных нейрофизиологичеких коррелятов когнитивных процессов. Отдельные компоненты вызванных потенциалов (ВП) соотносятся с определёнными стадиями процессов обработки информации: от базовых сенсорных процессов до высших интегративных уровней [15].
Показатели ВП головного мозга, отражая специфические афферентные процессы, находятся в тесной зависимости от деятельности неспецифических модулирующих систем и функционального состояния головного мозга [12, 17]. Исследование когнитивных ВП значимо при эпилепсии, так как данное заболевание может приводить к существенным сдвигам в когнитивной сфере, а длительный приём противоэпилептических препаратов в качестве побочного эффекта имеет снижение когнитивных функций, при этом наиболее часто описываются изменения амплитуды и латентности компонентов потенциала Р300 [14, 19, 20].
Цель исследования: выявить особенности функционирования афферентных и ассоциативных нейрофизиологических механизмов в группах больных эпилепсией с различным течением заболевания.
Материалы и методы. В исследование включено 220 человек; из них 72 практических здоровых человека и 148 больных эпилепсией. Всеми исследуемыми после ознакомления с протоколом исследования (одобрен комитетом по биомедицинской этике ФГБОУ ВО РязГМУ) подписан договор информированного согласия. Среди практически здоровых лиц 47 мужчин и 25 женщин; средний возраст составил 33,1 года, стандартная ошибка средней 0,56 года. Средний возраст больных эпилепсией составил 34,8 года, стандартная ошибка средней 1,08 года, из них 76 мужчины и женщин 72 женщин. Оценивалось среднее число приступов по данным анамнеза за 1 год предшествующий визиту и по данным последующего катамнестического 4-6 месячного наблюдения после проводимой по необходимости коррекции фармакотерапии. Учитывались сложные парциальные приступы (СПП), первично- и вторично-генерализованные приступы (ГП). Оценивалось число принимаемых пациентами антиконвульсантов.
Для пациентов, страдающих эпилепсией, проводилась оценка выраженности тревоги и депрессии по шкале HADS, а также оценка когнитивного статуса (MMSE, батарея лобных тестов - FAB) для балльной оценки соответствующих сфер. Оценка качества жизни проводилась при помощи «Опросника качества жизни при эпилепсии - 31» (QOLIE-31) [8]. Критерии, используемые для оценки, представлены ниже: 0 баллов по сфере «Эмоциональные нарушения» соответствует уровень тревоги или депрессии по шкале HADS 0-3 балла; 1 баллу - тревога или депрессия по шкале HADS 4-6 баллов; 2 баллам - тревога по HADS более 6 баллов или депрессия по шкале HADS более 7 баллов. При оценке когнитивных нарушений 0 баллов соответствует уровень MMSE от 30 до 27 баллов или FAB 17-18 баллов; 1 баллу - MMSE 24-26 баллов или FAB 15-16 баллов; 2 баллам уровень MMSE менее 24 или FAB менее 15 баллов. Оценка социальной адаптации предполагает выделение 0 баллов при оценке шкалы субсферы социальное функционирование (SF) опросника QOLIE-31 от 100 до 80 баллов; 1 балла при оценке субсферы SF QOLIE-31 от 79 до 55 баллов, 2 баллов при оценке субсферы SF QOLIE-31 менее 55 баллов.
Регистрация экзогенных зрительных и слуховых ВП проводилась для оценки деятельности соответствующих сенсорных систем при помощи программно-аппаратного комплекса «Нейро-МВП» ООО «Нейрософт» (Россия, г. Иваново) [2]. Запись зрительных ВП (ЗВП) на шахматный паттерн осуществлялась при расположении активных электродов в отведениях O1, O2, Oz, референтный электрод Fz, заземляющие электроды на ушах, максимальный подэлектродный импеданс составлял 5 кОм. Стимуляция проводилась реверсивным шахматным паттерном на оба полуполя зрения одновременно, угловая величина стимула составила 40 угловых минут, расстояние до экрана 1,5 метра. При анализе оценивались латентность компонентов P50, N75, P100, N145, Р200, а также межпиковая амплитуда P50N75, N75P100, P100N145, N145P200. Регистрировались длиннолатентные слуховые ВП (СВП), использовалась бинауральная стимуляция звуками длительностью 50 мс, наполнением 1000 Гц, частотой 1-1,5 Гц со случайным компонентом. Отводящие электроды располагались на голове пациента в зоне С3, С4, Сz, референтные на мочках ушей (А1, А2), заземляющий электрод располагался на лбу (Fpz); верифицировались пики P1, N1, P2, N2; оценивалась латентность и межпиковая амплитуда волн P1N1, N1P2, P2N2 [2].
Регистрация потенциала Р300 осуществлялась при звуковой стимуляции с частотой и вероятностью незначимого стимула 1000 Гц и 80%, значимого - 2000 Гц и 20%, длительность стимула 50 мс, интенсивность 60 Дб SPL, межстимульный интервал составил 1,5 с. Регистрация и усреднение ответа проводилось по отведениям Pz, Cz, Fz с референтными электродами на ушах (А1, А2), полоса частот составила от 0,5 Гц до 30 Гц, эпоха анализа 750 мс. Испытуемый находился в положении сидя с открытыми глазами, предварительно давалась инструкция о нажатии на кнопку ответа пациента при появлении значимого стимула. Анализировались следующие параметры: латентность пика N2; межпиковая амплитуда P2N2; латентность пика Р3 межпиковая амплитуда N2-P3, также оценивалось среднее время реакции, число верных и неверных нажатий. Условно-негативная волна (УНВ) регистрировалась в парадигме предупреждающего (тон 2000 Гц) и пускового (тон 1000 Гц) стимулов с активной реакцией пациента на появление пускового стимула в виде нажатия на клавишу. Амплитуда УНВ оценивалась также как характеристика деятельности центральных корковых механизмов готовности к моторной реакции [2].
Статистическая обработка данных проводилась при помощи пакета программ Statistica 10.0 Ru [10]. Распределение пациентов на группы осуществлялось методом кластерного анализа (k-средних) [7], сравнительный анализ проводился с использованием непараметрического критерия Манна-Уитни (U), различия считались достоверными при уровне ошибки p<0,05. Для описательной характеристики подгрупп пациентов применялись медиана (Me), верхний (UQ) и нижний квартиль (LQ). Анализ различия параметров между несколькими группами проводился при помощи дисперсионного анализа (теста Краскелла-Уоллиса (H), значимым считался достигнутый уровень р<0,05. При корреляционном анализе использовался ранговый непараметрический критерий Спирмена [18].
Построение, обучение и тестирование искусственных нейронных сетей (ИНС) проводилось при помощи пакета программ Statistica Artificial Neural Networks 10.0; были выделены прогностически значимые факторы (предикторы) для распределения исследуемых на группы в зависимости от результативности деятельности [10, 18].
Результаты исследования. В соответствии с предложенными критериями кластеризации (число СПП и ГП до и после коррекции терапии, число принимаемых антиконвульсантов, балльная оценка эмоциональных, когнитивных нарушений и социальной адаптации) методом K-средних были выделены и охарактеризованы 3 группы испытуемых (рис. 1) В группу 1 вошло 64 человека, в группу 2 - 38 человек, в группу 3 - 46 человек.
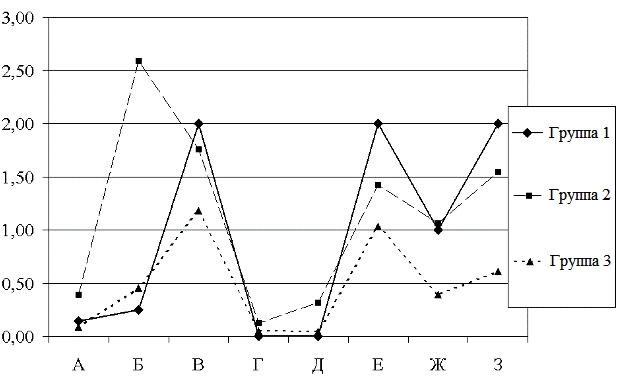
Рис. 1. Характеристика кластеров больных эпилепсией.
Примечание: А - исходное среднее число СПП, Б - исходное среднее число ГП, В - число принимаемых антиконвульсантов, Г - среднее число СПП после коррекции терапии, Д - среднее число ГП после коррекции терапии, Е - эмоциональные нарушения, баллы Ж - когнитивные нарушения, баллы, З - социальная дезадаптация, баллы.
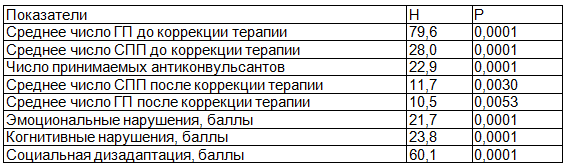
Методом дисперсионного анализа были выявлены достоверные различия между кластерами по изучаемым показателям (табл. 1).
Таблица 1. Клинические и психосоциальные характеристики кластеров больных эпилепсией.
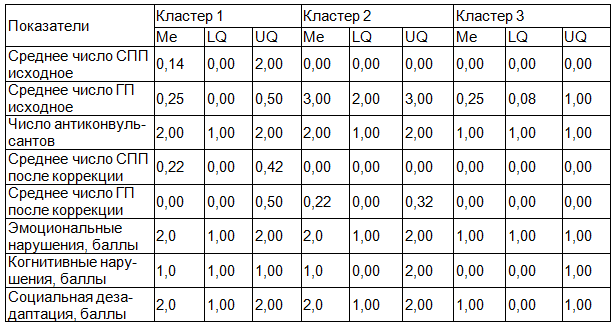
В кластер 1 вошли пациенты с преобладанием СПП до и после коррекции терапии, получающие более 1 антиконвульсанта, с высоким уровнем эмоциональных, когнитивных нарушений и социальной дезадаптации; в группе 2 объединены пациенты с преобладанием ГП, политерапией антиконвульсантами, высоким уровнем эмоциональных, когнитивных нарушений и социальной дезадаптации; в группе 3 наблюдаютя пациенты с высокой эффективностью монотерапии антиконвульсантами, минимальным уровнем эмоциональных, когнитивных нарушений и социальной дезадаптации. Различия между группами по исследуемыми показателям достоверны (табл. 2), в связи с этим пациентов группы 1 и 2 можно обозначить как пациентов с неблагоприятным течением заболевания, а пациенты группы 3 характеризуются благоприятным течением заболевания.
Таблица 2. Статистические критерии различия клинических и психосоциальных характеристик в группах больных эпилепсией
В табл. 3 представлены данные сравнительного анализа показателей экзогенных и когнитивных ВП в контрольной группе и в группе больных эпилепсией. Выявлено достоверное уменьшение амплитудных характеристики и увеличение латентности компонентов ЗВП, СВП, когнитивного вызванного потенциала Р300 и УНВ в группе больных эпилепсией.
Таблица 3. Показатели ВП в контрольной группе и группе больных эпилепсией
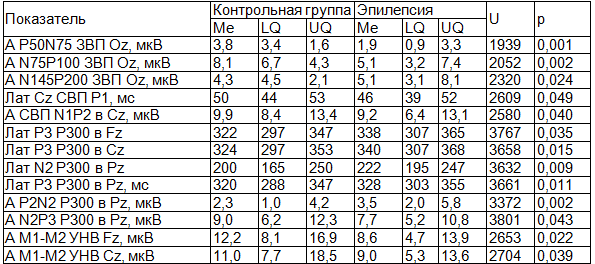
Примечание: здесь и далее А - амплитуда, Лат – латентность.
При анализе различий экзогенных и когнитивных ВП в кластерах больных эпилепсией выявлено достоверное уменьшение амплитуды и увеличение латентности исследуемых компонентов ЗВП, СВП и потенциала Р300 в группе 1 и 2 больных эпилепсией по сравнению с группой 3. Также определяется достоверно более низкая амплитуда УНВ в группе 1 и 2 больных эпилепсией (табл. 4).
Таблица 4. Показатели экзогенных и когнитивных ВП в кластерах больных эпилепсией
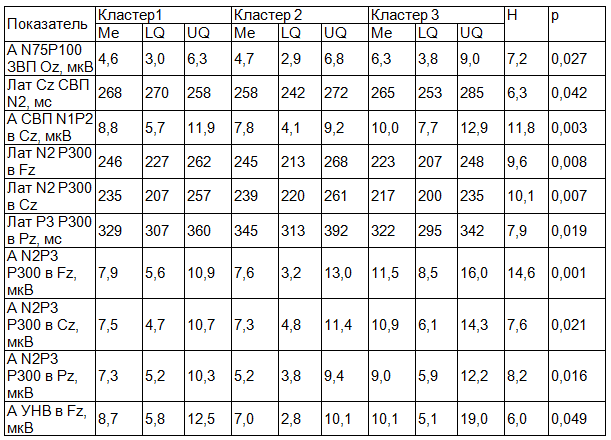
Методом корреляционного анализа были изучены взаимосвязи между показателями ВП в группах больных эпилепсией; данные представлении в форме графических схем в виде корреляционных плеяд. На рис. 2, 3, 4 представлены следующие обозначения: 1 - амплитуда P50N75 ЗВП в Oz, 2 - амплитуда N75P100 ЗВП в Oz, 3 - амплитуда N1P2 СВП в Cz, 4 - латентность N2 P300 в Pz, 5 - латентность P3 P300 в Pz, 6 - амплитуда P2N2 Р300 в Pz, 7 - амплитуда N2P3 P300 в Pz, 8 - амплитуда УНВ в Fz; сплошной линией обозначены положительные корреляции, штриховой - отрицательные; толщина линии соответствует силе корреляции; представлены статистически достоверные связи.
Как следует из рис. 2-4 наибольшее число корреляций определяется в кластере 1 (6 корреляций); в кластер 2 и 3 число корреляций одинаково (4 корреляции).
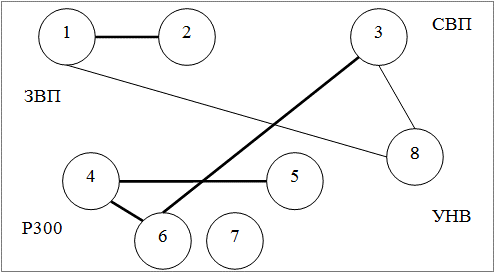
Рис. 2. Взаимоотношения показателей ВП в кластере 1.
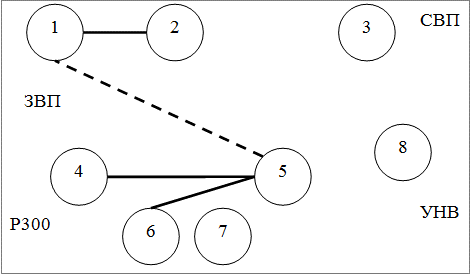
Рис. 3. Взаимоотношения показателей ВП в кластере 2.
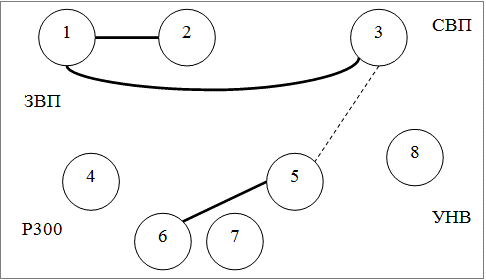
Рис. 4. Взаимоотношения показателей ВП в кластере 3.
Для прогнозирования распределения исследуемых в группы с различным течением заболевания был создан набор ИНС, реализующих решение задачи классификации. Оптимальными характеристиками обладала ИНС, представляющая собой многослойный персептрон, с 25 входными нейронами, 9 нейронами в промежуточном слое и 1 и выходным. Производительность обучения для данной выборки составила 98,5%, контрольная производительность 65%, тестовая производительность 75%. В табл. 5 представлены суммарные характеристики классификационной способности ИНС.
Таблица 5. Суммарные результаты работы ИНС (% верных и неверных решений задачи классификации)
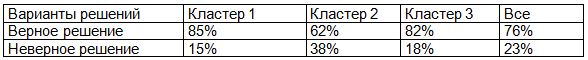
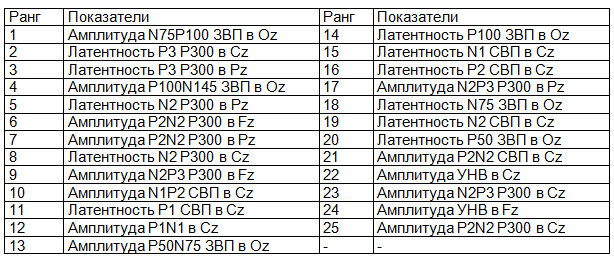
Как следует из табл. 5, задача распределения пациентов в подгруппы эффективно была решена для группы 1 и 3; вместе с тем оказалась достаточно сложной для группы 2. В табл. 6 представлены входные характеристики, используемые ИНС.
Таблица 6. Полный ранжированный перечень показателей, используемых ИНС в качестве входных
Обсуждение результатов. Успешное решение задачи кластеризации с выделением подгрупп, достоверно различающихся по предложенным характеристикам, отражает неоднородность выборки пациентов эпилепсией [3] с выделение кластеров 1 и 2 с неблагоприятным течением заболевания по критериям недостаточной эффективности проводимой антиконвульсантной терапии, уровню эмоциональных, когнитивных характеристик и социальной дезадаптации и кластера 3 с благоприятным течением заболевания.
Более низкий уровень специфической афферентации по данным амплитуды, а также большее время обработки информации по данным латентности экзогенных ВП в группах пациентов с неблагоприятным течением заболевания может быть объяснён как эффектом большего числа антиконвульсантов, так и большей активностью ингибирующих антиэпилептических субсистем [14, 20]. Характеристики когнитивного ВП Р300 как нейрофизиологического коррелята механизмов опознания стимула и принятия решения в его отношении позволяют определить недостаточную активацию ассоциативных зон коры при реализации данных процессов в группах больных с неблагоприятным течением. Амплитуда УНВ в данных группах больных эпилепсией также характеризует недостаточность активации корковых механизмов готовности к деятельности [2, 14].
Анализ взаимодействия показателей ВП позволяет характеризовать сопряжённость физиологических показателей в группах, при этом выявленное в группе 1 больных эпилепсией большее число достоверных корреляций отражает более высокий уровень внутрисистемной напряженности [1, 6, 9].
Физиологические субсистемы реализации сенсорных и ассоциативных когнитивных процессов объединены сложной сетью иерархических, последовательных и циклических связей [15], что требует использования адекватных методов их анализа [18]. Технология ИНС позволила с удовлетворительной эффективностью осуществить классификацию испытуемых на группы с особенностями течения заболевания, что отражает значимость данной группы показателей для характеристики кластеров. Наиболее мощными предикторами классификации по усреднённому рангу оказались показатели деятельности ассоциативных зон коры, что связано с отражением данными показателями характеристик когнитивной деятельности человека, являющихся одним из критериев кластеризации пациентов.
Выводы
- Метод кластерного анализа на основе характеристик частоты приступов, эффективности терапии, психических нарушений и уровня социализации позволяет выявить гетерогенность группы пациентов с выделением кластеров с неблагоприятными и благоприятным течением заболевания.
- Группы больных эпилепсией с неблагоприятным течениям характеризуется снижением уровня специфической афферентации и увеличением времени обработки сенсорной информации, а также снижением мощности биоэлектрогенеза в ассоциативных зонах коры, увеличением длительности реализации механизмов принятия решения в отношении стимула, сниженной активацией моторных зон коры при готовности к моторному ответу.
- Группы больных эпилепсией с неблагоприятным течением заболевания характеризуются большим сопряжением показателей ВП и внутрисистемным напряжением по данным корреляционного анализа.
- Технология нейронных сетей позволяет удовлетворительно решать задачу классификации больных эпилепсией по группам с различными клиническими и психолого-социальным характеристикам на основе показателей деятельности ассоциативных и афферентных систем.
