В последнее время наблюдается существенный рост интереса к использованию блокад периферических нервов, обусловленный внедрением в клиническую практику современного инструментария и малотоксичных местных анестетиков, а также экономической предпочтительностью регионарной анестезии [1, 3]. Достижения в области ультразвуковых технологий значительно увеличили внимание анестезиологов к регионарной анестезии, включая и блокаду седалищного нерва, которая применяется для анестезиологического обеспечения у пациентов при остеосинтезе переломов голени и стопы [5]. Однако на сегодняшний день частота неудач при блокаде седалищного нерва составляет в среднем 20% [18]. Для увеличения успешности манипуляции используют нейростимуляцию и ультразвуковую навигацию (УЗ-навигацию).
Целью нашего исследования явилось сравнение эффективности и безопасности нейростимуляции и ультразвуковой навигации при выполнении блокады седалищного нерва боковым доступом.
Материал и методы. После получения одобрения Этического комитета Северо-Западного государственного медицинского университета имени И.И. Мечникова было обследовано 52 пациента с переломами голени и стопы, разделенных на две сопоставимые по своим характеристикам группы (табл. 1). Для верификации седалищного нерва использовали в первой группе (n=18) группе нейростимуляцию, во второй (n=18) - УЗ-навигацию. Травмы были получены в быту - у 25 (48,1%) пациентов, на производстве 17 (32,7%) пациентов, в результате дорожно-транспортных происшествий — 5 (9,6%) пациентов.
Таблица 1. Характеристика обследованных пациентов

Критерии включения в исследование: получение добровольного информированного согласия пациентов на участие в исследовании, уровень сознания не менее 14 баллов по шкале Глазго, возраст пациента от 20 до 65 лет, риск по шкале американской ассоциации анестезиологов (ASA) I-IIIE, отсутствие аллергических реакций; критерии исключения: нежелание пациента участвовать в исследовании, возраст менее 20 лет или более 65 лет, риск по ASA IV, наличие тяжелой неврологической патологии, сахарный диабет, повышенное внутричерепное давление, индекс массы тела (ИМТ) более 30 кг/м2, беременность, нарушение протокола исследования.
В обеих группах блокаду седалищного нерва выполняли пациенту, находившемуся в положении на спине. Точка вкола находилась на 2-4 см вниз от нижнего края большого вертела по перпендикулярной оси конечности линии от наиболее выступающей части вертела. иглу 22G длиной не менее 10 см вводили вначале перпендикулярно коже, а затем на 10-15° каудально. После отрицательной аспирационной пробы вводили 20-25 мл 0,5% раствора ропивакаина (патент Российской Федерации № 2463086 от 23.12.2010).
Для нейростимуляции использовали аппарат Стимуплекс HNS 12 (B.Braun) в режиме начальной силы тока 0,8-1,0 мА с пошаговым уменьшением. Достаточным считали расположение иглы, при котором моторный ответ сохранялся на импульс 0,3-0,5 мА, для ультразвуковой навигации - аппарат MicroMaxx. (SonoSite).
Оценивали время, затраченное на выполнение блокады (от прокола кожи до окончания инъекции), глубину введения иглы, количество пункций, возникновение дискомфорта у пациентов во время манипуляции.
Развитие сенсорного блока определяли при помощи холодового теста, длительность - от момента инъекции до возникновения болевого синдрома, интенсивностью 4 балла по цифровой аналоговой шкале и выше. Развитие моторного блока определяли, как время от инъекции до потери двигательной активности в области иннервации седалищного нерва.
Периоперационный мониторинг с использованием аппарата Dash 5000 (GE, Medical Systems, USA) включал регистрацию среднего артериального давления (САД), частоты сердечных сокращений (ЧСС), электрокардиограмма (ЭКГ) во II стандартном отведении, насыщения крови кислородом (SpO2). Интенсивность болевого синдрома оценивали по 10-бальной цифровой аналоговой шкале (ЦАШ) [4].
Статистическая обработка полученного цифрового материала выполнялась с помощью «Пакета анализа» Microsoft Excel 2010 стандартного пакета Microsoft Office. Нормальность распределения оценивалась с использованием теста Шапиро-Уилка. При нормальном распределении использовали t-тест Стьюдента, при ненормальном - U-тест Манна-Уитни. Полученные цифровые результаты представлены в виде средних значений параметров и значений стандартной ошибки, вычисленные методом описательной статистики. Значение р<0,05 считалось статистически значимым.
Полученные результаты. Основные результаты, полученные в ходе исследования, представлены на табл. 2.
Таблица 2. Характеристики блокады
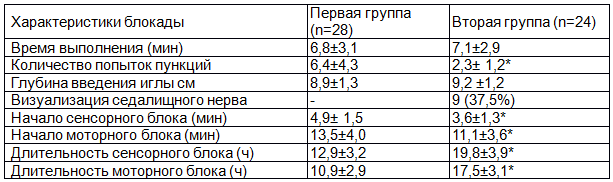
Примечание: * - p< 0.01.
Время, в среднем затраченное на выполнение блокады, между группами достоверно не различалось: 6,8±3,1 мин при нейростимуляции и 7,1±2,9 мин с УЗ-навигацией (р>0.05). Количество попыток пункций составляло в первой группе 6,4±4,3, во второй - 2,3±1,2 (p<0.01). Глубина, на которую вводили иглу, была в группе нейростимуляции 8,9±1,3 см, в группе УЗ-навигации - 9,2 ±1,2 см (р>0.05). Примечательно, что при УЗ-навигации визуализация седалищного нерва была возможна только у 9 (37,5%) пациентов.
Начало сенсорного блока отмечалось в первой группе через 4,9± 1,5 мин, во второй - через 3,6±1,3 мин (p<0.01), моторного блока - через 13,5±4,0 мин и 11,1±3,6мин (p<0.01) соответственно. Сенсорный блок длился в первой группе 12,9±3,2 ч, моторный - 10,9±2,9 ч., во второй группе - 19,8±3,9 ч и 17,5±3,1 ч (p<0.01) соответственно.
На фоне развития блока показатели САД, ЧСС, SpO2 не носили статистически значимого характера.
В процессе выполнения блокады у одного пациента первой группы, несмотря на отрицательную аспирационную пробу, раствор местного анестетика был непреднамеренно введен в сосудистое русло.
Развившиеся нарушение сознания и судорожный синдром, как проявление системной токсичности ропивакаина, были немедленно купированы введением 100 мл 20% липофундина.
Обсуждение полученных результатов. Мы смогли визуализировать седалищный нерв только у 37,5% пациентов. Примерно такие же результаты были получены и в исследовании [6]. Тем не менее, в работе J. Ota et al. [19] седалищный нерв визуализировался у 95% пациентов, однако авторы использовали передний доступ у довольно молодых пациентов (средний возраст 38 лет), не страдающих ожирением - индекс массы тела (ИМТ) - 22,7. В нашем исследовании средний ИМТ составлял 29,3, а средний возраст - 42 г. По нашему мнению, причинами неудач при визуализации седалищного нерва могли быть, наряду с глубоким расположением, изоэхогенность нерва относительно окружающих тканей и акустическая тень бедренной кости.
- F. Liu et al. [15] показали, что УЗ-навигация требует меньшего времени для выполнения блокады по сравнению с нейростимуляцией. Более быстрое выполнения блока с УЗ-навигацией показано в других работах [8, 10, 12]. Тем не менее, также, как и в работах D. Conceição et al. [11] и B. Strub et al. [23], мы не выявили статистической значимости между УЗ-навигацией и нейростимуляцией. Отсутствие разницы по времени выполнения блокады между обеими группами, возможно, обусловлена тем, что только у 37,5% пациентов второй группы была возможна визуализация седалищного нерва.
В ранних работах при сравнении применения УЗ-навигации и нейростимуляции не было выявлено статистически значимой разницы в частоте попыток пункций для блокады периферических нервов [9]. Однако в большинстве последних публикаций показано, что использование УЗ-навигации сопровождается сокращением частоты попыток пункций [10, 25]. Такие же результаты были получены при совместном использовании УЗ-навигации и нейростимуляции по сравнении с одной нейростимуляцией [22].
Полученные нами данные показывают, что количество попыток пункций была значительно выше в первой группе, что вероятно связано с одной стороны, возможностью визуализации нерва при УЗ-навигации, с другой - отсутствием мышечных сокращений, поскольку седалищный нерв, окруженный большим количеством с соединительной ткани, является смешанным, а кончик иглы не затрагивал моторные волокна. По мнению [7] поскольку пункция нерва с использованием нейростимуляции является «слепой» процедурой, то моторный ответ фиксируется не всегда: по данным авторов при силе тока в 1 мА и ниже, несмотря на возникновение парестезий, сокращение мышц отсутствует у 70% пациентов.
Единого мнения относительно времени наступления блока по этому вопросу нет. В одних работах получена статистически значимая разница в пользу УЗ-навигации [21, 24], в других - более короткое время начала в группе нейростимуляци [16], в третьих - различий не зафиксировано [10, 12, 17, 20, 24]. Мы считаем, что более быстрое начало блока при использовании нейростимуляции, выявленное в нашем исследовании, связано именно с периневральным распространением раствора местного анестетика.
Некоторые авторы не выявили различий в продолжительность блока при использовании УЗ-навигации и нейростимуляции [13], тогда как в работе S. Kapral et al. [14] показано преимущество УЗ-навигации. Мы полагаем, что визуализация распространения раствора местного анестетика, позволяющего в ряде случаев добиться симптома «кольца», способствует увеличению длительности сенсомоторного блока.
В нашем исследовании зафиксирован только один случай непреднамеренного введения раствора местного анестетика в сосудистое русло. Своевременное начало и выполнение «липидной» реанимации [2] позволило избежать нежелательных последствий. Случайное введение анестетика в сосуд встречается достаточно редко, так M. Wiegel et al. [26] при блокаде седалищного нерва выявили частоту этого осложнения в 6,6%. Выполнение блокады периферических нервов в условиях УЗ-навигации позволяет не только избежать непреднамеренней пункции кровеносного сосуда, но и наблюдать за распространением раствора местного анестетика.
Заключение. Таким образом, по сравнению с нейростимуляцией использование УЗ-навигация при блокаде седалищного нерва снижает число попыток пункций, позволяет визуализировать седалищный нерв, способствует укорочению времени развития и увеличению длительности сенсомоторого блока, позволяет избежать непреднамеренной пункции сосудов.
